

【化学】安徽省涡阳县第一中学2019-2020学年高二上学期寒假作业化学试题(三)
展开安徽省涡阳县第一中学2019-2020学年高二上学期寒假作业化学试题(三)
可能用到的相对原子质量H:1 C:12 O:16 Na:23 Al:27 Fe:56 Cu:64
一、选择题(每小题只有一个选项符合题意。)
1、据《本草纲目》记载:“生熟铜皆有青,即是铜之精华,大者即空绿,以次空青也。铜青则是铜器上绿色者,淘洗用之。”这里的”铜青”是指( )
A. CuO B. Cu2O C. Cu D. Cu2(OH)2CO3
2、我们生活在千变万化的物质世界里。下列变化中,没有发生氧化还原反应的是( )
3、如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。不正确的是( )
A.氢化物沸点:H2X>H2R
B.含氧酸酸性:HWO>H2RO4
C.气态氢化物的稳定性:HY>HW>H2R
D.离子半径:R2->X2->Y->Z+
4、NA代表阿伏伽德罗常数的值,下列说法正确的是( )
A. 2.8 g铁与0.05 mol Cl2 充分反应,转移0.15NA电子
B. 27 g Al与足量NaOH溶液反应生成33.6 L H2
C. 14 g由乙烯(C2H4)和丙烯(C3H6)组成的混合物中含有原子的数目为3NA
D. 300 mL 0.2 mol/L蔗糖溶液中所含分子数为0.06NA
5、几种不同周期的短周期元素的原子半径及主要化合价如下表:下列说法正确的是( )
元素代号 | X | Y | Z | W |
原子半径/pm | 186 | 143 | 99 | 66 |
主要化合价 | +1 | +3 | +7、-1 | -2 |
A.X、Y元素的金属性:X<Y
C.四种元素形成的简单离子半径:Z->X+>Y3+>W2-
B.Y的单质只能与强酸反应
D.Z的单质与X最高价氧化物的水化物反应的产物之一有漂白性
6、下列有关热化学方程式的叙述正确的是 ( )
A.已知S(s)+O2(g) SO2(g) ΔH1;S(g)+O2(g) SO2(g) ΔH2,则ΔH1<ΔH2
B.含20g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,稀NaOH溶液和稀醋酸的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l) ΔH>-57.4 kJ/mol
C.已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol
D.2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ/mol,2 mol SO2与足量的氧气混合,达平衡时,放出热量为196. 6 kJ
7、氢气用于烟气的脱氮、脱硫的反应 4H2(g)+2NO(g)+ SO2(g)N2(g)+S(l)+4H2O(g) ΔH﹤0 。下列有关说法正确的是( )
A. 当v(H2)= v(H2O)时,达到平衡
B. 升高温度,正反应速率减小,逆反应速率增大,化学平衡逆向移动
C. 使用高效催化剂可提高NO的平衡转化率
D. 化学平衡常数表达式为
8、用括号中的试剂和方法除去各物质中的少量杂质,正确的是( )
A.苯中的甲苯(溴水、分液)B.乙醇中的乙酸(NaOH溶液,蒸馏)
C.乙醇中的水(新制CaO,过滤)D.乙酸乙酯中的乙酸(NaOH溶液,分液)
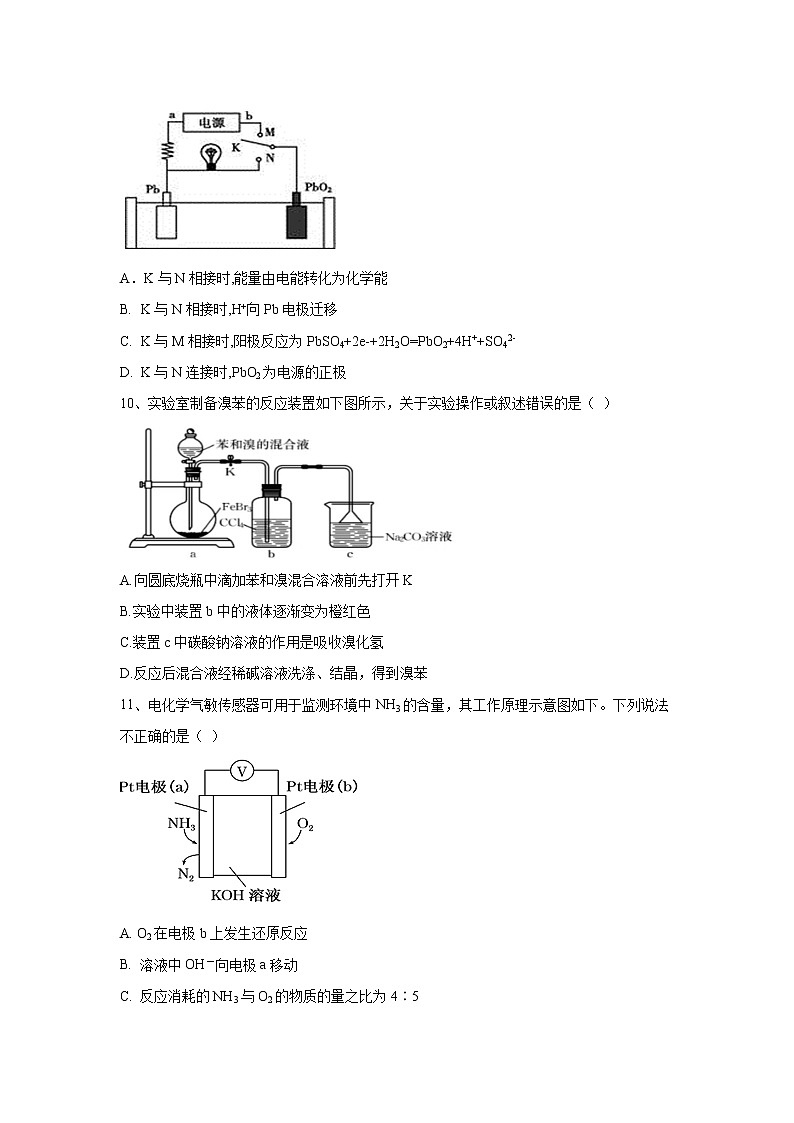
9、如图是铅蓄电池的工作原理示意图,已知放电时电池反应为
PbO2+Pb+4H++2SO42-=2PbSO4+2H2O。下列有关说法正确的是( )
A.K与N相接时,能量由电能转化为化学能
- K与N相接时,H+向Pb电极迁移
- K与M相接时,阳极反应为PbSO4+2e-+2H2O=PbO2+4H++SO42-
- K与N连接时,PbO2为电源的正极
10、实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是( )
A.向圆底烧瓶中滴加苯和溴混合溶液前先打开K
B.实验中装置b中的液体逐渐变为橙红色
C.装置c中碳酸钠溶液的作用是吸收溴化氢
D.反应后混合液经稀碱溶液洗涤、结晶,得到溴苯
11、电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是( )
A. O2在电极b上发生还原反应
B. 溶液中OH-向电极a移动
C. 反应消耗的NH3与O2的物质的量之比为4∶5
D. 负极的电极反应式为2NH3-6e-+6OH-=N2+6H2O
12、下列解释事实的方程式不正确的是( )
A. Na2S水溶液呈碱性:S2-+2H2OH2S+2OH-
B. 0.1 mol·L-1 氨水的pH为11:NH3·H2ONH4++ OH-
C. Al2S3在水溶液中不存在:Al2S3+6H2O === 2Al(OH)3↓+3H2S↑
D. MgO溶于稀硫酸中:MgO+2H+===Mg2++H2O
13、《科学美国人》评出的2016年十大创新技术之一是碳呼吸电池,电池原理如图所示,已知草酸铝[Al2(C2O4)3]难溶于水。则下列有关说法正确的是( )
A.该装置将电能转变为化学能
B. 正极的电极反应为C2O42--2e-=2CO2
C.每生成1molAl2(C2O4)3,有6mol电子流过负载
D.草酸盐溶液中的阳离子移向Al电极
14、已知25℃时,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.3×10-17,将AgCl与AgI的饱和溶液等体积混合,再向混合液中加入足量的浓硝酸银溶液,充分反应,下列说法正确的是 ( )
A.混合液中只有AgI沉淀生成B.混合液中生成AgI沉淀物质的量少于AgCl沉淀
C.常温下,AgCl在NaCl溶液中的溶解度与在纯水中的溶解度相同
D.常温下,AgCl在饱和NaCl溶液中的Ksp比在纯水中的Ksp小
15、对反应aA(g) bB(g)+cC(g),向密闭容器中充入1 mol A,达平衡时,体系中B的体积分数随温度、压强的变化关系如图15所示,下列判断正确的是 ( )
A.P、M两点A的转化率:P>M
B.M、N两点的化学平衡常数:M>N
C.ΔH<0,ΔS>0
D恒温恒容,向P点充入少量A,达新平衡,B%增大
16、某温度下,向10 mL 0.1 mol/L CuCl2溶液中滴加0.1mol/L的Na2S溶液,滴加过程中溶液中−lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是( )
已知:lg2=0.3,Ksp(ZnS)=3×10−25 mol2/L2。
A. a、b、c三点中,水的电离程度最大的为b点
B. Na2S溶液中:c(S2−)+c(HS−)+c(H2S)=2c(Na+)
C. 该温度下Ksp(CuS)=4×10−36 mol2/L2
D. 向100 mL Zn2+、Cu2+浓度均为10−5 mol•L−1的混液中逐滴加入10−4 mol•L−1的Na2S溶液,Zn2+先沉淀
二、填空题
17、为了除去KCl固体中少量的MgCl2、MgSO4,可选用Ba(OH)2、HCl和K2CO3三种试剂,按下图步骤操作:
(1)写出三种试剂的化学式:A________,B________,C________。
(2)①加入过量A的目的是______________,有关化学方程式为___________________。
②加入过量B的目的是______________,有关化学方程式为_________________。
③加热煮沸目的是_____________________________________________。
(3)操作Ⅰ是________,操作Ⅱ是________。
18、某化学兴趣小组同学设计如图装置:
回答下列问题:
(1)乙中铜片为________极 (填“正”或“负”),其电极反应式为________。
(2)一段时间后,将甲和乙两池溶液混合,加入H2O2和一定量稀硫酸后,有Fe(OH)3沉淀出现,但没有Cu(OH)2沉淀出现,此时溶液中c(Fe3+)=2.6×10-18 mol·L-1,求溶液中Cu2+的最大物质的量浓度________。(写出计算步骤)(已知2Fe2++H2O2+2H+=2Fe3++2H2O,Ksp[Fe(OH)3]=2.6×10-39,Ksp[Cu(OH)2]=2.2×10-20)。
(3)丙中电源的A极为________极(填“正”或“负”)。
(4)若丙池盛放足量的CuSO4溶液:
①在丙池铁棒这极的现象是________。
②在丙池中阳极的电极反应是________。
(5)若丙池中盛放滴加少量酚酞的足量的饱和NaCl溶液1L(假设溶液体积电解前后无变化)。
①丙池通电一段时间后,________极附近溶液呈红色(填Fe或C),总反应的离子方程式:________。
②25℃时,当丙池中有0.1mol电子发生转移时切断电源,则理论上标准状况下共有________ L气体生成。此时溶液的pH为________。
19、(1)已知:Ti(s) +2Cl2(g) = TiCl4(l) △H = -804.2 kJ ·mol-1;
2Na(s) +Cl2(g) = 2NaCl(s) △H = -882.0 kJ ·mol-1
Na(s) = Na(l) △H =2.6 kJ ·mol-1
请写出用液态钠与四氯化钛置换出钛的热化学方程式__________________________。
(2)已知:向一个体积恒定为2L的密闭容器中充入4mol A、1mol B,发生如下反应:4A(g)+B(s) 3C(s)+4D(g)。该反应中各物质的摩尔质量(单位g·mol-1)都不一样,在一定条件下该反应2分钟达到平衡。
①不能够说明该反应已达到平衡是:________。
A.恒温下,容器内的压强不再变化
B.恒温下,容器内混合气体的密度不再变化
C.一定条件下,D的体积分数保持不变
D.一定条件下,单位时间内消耗4molA的同时生成1 mol B
②平衡后测得D的浓度为0.3mol·L-1,则从反应开始到平衡时,A的平均反应速率为________,B转化率为________。
(3)用活性炭还原法可以处理氮氧化物,有关反应为:2NO(g)+C(s) N2(g)+CO2(g);△H,向某密闭容器加入一定量活性炭和NO,在t℃下反应,有关数据如图:
| NO | N2 | CO2 |
起始浓度/mol•L─1 | 0.10 | 0 | 0 |
平衡浓度/mol•L─1 | 0.04 | 0.03 | 0.03 |
①在t℃下,该反应的平衡常数为________(保留两位有效数字)。
②平衡后升高温度,再次达到平衡,测得容器中NO、N2、CO2的浓度之比为2:1:1,则该反应的
ΔH________0(填“>”、“<”或“=”),此时NO的转化率为________。
20、现有HA、HB 和H2C三种酸。室温下用0.1mol·L- 1NaOH溶液分别滴定20.00 mL浓度均为0.1mol·L-1的HA、HB两种酸的溶液,滴定过程中溶液的pH随滴入的NaOH 溶液体积的变化如图所示。
(1)原HA中水电离出的c(H+)=________mol·L-1
(2)与曲线I 上的c点对应的溶液中各离子浓度由大到小的顺序为________;b点对应的溶液中c(HB)____c(B-)(填“>”“<”或“=”)。
(3)已知常温下向0.1mol·L-1的NaHC 溶液中滴入几滴石蕊试液后溶液变成红色。
①若测得此溶液的pH=1,则NaHC的电离方程式为_______________。
②若在此溶液中能检测到H2C 分子,则此溶液中c(C2-)________c(H2C)(填“>”“<”或“=”)。
③若H2C的一级电离为H2C=H++HC-,常温下0.1mol·L-1H2C溶液中的c(H+)=0.11mol·L-1,则0.1mol·L-1NaHC溶液中的c(H+)________0.01mol·L-1(填“>”“<”或“=”)。
【参考答案】
一、选择题
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
答案 | D | C | B | C | D | B | D | B |
题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
答案 | D | D | C | A | C | B | C | C |
二、非选择题
17.Ba(OH)2K2CO3HCl除尽Mg2+和SO42—MgCl2+Ba(OH)2===BaCl2+Mg(OH)2↓,MgSO4+Ba(OH)2===BaSO4↓+Mg(OH)2↓除尽过量Ba(OH)2和生成的BaCl2Ba(OH)2+K2CO3===BaCO3↓+2KOH,BaCl2+K2CO3===BaCO3↓+2KCl使HCl挥发过滤蒸发结晶
18.(1). 正
(2). Cu2++2e-=Cu
(3). Ksp[Fe(OH)3]=c(Fe3+)·c3(OH—),c(OH—)===1×10-7 Ksp[Cu(OH)2]=c(Cu2+)·c2(OH—) ,c(Cu2+)===2.2×10-6(mol·L—1) (4). 负
(5). 有红色物质析出
(6). 4OH--4e-=O2↑+2H2O
(7). Fe
(8).
(9). 2.24
(10). 13
19.(1). TiCl4(l) +4Na(l) = Ti(s) +4NaCl(s) △H = -970.2kJ/mol (2). A (3). 0.15mol·L-1·min-1 (4). 15% (5). 0.56 (6). < (7). 50%
20.(1). 10-13 (2). c(Na+)>c(B-)>c(OH-)>c(H+) (3). < (4). NaHC=Na++H++C2- (5). > (6). >








