
【化学】内蒙古巴彦淖尔市乌拉特前旗第一中学2019-2020学年高一上学期第一次月考试卷
展开内蒙古巴彦淖尔市乌拉特前旗第一中学2019-2020学年高一上学期第一次月考试卷
(考试时间:90分钟 总分:100分)
可能用到的相对原子质量: H 1 C 12 N 14 O 16 S 32 Na 23 Cl 35.5 Ca 40
一、选择题(共25小题,每题2分,共50分,每题只有1个选项符合题意)
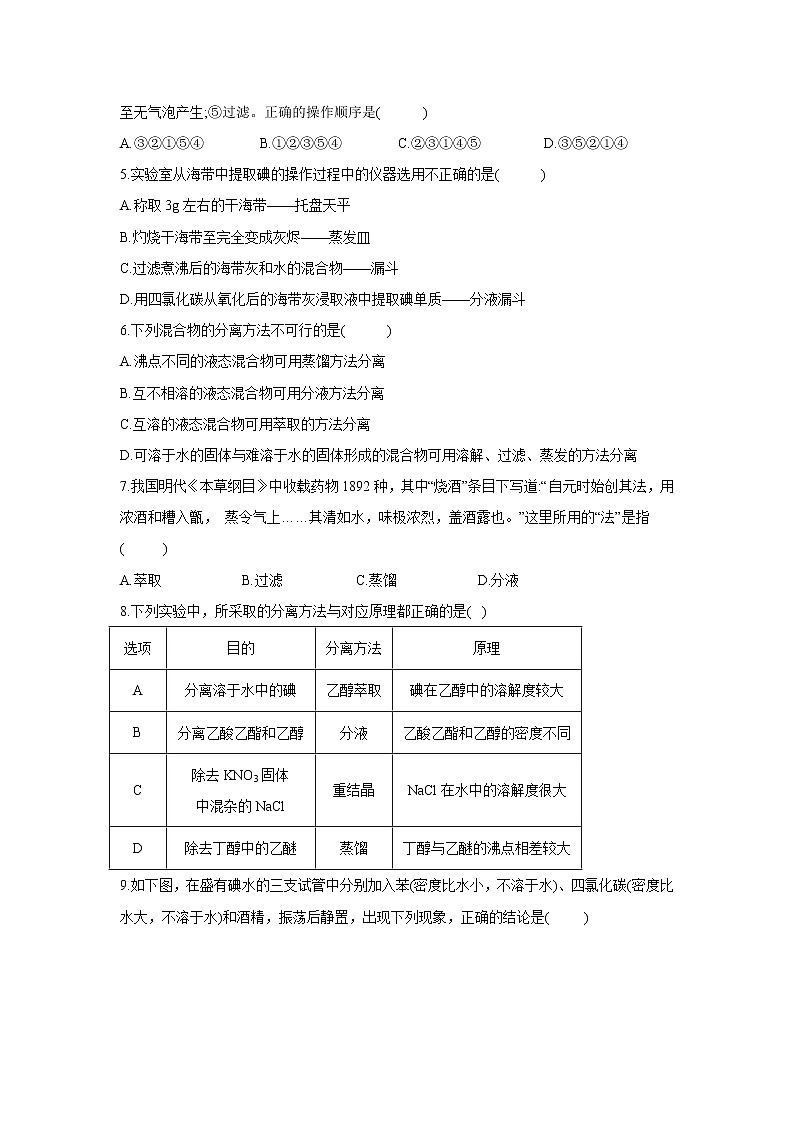
1.对于易燃、易爆、有毒的化学物质,往往会在其包装上面贴上危险警告标签。下面所列物质,贴错了包装标签的是( )
选项 | A | B | C | D |
物质 | 浓硫酸 | 汽油 | 酒精 | 氯酸钾 |
标签 |
2.进行化学实验时必须注意安全,下列说法不正确的是( )
①不慎将酸溅到眼中,应立即用大量水冲洗,边洗边眨眼睛
②不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液
③不慎将浓盐酸洒在桌面上,应立即用浓氢氧化钠溶液冲洗
④配制稀硫酸时,可先在量筒中加入一定体积的水,再边搅拌边慢慢加入浓硫酸
⑤酒精灯着火时可用水扑灭
A.①②③ B.②③④ C.③④⑤ D.全部
3.如图所示是分离混合物时常用的主要仪器,从左至右,可以进行的混合物分离操作分别是( )
A.蒸馏、蒸发、萃取、过滤 B.萃取、过滤、蒸馏、蒸发
C.过滤、蒸发、萃取、蒸馏 D.蒸馏、过滤、萃取、蒸发
4.过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2溶液;④滴入稀盐酸
至无气泡产生;⑤过滤。正确的操作顺序是( )
A.③②①⑤④ B.①②③⑤④ C.②③①④⑤ D.③⑤②①④
5.实验室从海带中提取碘的操作过程中的仪器选用不正确的是( )
A.称取3g左右的干海带——托盘天平
B.灼烧干海带至完全变成灰烬——蒸发皿
C.过滤煮沸后的海带灰和水的混合物——漏斗
D.用四氯化碳从氧化后的海带灰浸取液中提取碘单质——分液漏斗
6.下列混合物的分离方法不可行的是( )
A.沸点不同的液态混合物可用蒸馏方法分离
B.互不相溶的液态混合物可用分液方法分离
C.互溶的液态混合物可用萃取的方法分离
D.可溶于水的固体与难溶于水的固体形成的混合物可用溶解、过滤、蒸发的方法分离
7.我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑, 蒸令气上……其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指( )
A.萃取 B.过滤 C.蒸馏 D.分液
8.下列实验中,所采取的分离方法与对应原理都正确的是( )
选项 | 目的 | 分离方法 | 原理 |
A | 分离溶于水中的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
B | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
C | 除去KNO3固体 中混杂的NaCl | 重结晶 | NaCl在水中的溶解度很大 |
D | 除去丁醇中的乙醚 | 蒸馏 | 丁醇与乙醚的沸点相差较大 |
9.如下图,在盛有碘水的三支试管中分别加入苯(密度比水小,不溶于水)、四氯化碳(密度比水大,不溶于水)和酒精,振荡后静置,出现下列现象,正确的结论是( )
A.①加入的是CCl4②加苯③加酒精 B.①加入的是酒精②加CCl4③加苯
C.①加入的是苯②加酒精③加CCl4 D.①加入的是苯②加CCl4③加酒精
10.用括号中注明的方法分离下列各组混合物,其中不正确的是( )
A.汽油和煤油(蒸馏) B.食盐中的沙子(溶解、过滤)
C.氯化钠和水(过滤) D.花生油和水(分液)
11.完成下列实验所需选择的装置、试剂都正确的( )
| A | B | C | D |
实验 | 分离植物油和氯化钠溶液 | 除去氯化钠晶体中混有的氯化钾晶体 | 分离CCl4中的I2 | 除去CO2气体中的HCl气体 |
装置或仪器 |
12.下列实验操作中错误的是( )
A.蒸发操作时,待混合物中出现大量晶体时,停止加热
B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
13.下列关于蒸馏操作的有关叙述不正确的是( )
A.蒸馏操作的主要仪器是蒸馏烧瓶、酒精灯、铁架台、冷凝管、锥形瓶、牛角管、温度计等
B.蒸馏操作使用的温度计的水银球应插入到液体内
C.在蒸馏烧瓶内放入少量碎瓷片,目的是防止暴沸
D.冷凝管进出水的方向是下口进、上口出
14.按以下实验方案可从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。下列说法错误的是( )
A.步骤(1)需要过滤装置 B.步骤(2)需要用到分液漏斗
C.步骤(3)需要用到坩埚 D.步骤(4)需要蒸馏装置
15.从海带中提取I2的实验流程如图所示,下列说法正确的是( )
A.操作①用到的玻璃仪器有烧杯、玻璃棒、漏斗
B.操作②用到的玻璃仪器有长颈漏斗、烧杯
C.操作③用到的玻璃仪器有烧杯、酒精灯、温度计、 漏斗
D.将操作②中的苯换为酒精可以达到同样的效果
16.下列判断正确的是( )
A.向某溶液中加入AgNO3溶液,生成白色沉淀,可确定有Cl-存在
B.向某溶液中加入氢氧化钠溶液,产生蓝色沉淀,可确定有Cu2+存在
C.向某溶液中加入BaCl2溶液,生成白色沉淀,加稀盐酸沉淀不溶解,可确定有SO42-存在
D.向某溶液中加入稀盐酸,生成的气体能使澄清石灰水变浑浊,可确定有CO32-存在
17.现有含NaCl、Na2SO4和NaNO3的混合溶液,采用下列实验流程加入适当的试剂将其转化为相应的沉淀或固体,实现Cl-、 SO42-和NO3-的相互分离:
其中试剂1、2、4分别为( )
A.氯化钡溶液、硝酸银溶液、硝酸溶液 B.氯化钡溶液、硝酸溶液、硝酸银溶液
C. NaOH溶液、硝酸银溶液、硝酸溶液 D.硝酸银溶液、硝酸钡溶液、硝酸溶液
18.下列叙述中正确的是( )
A.1mol CO的质量是28g B.硝酸的摩尔质量为63g
C.2g氢气所含原子数目为1mol D.铁的摩尔质量就是铁原子的相对原子质量
19.用表示阿伏加德罗常数的值,下列叙述正确的是( )
A.含有NA个氮原子的氮气的体积约为11.2L
B.标准状况下, 11.2L H2O含有的分子数为0.5NA
C.常温常压下,11.2L Cl2含有的分子数为0.5NA
D.常温常压下,64g SO2中含有的原子数为3NA
20.16g X气体含有3.01×1023个分子,则X的摩尔质量为( )
A.16g•mol-1 B.32g C.32 g•mol-1 D.64 g•mol-1
21.设NA为阿伏加德罗常数,如果a g某气态双原子分子的分子数为p,则b g该气体在标准状况下的体积V(L)是( )
A. B. C. D.
22.设NA为阿伏加德罗常数的值,则下列叙述正确的是( )
A. 6.02×1022个H2SO4分子在水中可电离生成2NA个H+
B.在25℃, 101KPa时, 22.4L氢气中含有2NA个氢原子
C.14g氮气中含有7NA个电子
D. NA个一氧化碳分子和0.5mol甲烷的质量比为7:4
23. 设NA为阿伏加德罗常数的值,下列说法正确的是 ( )
A. 28g氮气含有的原子数为NA
B. 4g金属钙变成钙离子时失去的电子数为0.1NA
C. 1molO2分子质量等于1mol氧原子的质量
D. 24g O2和24g O3所含的氧原子数目相等
24.在标准状况下有:①6.72L CH4;②3.01×1023个氯化氢分子;③13.6g硫化氢(H2S);④0.2mol NH3。下列对这四种气体相关量的比较不正确的是( )
A.体积:②>③>①>④ B.密度:②>③>④>①
C.质量:②>③>①>④ D.氢原子数:①>④>③>②
25.对于同温同压下等质量的CO和CO2,下列叙述正确的是( )
A.体积之比为2:1 B.体积之比为7:1 C.所含原子数之比为22:21 D.密度之比为11:7
二、非选择题(本题共5题,共50分)
26.(12分)某同学设计如下实验方案分离KCl和BaCl2两种固体混合物,试回答下列问题:
供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸。
① 试剂a是__________,固体B是__________。(填化学式)
② 操作④的名称是__________。
③ 加入试剂b时反应方程式为____________________________________________。
④ 该方案存在一定的不足,不能完全达到实验目的,应如何改进__________。
⑤ 若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是__________的质量(填A、A1、B、C)。
27.(10分)如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题
① 写出仪器的名称:A._______________,B_______________。
② 实验时A中除加入自来水外,还需加入少量__________________,其作用是____________________。
③ 改正图中两处明显的错误。
ⅰ_____________________________________________;
ⅱ_____________________________________________。
④ 收集完蒸馏水后,是先撤酒精灯还是先停冷凝水?
_________________________________________________。
28.(10分)某化学课外小组以海带为原料制取少量碘水,现用CCl4从碘水中萃取碘并用分液漏斗分离两种
溶液,其实验可分解为如下各步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50 mL碘水和15 mL CCl4加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层水溶液;
G.将分液漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准分液漏斗上口的小孔;
H.静置、分层。
就此实验完成下列填空:
①正确操作步骤的顺序是(填写各操作的编号字母)
__________→__________→__________→A→__________→G→E→F
② 上述步骤E的操作中应注意___________________________________________________________。
③ 上述步骤G操作的目的是_____________________________________________________________。
④ 能用CCl4,从碘水中萃取碘的原因是___________________________________________________。
29.(10分)设用表示阿伏加德罗常数的值,其计算近似值为6.02×1023,按要求完成下列填空:
① 0.5mol NH3共含有__________个原子。
② 6mol H2O与标准状况下________L NH3所含氢原子数相等。
③ 某硫酸钠溶液中含有3.01×1022个Na+,则该溶液中SO42-的物质的量是_________。
④ 标准状况下11.2L NO和_________g NO2所含有的氧原子数相等。
⑤ 0.8g某物质含有3.01×1022个分子,该物质的相对分子质量约为____________。
30.(8分)一定质量的液态化合物AB2与标准状况下一定质量的O2恰好完全反应,
化学方程式为,冷却后,在标准状况下测得生成物的总体积是336mL,
密度为2.56 g•L-1。
① 反应前的体积为__________________。
② 化合物AB2的摩尔质量为________________。
③ 若AB2分子中A、B两元素的质量之比是3:16,则A、B两元素分别为____________(填元素符号,下同)、________________。
【参考答案】
一、选择题(共25小题,每题2分,共50分,每题只有1个选项符合题意)
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
答案 | C | C | D | A | B | C | C | D | D | C |
题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
答案 | A | D | B | C | A | B | A | A | D | C |
题号 | 21 | 22 | 23 | 24 | 25 |
| ||||
答案 | D | C | D | D | C | |||||
二、非选择题
26.(12分)(各2分)
①K2CO3; BaCl2
②蒸发结晶;
③BaCO3+2HCl=BaCl2+CO2↑+H2O
④应在操作②的滤液中加入过量盐酸后再蒸发结晶
⑤沉淀A1或固体B
27.(10分)
①蒸馏烧瓶(1分); 冷凝管(1分)
②沸石(碎瓷片)(1分); 防止暴沸(1分)
③ⅰ温度计水银球位置应在支管口附近(2分)
ⅱ冷凝管进出水方向应是下口进,上口出(2分)
④.先撤酒精灯(2分)
28.(10分)
①C; B; D; H;(各1分)
②使分液漏斗下端管口紧靠烧杯内壁;及时关闭活塞,不要让上层液体流出(2分)
③使分液漏斗内外气压相同,以保证进行E操作时,分液漏斗里的液体能顺利流出(2分)
④CCl4与水不互溶,碘与CCl4不反应,并且碘在CCl4中的溶解度比在水中大得多(2分)
29.(10分)①或2NA; ②89.6; ③0.025mol; ④11.5; ⑤16(各2分)
30.(8分) ①336mL; ②; ③C ; S(各2分)








