

【化学】湖南省邵阳市邵东县第一中学2018-2019学年高一上学期第三次月考试题
展开湖南省邵阳市邵东县第一中学2018-2019学年高一上学期第三次月考试题
本试题卷分为选择题和非选择题两部分,共4页考试范围:第一章--第三章第2节
时量90分钟, 总分100分
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 P-31 Cl- 35.5 Ca-40
一、选择题(每小题只有一个正确答案,每小题3分,共60分)
1.下列有关物质及其用途叙述错误的是( )
A.明矾用作净水剂 B.小苏打做发酵粉
C.氧化钠做潜水、宇航供氧剂 D.浓硫酸用作干燥剂
2.下列现象或新技术应用中,不涉及胶体性质的是( )
A.在饱和氯化铁溶液中逐滴加入NaOH溶液,产生红褐色沉淀
B. 水泥厂、冶金厂用高压电除去烟尘
C. 清晨,在茂密的森林中,常常可以看到从枝叶间透过的一道道光柱
D. 肾衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
3.下列关于物质的分类的说法正确的是( )
A.Fe2O3、 Na2O2 、Al2O3都属于碱性氧化物
B.明矾、纯碱、胆矾都属于盐类
C.醋酸、氨水和水都属于弱电解质
D.液氨、SO2、液态HCl都属于非电解质
4.金属钠长期露置于空气中,最终的产物是( )
A.Na2O B.NaOH C. Na2CO3 D.NaHCO3
5.下列有关NA的说法不正确的是( )
A. 标准状况下的22.4L 氯气与过量的铁加热充分反应,转移电子数为3NA
B. 1 L 0.5 mol/L的CH3COOH溶液中所含H+的数目小于0.5NA
C. 5.6g C2H4和C3H6的混合气体中所含原子数为1.2NA
D. 4.6 g Na 与一定量的O2反应生成的Na2O和Na2O2的混合物时转移电子总数为0.2NA
6.关于氧化还原反应,下列说法正确的是( )
①Na在化学反应中失去1个电子,而Al在化学反应中失去3个电子 ,因此还原性Al>Na;
②还原剂具有还原性; ③没有单质参加的反应一定不是氧化还原反应;
④2Fe+3Cl22FeCl3;Fe+I2FeI2 ,由此可以判断氧化性:Cl2>I2;
⑤氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原.
A.②③④ B.②④ C.①②⑤ D.①②
7.已知在碱性溶液中可发生如下反应: 2R(OH)3 + 3ClO- + 4OH- == 2RO4n- + 3Cl- + 5H2O 。则RO4n- 中R的化合价是( )
A.+3 B.+4 C.+5 D.+6
8.下列反应的离子方程式书写正确的是( )
- 氯化铝溶液与过量氨水反应:Al3++4NH3·H2O== AlO2-+4NH4+ + 2H2O
B.澄清石灰水中通入过量CO2: OH- + CO2 == HCO3-
C. 少量Ba(OH)2溶液和NaHCO3溶液反应:Ba2+ + OH- + HCO3- == BaCO3↓+ H2O
- 钠投入到CuSO4溶液中:2Na + Cu2+ == 2Na+ + Cu
9.在三个等体积的密闭容器中分别充入N2、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p),从大到小的顺序是( )
A.p(N2) > p(H2) > p(O2) B.p(O2) > p(N2) > p(H2)
C.p(N2) > p(O2) > p(H2) D.p(H2) > p(N2) > p(O2)
10.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 0.1mol/L的NaHSO4 溶液中: K+、 NH4+、HCO3- 、NO3-
B.与铝反应产生氢气的溶液中: Na+ 、NH4+、SO42-、 F-
C. 加入Na2O2后的溶液中: Na+ 、 NO3- 、 CO32-、 CH3COO-
D. 在含有AgNO3的溶液中: Fe2+ 、 H+、 Cl- 、 I-
11.有一无色未知溶液中检验出有Ba2+、Ag+,同时又测得其酸性很强.某学生还要鉴定此溶液中是否大量存在①Cu2+ ②Al3+ ③Cl- ④NO3- ⑤NH4+ ⑥CO32-⑦Na+ ⑧Mg2+ ⑨Fe3+,而事实上有部分离子不用鉴定就能加以否定,你认为不必鉴定的是( )
A.③⑤⑥⑨ B.①③⑥⑨ C.③④⑦⑧⑨ D.①②⑨
12. 500mL含有0.6mol/L碳酸钠的溶液和300mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
A.1.0 mol/L B.1.5 mol/L
C.2.0 mol/L D.0.24 mol/L
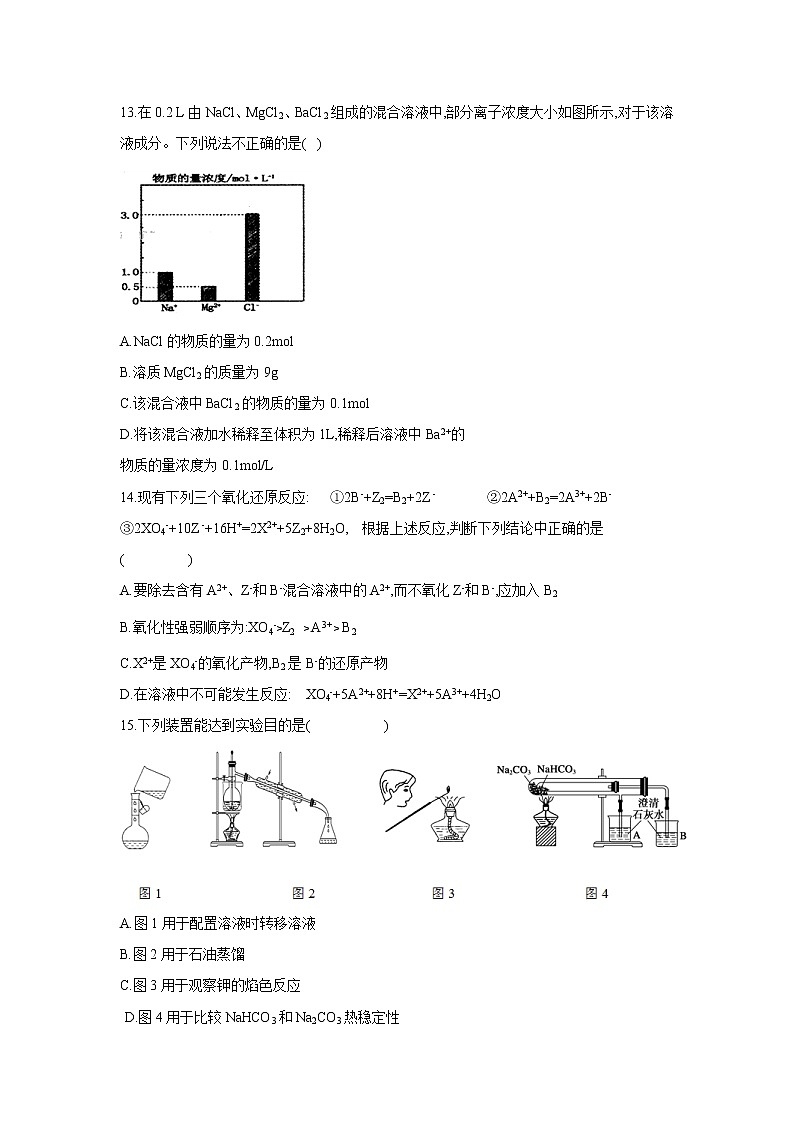
13.在0.2 L由NaCl、MgCl2、BaCl2组成的混合溶液中,部分离子浓度大小如图所示,对于该溶液成分。下列说法不正确的是( )
A.NaCl的物质的量为0.2mol
B.溶质MgCl2的质量为9g
C.该混合液中BaCl2的物质的量为0.1mol
D.将该混合液加水稀释至体积为1L,稀释后溶液中Ba2+的
物质的量浓度为0.1mol/L
14.现有下列三个氧化还原反应: ①2B-+Z2=B2+2Z - ②2A2++B2=2A3++2B-
③2XO4-+10Z -+16H+=2X2++5Z2+8H2O, 根据上述反应,判断下列结论中正确的是( )
A.要除去含有A2+、Z-和B-混合溶液中的A2+,而不氧化Z-和B-,应加入B2
B.氧化性强弱顺序为:XO4-﹥Z2 ﹥ A3+ ﹥ B2
C.X2+是XO4-的氧化产物,B2是B-的还原产物
D.在溶液中不可能发生反应: XO4-+5A2++8H+=X2++5A3++4H2O
15.下列装置能达到实验目的是( )
A.图1用于配置溶液时转移溶液
B.图2用于石油蒸馏
C.图3用于观察钾的焰色反应
D.图4用于比较NaHCO3和Na2CO3热稳定性
16.下列各项操作过程中,发生“先产生沉淀,后沉淀又溶解”现象的是( )
①向Fe(OH)3胶体中逐滴加入过量的稀硫酸
②向AlCl3溶液中通入过量的NaOH溶液
③向Ba(OH)2溶液中通入过量CO2
④向NaAlO2溶液中逐滴加入过量的盐酸
- ①② B. ①②③④ C. ①③ D. ③④
17. 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,
湿法制备的主要反应方程为: 2Fe(OH)3 + 3ClO- + 4OH- == 2FeO42- + 3Cl- + 5H2O;
干法制备的主要反应方程为: 2FeSO4 + 4Na2O2 == 2Na2FeO4 + 2Na2SO4
下列有关说法不正确的是( )
A.干法中每生成1molNa2FeO4转移4mol电子
B.湿法中每生成1molNa2FeO4转移3mol电子
C.高铁酸钾中铁显+3价
D.K2FeO4处理水时,不仅能消毒杀菌,还能吸附水中的悬浮杂质
18.300mLAl2(SO4)3溶液中,含Al3+为1.62g,在该溶液中加入0.1mol/L的Ba(OH)2溶液300 mL ,反应后溶液中SO42-的物质的量浓度为(混合体积看成两液体体积之和)( )
A.0.1mol/L B.0.2mol/L C.0.3mol/L D.0.4mol/L
19.根据表中信息判断,下列选项不正确的是 ( )。
序号 | 反应物 | 产物 |
① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4…… |
② | Cl2、FeBr2 | FeCl3、FeBr3 |
③ | MnO4-…… | Cl2、Mn2+…… |
A.第①组反应的其余产物为H2O和O2
B.第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C.第③组反应中生成1 mol Cl2,转移电子2 mol
D.氧化性由强到弱的顺序为MnO4->Cl2>Fe3+>Br2
20.某同学用Na2CO3和KHCO3组成的混合物进行实验,测得如下数据(盐酸的物质的量浓度相等且不考虑HCl的挥发),下列有关说法正确的是( )
实验序号 | | | | ④ |
盐酸体积/mL | 50 | 50 | 50 | 50 |
固体质量/g | 3.06 | 6.12 | 9.18 | 12.24 |
生成气体体积/L(标况) | 0.672 | 1.344 | 1.568 | 1.344 |
A.盐酸的物质的量浓度为2mol/L
B.原混合物中n(Na2CO3):n(NaHCO3)==1:1
C.实验②中混合物过量
D.实验④反应后,至少需加入40mL的该盐酸才能使12.24g的混合物全部反应
非选择题(每空2分,共40分)
21.(1)在下列物质 6.2g P4 标况下的5.6L CH4 4℃时的9mL H2O ④6.02 × 1022 个CO2 中,所含分子数目由多到少的顺序为_________________________________;(均填序号)
(2) 实验室需要480 mL0.1 mol/L的Na2CO3溶液,现用Na2CO3·10H2O晶体进行配制,需称量____________ g Na2CO3·10H2O;实验中需要的仪器除烧杯和玻璃棒之外,还需用到玻璃仪器有__________________________________, 配制溶液时,下列措施会导致Na2CO3溶液浓度偏高的有_____________________。
A.部分Na2CO3·10H2O晶体失水风化 B.称量Na2CO3·10H2O晶体质量时药品置于右盘
C. 溶液未冷却即转入容量瓶 D.溶液转入前,容量瓶内壁有水未干燥
E. 溶液转移后未洗涤烧杯和玻璃棒 F.定容时俯视读数
G.摇匀后容量瓶内液面下降,继续加水至刻度线
22.医学上常用酸性高锰酸钾溶液和草酸溶液的反应用于测定血钙的含量。回答下列问题:
H+ + MnO4- + H2C2O4 ===== CO2↑ + Mn2+ +
(1).配平以上离子方程式,并在 中填上所需的微粒。
(2).该反应中的还原剂是 (填化学式)。
(3).反应转移了0.4mol电子,则消耗KMnO4的物质的量为 mol。
(4).测定血钙含量的方法是:取2mL血液用蒸馏水稀释后,向其中加入足量(NH4)2C2O4溶液,反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解得到H2C2O4 后,再用KMnO4溶液滴定。
若消耗了1.0×10-4 mol/L的KMnO4溶液20.00mL,则100mL该血液中含钙 g。
23.某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量。
(1) A中试剂为____________________;
(2) 实验前先将铝镁合金在稀硫酸中浸泡片刻,除去合金表面的氧化膜
(3) 检查气密性,将药品和水装入各仪器中,连接好装置后,须进行的操作还有:①记录C的液面位置; ② 将B中剩余固体过滤、洗涤、
干燥、称重; ③ 待B中不再有气体产生并回复至室温后,记录C的液面位置; ④ 由A向B中滴加足量试剂;⑤ 检查装置气密性。
上述操作的先后顺序是 _________________________________(填序号);
记录C的液面位置时,除视线平视外,还应_______________________________________。
(4)B中发生反应的离子方程式为_______________________________________ 。
(5)若实验用铝镁合金的质量为a g,测得生成的氢气的体积为 b mL(标况),B中剩余固体的质量为 c g,则铝的相对原子质量为_________________________。
(6) 实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将____________(填“偏大”、 “偏小”或“不受影响”)
24.雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下离子中的一种或几种: Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-。某同学收集了该地区的雾霾,经必要的预处理后得到试样溶液,设计并完成了如下实验:
已知: NO3- + Al + OH- + _______ NH3 ↑ + AlO2-
(1).完成并配平上面的离子方程式:_____________________。
(2).试样中肯定存在的离子有____________________。
(3).现取10.0mL的试样溶液,向其中加入0.100 mol/L的NaOH溶液,生成沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如下图所示。则:①溶液中还含有的金属阳离子是_________________;.
②bc段发生反应的离子方程式为______________________________________;
③图中④试样溶液中存在的阳离子的物质的量浓度之比为_______________[要标明离子符号,如C(Na+)]。
(4).检验该试样溶液中是否存在Cl-的方法是:_________________
【参考答案】
一、选择题(每小题3分,共60分)
1-5 CABCA 6-10 BDBDC 11-15 BBBAD 16-20 BCADA
二、非选择题(每空2分,共40分)
21.(1) ③>②>④>①
(2)14.3 500mL容量瓶和胶头滴管 A、C、F
- (1) 6 H+ + 2 MnO4- +5 H2C2O4 ===== 10 CO2↑ +2 Mn2+ + 8H2O
(2) H2C2O4
(3) (3) 0.08
(4) (4) 2
23.(1) NaOH溶液
(2)⑤①④③②
(3)使C、D两管液面保持相平
(4) 2Al + 2OH- + 2H2O ==2AlO2- + 3H2↑
(5) 33600(a-c)/b
(6) 偏小
24.(1) 3NO3- + 8Al + 5OH- + 2_H2O 3NH3 ↑ + 8AlO2-
(2)NH4+、Mg2+ 、SO42-、NO3-
(3)①Al3+ ②Al(OH)3+ OH- ==AlO2-+ 2H2O
③ C(NH4+):C(Al3+ ):C(Mg2+ )=4:2:1
(4)取试样溶液少许于试管,加入过量Ba(NO3)2溶液,充分反应后,静置,取上层清液加入硝酸酸化的AgNO3溶液,若生成白色沉淀,则含有Cl-;否则不含Cl-








