

还剩11页未读,
继续阅读
【化学】陕西省西安市远东第一中学2018-2019学年高一10月月月考试题(解析版)
展开
陕西省西安市远东第一中学2018-2019学年高一10月月月考试题
可能用到的相对原子质量:H∶1 C∶12 N∶14 O∶16 Na∶23 Al∶27 S∶32 Cl∶35.5 K∶39 Cu∶64
一、选择题(本题包括24小题,每小题2分,共48分。每小题只有一个选项符合题意。)
1.下列操作或发生事故时的处理方法正确的是( )
A. 可用燃着的酒精灯引燃另一只酒精灯
B. 给试管里的液体加热时,试管应与桌面垂直
C. 配制一定浓度的NaCl溶液时,定容振荡摇匀后,发现液面低于刻度线,再加水到刻度线
D. 浓硫酸不慎沾在皮肤上,应立即用大量水冲洗,最后涂上3%~5%的小苏打溶液
【答案】D
【解析】A、用燃着的酒精灯引燃另一只酒精灯,容易造成酒精着火,容易发生火灾,应该用火柴点燃,选项A错误;B、若给试管里的液体加热,液体体积一般不超过试管容积的,试管跟桌面成45°角,先使试管均匀受热,然后小心地在试管里液体的底部加热,试管不能与桌面垂直,选项B错误;C、定容后不能再加水,这样会使配制的溶液浓度偏低,选项C错误;D、浓硫酸具有很强的腐蚀性,如果浓硫酸不慎沾在皮肤上,应立即用干布擦掉,然后用水冲洗,最后再涂上3%~5%的小苏打溶液,选项D正确。答案选D。
2.下列实验操作中正确的是 ( )
A. 蒸发操作时,应使混合物中的水分完全蒸干后才能停止加热
B. 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶支管口处
C. 分液操作时,分液漏斗中下层液体从下口放出后,再将上层液体从下口放出到另一个烧杯
D. 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
【答案】B
【解析】A.蒸发时待大量晶体析出时,停止加热,利用蒸发皿的余热把剩余的水蒸干,A错误;B.进行蒸馏操作时温度计测量蒸汽的温度,应使温度计水银球靠近蒸馏烧瓶的支管口处,B正确;C.为防止液体污染,分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出,C错误;D.萃取剂不一定是有机溶剂,萃取剂的选择与密度无关,D错误,答案选B。
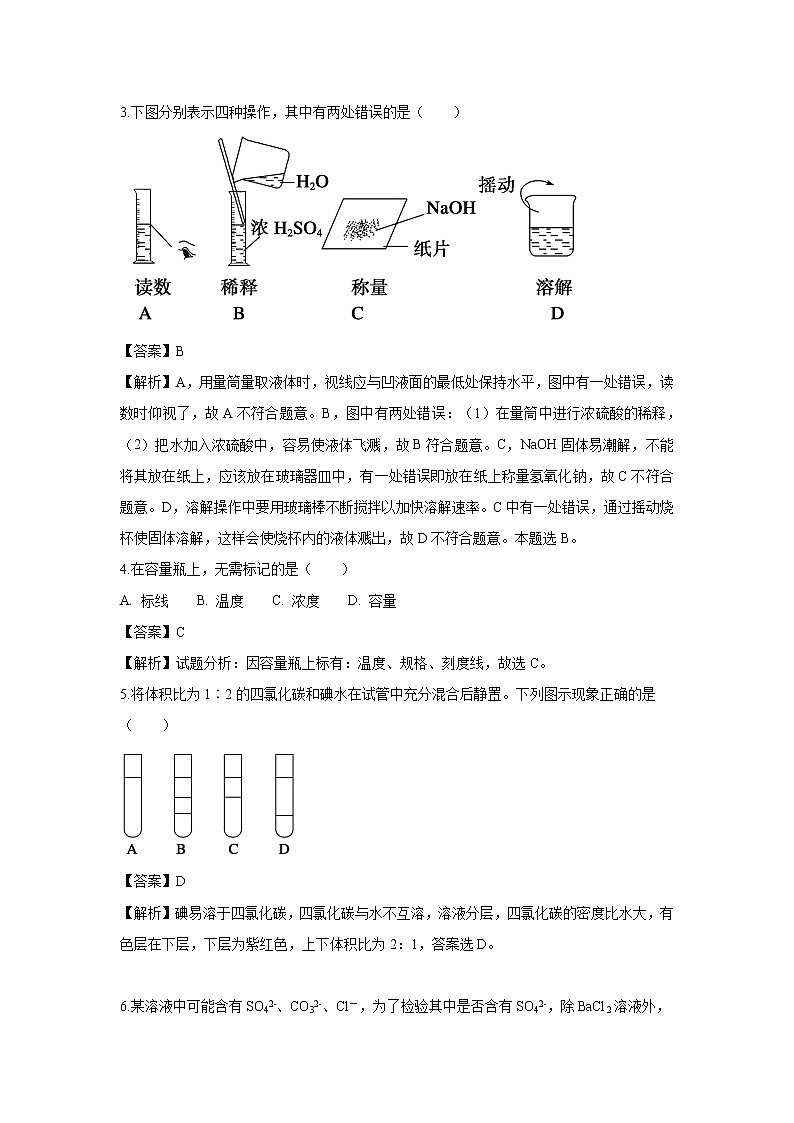
3.下图分别表示四种操作,其中有两处错误的是( )
【答案】B
【解析】A,用量筒量取液体时,视线应与凹液面的最低处保持水平,图中有一处错误,读数时仰视了,故A不符合题意。B,图中有两处错误:(1)在量筒中进行浓硫酸的稀释,(2)把水加入浓硫酸中,容易使液体飞溅,故B符合题意。C,NaOH固体易潮解,不能将其放在纸上,应该放在玻璃器皿中,有一处错误即放在纸上称量氢氧化钠,故C不符合题意。D,溶解操作中要用玻璃棒不断搅拌以加快溶解速率。C中有一处错误,通过摇动烧杯使固体溶解,这样会使烧杯内的液体溅出,故D不符合题意。本题选B。
4.在容量瓶上,无需标记的是( )
A. 标线 B. 温度 C. 浓度 D. 容量
【答案】C
【解析】试题分析:因容量瓶上标有:温度、规格、刻度线,故选C。
5.将体积比为1∶2的四氯化碳和碘水在试管中充分混合后静置。下列图示现象正确的是( )
【答案】D
【解析】碘易溶于四氯化碳,四氯化碳与水不互溶,溶液分层,四氯化碳的密度比水大,有色层在下层,下层为紫红色,上下体积比为2:1,答案选D。
6.某溶液中可能含有SO42-、CO32-、Cl-,为了检验其中是否含有SO42-,除BaCl2溶液外,还需要的溶液是( )
A. H2SO4 B. HCl C. NaOH D. NaNO3
【答案】B
【解析】试题分析:只加可溶性钡盐,不酸化,误将CO32-等干扰离子判成SO42-,所以应先加盐酸酸化,然后加入BaCl2溶液,故选B。
7.下列括号中的分离方法运用得当的是( )
A. 植物油和自来水(蒸馏)
B. 水溶液中的食盐和碘(分液)
C. CaCO3和CaCl2(溶解、过滤、蒸发)
D. 自来水中的杂质(萃取)
【答案】C
【解析】试题分析:A.植物油和水是互不相溶的两层液体,应该适应分液的方法分离,错误。B.水溶液中的食盐和碘,可以利用碘容易溶于有机物苯,而苯与水互不相溶的性质,用萃取的方法分离,错误。C.CaCO3难溶于水,CaCl2容易溶于水,可以加上溶解然后过滤得到CaCO3,再蒸发结晶得到CaCl2,正确。D.自来水中的杂质溶于水的可以采用蒸馏的方法分离除去,难溶性物质才用过滤的方法分离除去,错误。
8.下列说法中,不正确的是( )
A. 1 mol任何物质都含有6.02×1023个原子
B. 0.012 kg 12C约含有6.02×1023个碳原子
C. 阿伏加德罗常数表示的粒子“集体”就是1 mol
D. 使用摩尔这一单位时必须指明粒子的名称
【答案】A
【解析】试题分析:A.1mol任何由原子构成的物质都含6.02×1023个原子,若物质的构成微粒不是原子,则不一定是含6.02×1023个原子,错误;B.根据规定可知0.012kg12C所含有的碳原子的物质的量是1mol,所含有的碳原子数为阿伏加德罗常数,近似值是6.02×1023,正确;C.阿伏伽德罗常数个粒子的“集体”的物质的量就是1mol,正确;D.摩尔是物质的量的单位,其使用范围是微粒,使用使用摩尔这一单位时必须指明微粒的种类,正确。
9.下列叙述中正确的是( )
A. 1 mol CO的质量是28 g·mol-1
B. 硫酸根离子的摩尔质量是98 g
C. Cl2的摩尔质量是71 g·mol-1
D. NaCl的相对分子质量是58.5 g·mol-1
【答案】C
【解析】A、1mol一氧化碳的质量为28g,28g•mol-1为一氧化碳的摩尔质量,故A错误;B、硫酸根离子的摩尔质量为98g/mol,98g为1mol硫酸的质量,故B错误;C、氯气的相对分子质量为71,其摩尔质量为71g/mol,故C正确;D、相对分子质量单位为1,省略不写,氯化钠的相对分子质量为58.5,58.5 g•mol-1为氯化钠的摩尔质量,故D错误;故选C。
10.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 含有NA个氦原子的氦气在标准状况下的体积约为11.2 L
B. 25℃,1.01×105 Pa,64 g SO2中含有的原子数为3NA
C. 在常温常压下,11.2 L Cl2含有的分子数为0.5 NA
D. 标准状况下,11.2 L H2O含有的分子数为0.5 NA
【答案】B
【解析】考查了气体的摩尔体积;A:没有标明气体的状况;C:标准状况下,11.2L Cl2含有的分子数为0.5NA;D:水为液态,不符合气体的摩尔体积的概念。
11.将5 mol·L-1的盐酸10 mL稀释到200 mL,再取出5 mL,这5 mL溶液的物质的量浓度是( )
A. 0.05 mol ·L-1 B. 0.25 mol ·L-1
C. 0.1 mol ·L-1 D. 0.5 mol ·L-1
【答案】B
【解析】试题分析:设稀释后盐酸物质量浓度为c,则:10mL×5mol/L=200mL×c,解得c=0.25mol/L。由于溶液是均匀的,所以取出的5ml盐酸的浓度等于稀释后盐酸的浓度为0.25mol/L,故选B。
12.只给出下列甲中和乙中对应的量,不能组成一个求物质的量的公式的是( )
序号
①
②
③
④
⑤
甲
物质微粒数
标准状况气体摩尔体积
固体体积
溶液的
质量分数
非标准状况
下物质的质量
乙
阿伏加德罗常数
标准状况下气体体积
固体密度
溶液的体积
物质的摩尔质量
A. ②③④ B. ③④⑤ C. ③④ D. ③
【答案】C
【解析】试题分析:①根据N=nNA,利用物质的粒子数(N)、阿伏加德罗常数(NA)可以计算物质的量,由n=N/NA可知,故①正确;②根据V=nVm,利用标准状况下的气体摩尔体积(Vm)、标准状况下的气体体积(V)可以计算物质的量n=V/Vm可知,故②正确;③由m=ρV,n=m/M可知,利用体积、密度只能计算其质量,但摩尔质量(M)未知,则不能计算出其物质的量,故③错误;④只有溶液的体积、溶质质量分数,不能计算溶质的质量,不能确定溶质的物质的量,故④错误;⑤由n=m/M可知,利用物质的质量与摩尔质量可以计算其物质的量,故⑤正确;故选:C。
13.下列配制的溶液浓度偏高的是( )
A. 配制盐酸用量筒量取盐酸时俯视刻度线
B. 配制盐酸定容时,仰视容量瓶刻度线
C. 称量10g NaOH配制0.25 mol ·L-1 NaOH溶液1000 mL时,砝码错放左盘
D. NaOH溶解后未经冷却即注入容量瓶至刻度线
【答案】D
【详解】A. 配制盐酸用量筒量取盐酸时俯视刻度线,量取的盐酸体积减小了,配制的溶液浓度偏低了,故A错误;B. 配制盐酸定容时,仰视容量瓶刻度线,相当于加水多了,导致配制的溶液浓度偏低了,故B错了;C. 要用天平称量10g NaOH固体时,砝码错放左盘了,因为没有用到游码,无影响;D.根据热胀冷缩的原理。 NaOH溶解后未经冷却即注入容量瓶至刻度线,导致加水的体积减小了,配制的溶液浓度偏高,故D正确;答案:D。
14.空气中的自由电子附着在分子或原子上形成的空气负离子(也叫阴离子)被称为“空气维生素”,O22-就是一种空气负离子,O22-的摩尔质量为( )
A. 32 g B. 34 g
C. 32 g/mol D. 34 g/mol
【答案】C
【解析】如果质量的单位用g表示;则摩尔质量在数值上等于物质的相对分子质量与相对原子质量,所以该微粒的摩尔质量是32g/mol,选项C正确,答案选C。
15.若某原子的摩尔质量是M g/mol,则一个该原子的真实质量是( )
A. M g B. 1/M g
C. M/(6.02×1023) g D. (6.02×1023) /Mg
【答案】C
【解析】试题分析:摩尔质量的定义是1mol该微粒所占的质量,1mol该原子含有的原子数为6.02×1023,因此1个原子真实的质量为M/6.02×1023g,故选项A正确。
16.如果a g某气体中含有该气体的分子数为b,则c g该气体在标准状况下的体积是(各选项中NA为阿伏加德罗常数) ( )
A. 22.4bc/(aNA)L B. 22.4ab/(cNA)L
C. 22.4ac/(bNA)L D. 22.4/(acNA)L
【答案】A
【解析】试题分析:a克某气体中含有的分子数为b,则c克气体含有的分子数为cb/a,c克该气体的物质的量为mol,在标准状况下Vm=22.4L/mol,则cg该气体的体积为mol×22.4L/mol= A.22.4bc/aNA L,故选A。
17.标准状况下有
①0.112L水;②3.01×1023个氯化氢分子;③13.6g H2S气体;④0.2mol氨气,下列对这四种物质的关系由小到大排列正确的是( )
A. 体积:①③②④ B. 密度:④①③② C. 质量:①④③② D. 氢原子数:②④③①
【答案】D
【解析】试题分析:标准状况下0.112 L水的质量是112g,物质的量是112g÷18g/mol=6.2mol,氢原子的物质的量是12.4mol;3.01×1023个氯化氢分子的物质的量是0.5mol,质量是18.25g,氢原子的物质的量是0.5mol;13.6 g H2S气体的物质的量是13.6g÷34g/mol=0.4mol,氢原子的物质的量是0.8mol;0.2 mol氨气的质量是3.4g,氢原子的物质的量是0.6mol。A、体积:①④③②,A错误;B、密度:④③②①,B错误;C.质量:④②③①,C错误;D.氢原子数:②④③①,D正确,答案选D。
18.某溶液中存在Mg2+、Ag+、Ba2+三种金属离子,现用NaOH、Na2CO3、NaCl三种溶液使它们分别沉淀并分离出来,要求每次只加一种溶液,滤出一种沉淀,所加溶液顺序正确的是( )
A. Na2CO3 NaCl NaOH B. NaOH NaCl Na2CO3
C. NaCl NaOH Na2CO3 D. NaCl Na2CO3 NaOH
【答案】C
【解析】A.由于碳酸钠溶液中的碳酸根离子能与溶液中Mg2+、Ag+、Ba2+均形成沉淀,先加入碳酸钠溶液会出现三种沉淀,不符合每次得到一种沉淀的要求,故A错误;B.由于氢氧化钠溶液中的氢氧根离子能与溶液中的Mg2+、Ag+形成沉淀,先加入氢氧化钠溶液出现象两种沉淀,不符合每次得到一种沉淀的要求,故B错误;C.氯化钠只能与溶液中Ag+形成氯化银沉淀,然后加入的氢氧化钠只与溶液中Mg2+形成氢氧化镁沉淀,最后加入的碳酸钠沉淀溶液中的Ba2+形成碳酸钡沉淀,满足每次只得一种沉淀的要求,故C正确;D.氯化钠溶液沉淀溶液中Ag+后,加入的碳酸钠溶液却能同时沉淀溶液中Mg2+、Ba2+的,不符合每次得到一种沉淀的要求,故D错误;故选C。
19.偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生的巨大能量可作为航天运载火箭的推动力。下列叙述正确的是( )
A. 偏二甲肼(C2H8N2)的摩尔质量为60 g/ mol
B. 6.02×1023个偏二甲肼(C2H8N2)分子的质量约为60 Kg
C. 1 mol偏二甲肼(C2H8N2)的质量为60 g·mol-1
D. 6 g偏二甲肼(C2H8N2)含有NA个偏二甲肼(C2H8N2)分子
【答案】A
【详解】A. 因为1mol偏二甲肼的质量为60g,所以偏二甲肼(C2H8N2)的摩尔质量为60 g/ mol,故A正确;B. 根据n=N/NA=6.02×1023/ 6.02×1023=1mol,m=nM=1mol=60g,故B错误;C. 1 mol偏二甲肼(C2H8N2)的质量为m=nM=1mol=60g 故C错误;D. 6 g-1=0.1mol,含有0.1NA个偏二甲肼(C2H8N2)分子,故D错误;答案:A。
20.下列说法正确的是( )
A. 在标准状况下,11.2 L某气体的质量为22 g,则该气体的相对分子质量是44 g/mol
B. 16 g O2和16 g O3含的氧原子个数一样多
C. 在标准状况下,水、氧气和氮气分子间的平均距离都相等
D. 1 mol氯化钙溶于水配成1 L溶液,所得溶液中Cl-的物质的量浓度为1 mol/L
【答案】B
【解析】试题分析:A、n=11.2L÷22.4L/mol=0.5mol,质量为22 g,则M=22g÷0.5mol=44g/mol,相对分子质量为44,错误;B、O2和 O3都由O元素组成,质量相等时,原子个数相等,正确;C、物质的聚集状态不同,分子间距离不同,标准状况下,氧气和氮气相等,水的最小,错误;D、1 mol氯化钙含有2molCl-,溶于水配成1 L溶液,所得溶液中Cl-的物质的量浓度为2 mol/L,错误。
21.在KCl、FeCl3、Fe2(SO4)3三种盐配成的混合溶液中,若K+为0.15 mol,Fe3+为0.25 mol,Cl-为0.2 mol,则SO42-为( )
A. 0.1 mol B. 0.15 mol C. 0.25 mol D. 0.35 mol
【答案】D
【解析】试题分析:根据电荷守恒可知3n(Fe3+)+n(K+)=2n(SO42-)+n(Cl—),解得n(SO42-)=0.35mol,答案选D。
22.下列物质分类的正确组合是( )
碱
酸
盐
酸性氧化物
A
纯碱
盐酸
烧碱
二氧化硫
B
烧碱
硫酸
食盐
一氧化碳
C
苛性钠
醋酸
石灰石
水
D
苛性钾
碳酸
苏打
三氧化硫
【答案】D
【解析】A、纯碱是碳酸钠,属于盐;烧碱是氢氧化钠,属于碱;选项A错误;B、一氧化碳是不成盐氧化物,不属于酸性氧化物,选项B错误;C、水是中性氧化物,选项C错误;D、苛性钾属于碱,碳酸属于酸,苏打是碳酸钠属于盐,三氧化硫属于酸性氧化物,分类全部正确,选项D正确。答案选D。
23.磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性。制备时将FeSO4和Fe2(SO4)3的溶液等物质的量混合,滴入稍过量的氢氧化钠溶液,随后加入油酸钠溶液,即可生成黑色的分散质粒子直径在5.5 nm~36 nm(1 nm=10-9m)的磁流体。下列说法正确的是( )
A. 所得的分散系属于溶液 B. 所得的分散系能产生丁达尔效应
C. 所得的分散系不能通过滤纸 D. 磁流体微粒的直径比Fe2+小
【答案】B
【分析】根据题意磁流体分散系分散质粒子直径在5.5 nm~36 nm,属于胶体的范畴,根据胶体的性质进行分析。
【详解】A.分散质粒子直径在5.5 nm~36 nm 之间,所得分散系为胶体不是溶液,故A错误;B.该分散系属于胶体,胶体有丁达尔效应,所以当一束强光通过此磁流体时会出现光亮的通路,故B选项是正确的;C.该分散性属于胶体,可以通过滤纸,故C错误;D.磁流体属于胶体,胶粒的直径大于溶液中离子的直径,磁流体微粒的直径比Fe2+大,故D错误;所以答案为B。
24.下列不能用有关胶体的观点解释的现象是( )
A. 在豆浆里加入盐卤做豆腐
B. 在河流入海处易形成沙洲
C. 将一束强光通过蛋白质溶液,能产生丁达尔效应
D. 通过溶解、过滤,可以除去食盐中的少量泥沙
【答案】D
【详解】A.因为豆浆为胶体,盐卤可使其发生聚沉成为固体凝胶,不符合题意,故不选;B.海水中的氯化钠等盐类可使河水中的胶体发生聚沉,渐渐形成沙洲,不符合题意,故不选;C.蛋白质溶液为胶体,具有丁达尔效应,不符合题意,故不选;粗盐中的泥沙不能透过滤纸,可用过滤法将其除去,与胶体无关,符合题意,故可选。答案为D。
二、非选择题(本题包括6小题,共52分)
25.已知半透膜有非常细小的孔,只允许较小的离子、分子通过,胶体粒子不能透过。(提示:碘遇淀粉显蓝色)
把10 mL淀粉胶体和5 mL KCl溶液的混合液体加入到用半透膜制成的袋内,将此袋浸入盛蒸馏水的烧杯中,2 min后,用两支试管各取5 mL烧杯中的液体,并做如下实验:
(1)向其中一支试管里滴加少量AgNO3溶液,其现象是______________________。
(2)向另一支试管里滴加少量碘水,其现象是______________________________。
(3)由上述实验得出的结论是_____________________________________________。
【答案】(1). 出现白色沉淀 (2). 无明显变化 (3). Cl-能透过半透膜,淀粉胶体粒子不能透过半透膜
【分析】淀粉胶体和氯化钠溶液混合后,放入用半透膜制成的袋内,将此袋浸入蒸馏水中后,淀粉胶体不能通过半透膜而留在袋内,但是氯离子和钠离子能通过半透膜而进入烧杯的水中.
【详解】(1)向其中一支试管里滴加少量AgNO3溶液,氯离子可以和银离子反应生成白色沉淀,其现象是出现白色沉淀;答案为:出现白色沉淀。
(2)袋内液体是淀粉胶体,向另一支试管里滴加少量碘水,无明显变化;
答案为:无明显变化。
(3)由上述实验现象得出的结论是Cl-能透过半透膜,淀粉胶体粒子不能透过半透膜;答案为:Cl-能透过半透膜,淀粉胶体粒子不能透过半透膜。
26.(1)同温同压下,同体积的氨气(NH3)和硫化氢(H2S)气体的质量比为________。
(2)同温同压下,氨气和硫化氢气体的密度比为________。
(3)在标准状况下,0.01 mol某气体的质量为0.44 g,则该气体的密度为________g·L−1(保留小数点后两位),该气体的相对分子质量为________。
(4)在标准状况下,14 g CO与2 g H2的混合气体体积为________L。
【答案】(1). 1∶2 (2). 1∶2 (3). 1.96 (4). 44 (5). 33.6
【详解】(1)根据阿伏加德罗定律,同温同压下,相同体积的气体所具有的物质的量相等,因此NH3和H2S的质量之比为17:34=1:2;(2)同温同压下,密度之比等于摩尔质量之比,即两种气体的密度之比为17:34=1:2;(3)该气体的体积为0.01×22.4L=0.224L,根据密度的定义,即该气体的密度为0.44/0.224g·L-1≈1.96g·L-1;根据摩尔质量的定义时M=m/n=0.44/0.01g·mol-1=44g·mol-1,摩尔质量在数值上等于其相对分子质量,即该气体的相对分子质量为44;(4)14gCO的物质的量为14/28mol=0.5mol,2gH2的物质的量为2/2mol=1mol,该混合气体的总物质的量为1.5mol,即气体体积为1.5×22.4L=33.6L。
27.(1)阅读、分析下列两个材料:
材料一
材料二
物质
熔点/℃
沸点/℃
密度/ g/cm3
溶解性
乙二醇(C2H6O2)
-11.5
198
1.11
易溶于水和乙醇
丙三醇(C3H8O3)
17.9
290
1.26
能跟水、酒精以任意比互溶
回答下列问题(填字母序号):
A.蒸馏法 B.萃取法
C.“溶解、结晶、过滤”的方法 D.分液法
①将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用________;
②将乙二醇和丙三醇相互分离的最佳方法是________________________。
(2)阅读材料三
在溶解性方面,Br2(溴)与I2很相似,其稀的水溶液显黄色。在实验室里从溴水(Br2的水溶液)中提取Br2和提取I2的方法相似。
回答下列问题:
①常用的提取方法是________________,化学试剂是________,最主要的仪器是__________。
②若观察发现提取Br2以后的水还有颜色,解决该问题的方法是__________________。
【答案】(1). C (2). A (3). 萃取 (4). 四氯化碳 (5). 分液漏斗 (6). 再进行萃取,直到水呈无色,将各项分离出来的含溴的四氯化碳溶液合并
【详解】①由图可知,氯化钠溶解度受温度影响较小,碳酸钠溶解度受温度影响大,利用冷却热饱和溶液分离,即用热水把固体溶解配制成饱和溶液,等液体冷却后,因为碳酸钠的溶解度随温度变化大,而NaCl小,所以碳酸钠析出,而氯化钠留在母液当中,反复多次也可以提纯,故可用“溶解、结晶、过滤”的方法分离,故答案为:C;
②由表可知乙二醇和丙三醇互溶的液体,沸点相差比较大,可用蒸馏法分离,故答案为:A;
(2)因为碘在CCl4中的溶解度大于在水中的溶解度,且碘与CCl4不反应;水与CCl4不互溶,所以在实验室里从溴水(Br2的水溶液)中提取Br2,采用萃取的方法, 常用萃取的化学试剂是四氯化碳,萃取最主要的仪器是分液漏斗。故答案为:萃取; 四氯化碳;分液漏斗。
②若观察发现提取Br2以后的水还有颜色,说明水中还含有溴,需再进行萃取,直到水为无色,然后将各次分离出来的含溴的四氯化碳溶液合并起来。
故答案为:再进行萃取,直到水为无色,将各次分离出来的含溴的四氯化碳溶液合并起来。
28.实验室欲用NaOH固体配制1.0 mol·L-1的NaOH溶液240 mL:
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却 ⑨摇动
其正确的操作顺序为②①③__________________⑦④。本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、__________________________。
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图所示。
烧杯的实际质量为________g,要完成本实验该同学应称出________g NaOH。
(3)使用容量瓶前必须进行的一步操作是_________________。
(4)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是___________。
A.转移溶液时不慎有少量洒到容量瓶外面
B.定容时俯视刻度线
C.未冷却至室温就将溶液转移到容量瓶并定容
D.定容后塞上瓶塞反复倒转摇匀,静置后,液面低于刻度线,再加水至刻度线
【答案】(1). ⑧⑤⑥⑨ (2). 250 mL容量瓶、胶头滴管 (3). 27.4 (4). 10.0 (5). 查漏 (6). BC
【详解】(1)配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、移液、洗涤、定容、摇匀等其正确的顺序为②①③⑧⑤⑥⑨⑦④:用到的仪器:天平、药匙、玻璃棒、烧杯、胶头滴管、250mL容量瓶,根据题意还缺少的仪器为: 250mL 容量瓶; 和胶头滴管。答案是: 250mL 容量瓶; 和胶头滴管。答案:⑧⑤⑥⑨ 250 mL容量瓶、胶头滴管 。
(2)根据图可以知道:砝码为30g,游码为2.6g,因为用天平称量物质时是左物右码,本实验物质和砝码放反了,所以烧杯的实际质量为30g -2.6g= 27.4 g;要用NaOH固体配制1.0 mol·L-1的NaOH溶液240 mL应选择250mL 容量瓶,需要氢氧化钠质量m=0.25L40g/mol=10g。因此,本题正确答案是:27.4 10.0。
(3)容量瓶带有活塞,使用过程中需要上下颠倒摇动,所以使用前应检查是否漏水; 因此,本题正确答案是:查漏;
(4) A.转移溶液时不慎有少量洒到容量瓶外面,导致溶质的量减小,所配溶液浓度偏低。故A错误;B.定容时俯视刻度线加水的体积减小了,导致溶液浓度偏高,故B符合题意;C.未冷却至室温就将溶液转移到容量瓶并定容导致溶液体积减小,溶液浓度偏高,故C符合题意;D.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线,导致溶液体积偏大,溶液浓度偏低,故不选。答案:BC。
29.某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2。
实验步骤如下:
①把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量试管和药品的总质量为15.95 g。
②连接好实验装置,检查装置的气密性。
③加热,开始反应,直到不再有气体产生为止。
④测量排入量筒中水的体积为285.0 mL,换算成标准状况下氧气的体积为279.7 mL.
⑤准确称量试管和残留物的质量为15.55 g。
根据上述实验过程,回答下列问题:
(1)如何检查装置的气密性?____________________________________________________________________________。
(2)试管中发生的化学反应方程式为:_______________________________________。
(3)以下是测量收集到气体体积必须包括的几个步骤:
①调整量筒的高度使广口瓶和量筒内的液面高度相同
②使试管和广口瓶内气体都冷却至室温
③读取量筒内液体的体积
这三步操作的正确顺序是___________(请填写步骤代码)。
进行③的实验操作时,若仰视读数,则读取氧气的体积________(填“偏大”、“偏小”或“无影响”)。
(4)实验过程中产生氧气的物质的量是________mol;实验测得氧气的摩尔体积是________(保留小数点后两位)。
【答案】(1). 往广口瓶中注满水,塞紧橡胶塞,按装置图连接好装置,用手将试管底部捂热,若观察到广口瓶中长玻璃管内液面上升,松开手后,过一会儿长玻璃管内的液面下降,则证明该装置不漏气。 (2). 2KClO3 2KCl+3O2↑ (3). ②①③ (4). 偏小 (5). 0.0125 (6). 22.38 L·mol-1
【详解】(1)检查装置的气密性的方法:往广口瓶中注满水,塞紧橡胶塞,按装置图连接好装置,用手将试管底部捂热,若观察到广口瓶中长玻璃管内液面上升,松开手后,过一会儿长玻璃管内的液面下降,则证明该装置不漏气。
(2)试管中的反应物为氯酸钾粉末和少量二氧化锰粉末,加热会发生化学反应生成氧气和氯酸钾。其化学反应方程式为2KClO3 2KCl+3O2↑。
(3)测量收集到气体体积必须包括的步骤:②先使试管和广口瓶内气体都冷却至室温,①在调整量筒的高度使广口瓶和量筒内的液面高度相同,③才能读取量筒内液体的体积。三步操作的正确顺序是②①③。读取量筒内液体的体积时,若仰视读数,则读取氧气的体积偏小。答案:②①③ 偏小
(4) 准确称量试管和药品的总质量为15.95 g,准确称量试管和残留物的质量为15.55 g,根据质量守恒定律,产生氧气的质量为m=15.95 g-15.55 g=0.40g,根据n=m/M=0.40g/32gmol-1=0.0125mol;由测量排入量筒中水的体积为285.0 mL,换算成标准状况下氧气的体积为279.7 mL,根据Vm=V/n=(279.7 mL10-3)/0.0125mol=22.38 L·mol-1.答案:22.38 L·mol-1。
可能用到的相对原子质量:H∶1 C∶12 N∶14 O∶16 Na∶23 Al∶27 S∶32 Cl∶35.5 K∶39 Cu∶64
一、选择题(本题包括24小题,每小题2分,共48分。每小题只有一个选项符合题意。)
1.下列操作或发生事故时的处理方法正确的是( )
A. 可用燃着的酒精灯引燃另一只酒精灯
B. 给试管里的液体加热时,试管应与桌面垂直
C. 配制一定浓度的NaCl溶液时,定容振荡摇匀后,发现液面低于刻度线,再加水到刻度线
D. 浓硫酸不慎沾在皮肤上,应立即用大量水冲洗,最后涂上3%~5%的小苏打溶液
【答案】D
【解析】A、用燃着的酒精灯引燃另一只酒精灯,容易造成酒精着火,容易发生火灾,应该用火柴点燃,选项A错误;B、若给试管里的液体加热,液体体积一般不超过试管容积的,试管跟桌面成45°角,先使试管均匀受热,然后小心地在试管里液体的底部加热,试管不能与桌面垂直,选项B错误;C、定容后不能再加水,这样会使配制的溶液浓度偏低,选项C错误;D、浓硫酸具有很强的腐蚀性,如果浓硫酸不慎沾在皮肤上,应立即用干布擦掉,然后用水冲洗,最后再涂上3%~5%的小苏打溶液,选项D正确。答案选D。
2.下列实验操作中正确的是 ( )
A. 蒸发操作时,应使混合物中的水分完全蒸干后才能停止加热
B. 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶支管口处
C. 分液操作时,分液漏斗中下层液体从下口放出后,再将上层液体从下口放出到另一个烧杯
D. 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
【答案】B
【解析】A.蒸发时待大量晶体析出时,停止加热,利用蒸发皿的余热把剩余的水蒸干,A错误;B.进行蒸馏操作时温度计测量蒸汽的温度,应使温度计水银球靠近蒸馏烧瓶的支管口处,B正确;C.为防止液体污染,分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出,C错误;D.萃取剂不一定是有机溶剂,萃取剂的选择与密度无关,D错误,答案选B。
3.下图分别表示四种操作,其中有两处错误的是( )
【答案】B
【解析】A,用量筒量取液体时,视线应与凹液面的最低处保持水平,图中有一处错误,读数时仰视了,故A不符合题意。B,图中有两处错误:(1)在量筒中进行浓硫酸的稀释,(2)把水加入浓硫酸中,容易使液体飞溅,故B符合题意。C,NaOH固体易潮解,不能将其放在纸上,应该放在玻璃器皿中,有一处错误即放在纸上称量氢氧化钠,故C不符合题意。D,溶解操作中要用玻璃棒不断搅拌以加快溶解速率。C中有一处错误,通过摇动烧杯使固体溶解,这样会使烧杯内的液体溅出,故D不符合题意。本题选B。
4.在容量瓶上,无需标记的是( )
A. 标线 B. 温度 C. 浓度 D. 容量
【答案】C
【解析】试题分析:因容量瓶上标有:温度、规格、刻度线,故选C。
5.将体积比为1∶2的四氯化碳和碘水在试管中充分混合后静置。下列图示现象正确的是( )
【答案】D
【解析】碘易溶于四氯化碳,四氯化碳与水不互溶,溶液分层,四氯化碳的密度比水大,有色层在下层,下层为紫红色,上下体积比为2:1,答案选D。
6.某溶液中可能含有SO42-、CO32-、Cl-,为了检验其中是否含有SO42-,除BaCl2溶液外,还需要的溶液是( )
A. H2SO4 B. HCl C. NaOH D. NaNO3
【答案】B
【解析】试题分析:只加可溶性钡盐,不酸化,误将CO32-等干扰离子判成SO42-,所以应先加盐酸酸化,然后加入BaCl2溶液,故选B。
7.下列括号中的分离方法运用得当的是( )
A. 植物油和自来水(蒸馏)
B. 水溶液中的食盐和碘(分液)
C. CaCO3和CaCl2(溶解、过滤、蒸发)
D. 自来水中的杂质(萃取)
【答案】C
【解析】试题分析:A.植物油和水是互不相溶的两层液体,应该适应分液的方法分离,错误。B.水溶液中的食盐和碘,可以利用碘容易溶于有机物苯,而苯与水互不相溶的性质,用萃取的方法分离,错误。C.CaCO3难溶于水,CaCl2容易溶于水,可以加上溶解然后过滤得到CaCO3,再蒸发结晶得到CaCl2,正确。D.自来水中的杂质溶于水的可以采用蒸馏的方法分离除去,难溶性物质才用过滤的方法分离除去,错误。
8.下列说法中,不正确的是( )
A. 1 mol任何物质都含有6.02×1023个原子
B. 0.012 kg 12C约含有6.02×1023个碳原子
C. 阿伏加德罗常数表示的粒子“集体”就是1 mol
D. 使用摩尔这一单位时必须指明粒子的名称
【答案】A
【解析】试题分析:A.1mol任何由原子构成的物质都含6.02×1023个原子,若物质的构成微粒不是原子,则不一定是含6.02×1023个原子,错误;B.根据规定可知0.012kg12C所含有的碳原子的物质的量是1mol,所含有的碳原子数为阿伏加德罗常数,近似值是6.02×1023,正确;C.阿伏伽德罗常数个粒子的“集体”的物质的量就是1mol,正确;D.摩尔是物质的量的单位,其使用范围是微粒,使用使用摩尔这一单位时必须指明微粒的种类,正确。
9.下列叙述中正确的是( )
A. 1 mol CO的质量是28 g·mol-1
B. 硫酸根离子的摩尔质量是98 g
C. Cl2的摩尔质量是71 g·mol-1
D. NaCl的相对分子质量是58.5 g·mol-1
【答案】C
【解析】A、1mol一氧化碳的质量为28g,28g•mol-1为一氧化碳的摩尔质量,故A错误;B、硫酸根离子的摩尔质量为98g/mol,98g为1mol硫酸的质量,故B错误;C、氯气的相对分子质量为71,其摩尔质量为71g/mol,故C正确;D、相对分子质量单位为1,省略不写,氯化钠的相对分子质量为58.5,58.5 g•mol-1为氯化钠的摩尔质量,故D错误;故选C。
10.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 含有NA个氦原子的氦气在标准状况下的体积约为11.2 L
B. 25℃,1.01×105 Pa,64 g SO2中含有的原子数为3NA
C. 在常温常压下,11.2 L Cl2含有的分子数为0.5 NA
D. 标准状况下,11.2 L H2O含有的分子数为0.5 NA
【答案】B
【解析】考查了气体的摩尔体积;A:没有标明气体的状况;C:标准状况下,11.2L Cl2含有的分子数为0.5NA;D:水为液态,不符合气体的摩尔体积的概念。
11.将5 mol·L-1的盐酸10 mL稀释到200 mL,再取出5 mL,这5 mL溶液的物质的量浓度是( )
A. 0.05 mol ·L-1 B. 0.25 mol ·L-1
C. 0.1 mol ·L-1 D. 0.5 mol ·L-1
【答案】B
【解析】试题分析:设稀释后盐酸物质量浓度为c,则:10mL×5mol/L=200mL×c,解得c=0.25mol/L。由于溶液是均匀的,所以取出的5ml盐酸的浓度等于稀释后盐酸的浓度为0.25mol/L,故选B。
12.只给出下列甲中和乙中对应的量,不能组成一个求物质的量的公式的是( )
序号
①
②
③
④
⑤
甲
物质微粒数
标准状况气体摩尔体积
固体体积
溶液的
质量分数
非标准状况
下物质的质量
乙
阿伏加德罗常数
标准状况下气体体积
固体密度
溶液的体积
物质的摩尔质量
A. ②③④ B. ③④⑤ C. ③④ D. ③
【答案】C
【解析】试题分析:①根据N=nNA,利用物质的粒子数(N)、阿伏加德罗常数(NA)可以计算物质的量,由n=N/NA可知,故①正确;②根据V=nVm,利用标准状况下的气体摩尔体积(Vm)、标准状况下的气体体积(V)可以计算物质的量n=V/Vm可知,故②正确;③由m=ρV,n=m/M可知,利用体积、密度只能计算其质量,但摩尔质量(M)未知,则不能计算出其物质的量,故③错误;④只有溶液的体积、溶质质量分数,不能计算溶质的质量,不能确定溶质的物质的量,故④错误;⑤由n=m/M可知,利用物质的质量与摩尔质量可以计算其物质的量,故⑤正确;故选:C。
13.下列配制的溶液浓度偏高的是( )
A. 配制盐酸用量筒量取盐酸时俯视刻度线
B. 配制盐酸定容时,仰视容量瓶刻度线
C. 称量10g NaOH配制0.25 mol ·L-1 NaOH溶液1000 mL时,砝码错放左盘
D. NaOH溶解后未经冷却即注入容量瓶至刻度线
【答案】D
【详解】A. 配制盐酸用量筒量取盐酸时俯视刻度线,量取的盐酸体积减小了,配制的溶液浓度偏低了,故A错误;B. 配制盐酸定容时,仰视容量瓶刻度线,相当于加水多了,导致配制的溶液浓度偏低了,故B错了;C. 要用天平称量10g NaOH固体时,砝码错放左盘了,因为没有用到游码,无影响;D.根据热胀冷缩的原理。 NaOH溶解后未经冷却即注入容量瓶至刻度线,导致加水的体积减小了,配制的溶液浓度偏高,故D正确;答案:D。
14.空气中的自由电子附着在分子或原子上形成的空气负离子(也叫阴离子)被称为“空气维生素”,O22-就是一种空气负离子,O22-的摩尔质量为( )
A. 32 g B. 34 g
C. 32 g/mol D. 34 g/mol
【答案】C
【解析】如果质量的单位用g表示;则摩尔质量在数值上等于物质的相对分子质量与相对原子质量,所以该微粒的摩尔质量是32g/mol,选项C正确,答案选C。
15.若某原子的摩尔质量是M g/mol,则一个该原子的真实质量是( )
A. M g B. 1/M g
C. M/(6.02×1023) g D. (6.02×1023) /Mg
【答案】C
【解析】试题分析:摩尔质量的定义是1mol该微粒所占的质量,1mol该原子含有的原子数为6.02×1023,因此1个原子真实的质量为M/6.02×1023g,故选项A正确。
16.如果a g某气体中含有该气体的分子数为b,则c g该气体在标准状况下的体积是(各选项中NA为阿伏加德罗常数) ( )
A. 22.4bc/(aNA)L B. 22.4ab/(cNA)L
C. 22.4ac/(bNA)L D. 22.4/(acNA)L
【答案】A
【解析】试题分析:a克某气体中含有的分子数为b,则c克气体含有的分子数为cb/a,c克该气体的物质的量为mol,在标准状况下Vm=22.4L/mol,则cg该气体的体积为mol×22.4L/mol= A.22.4bc/aNA L,故选A。
17.标准状况下有
①0.112L水;②3.01×1023个氯化氢分子;③13.6g H2S气体;④0.2mol氨气,下列对这四种物质的关系由小到大排列正确的是( )
A. 体积:①③②④ B. 密度:④①③② C. 质量:①④③② D. 氢原子数:②④③①
【答案】D
【解析】试题分析:标准状况下0.112 L水的质量是112g,物质的量是112g÷18g/mol=6.2mol,氢原子的物质的量是12.4mol;3.01×1023个氯化氢分子的物质的量是0.5mol,质量是18.25g,氢原子的物质的量是0.5mol;13.6 g H2S气体的物质的量是13.6g÷34g/mol=0.4mol,氢原子的物质的量是0.8mol;0.2 mol氨气的质量是3.4g,氢原子的物质的量是0.6mol。A、体积:①④③②,A错误;B、密度:④③②①,B错误;C.质量:④②③①,C错误;D.氢原子数:②④③①,D正确,答案选D。
18.某溶液中存在Mg2+、Ag+、Ba2+三种金属离子,现用NaOH、Na2CO3、NaCl三种溶液使它们分别沉淀并分离出来,要求每次只加一种溶液,滤出一种沉淀,所加溶液顺序正确的是( )
A. Na2CO3 NaCl NaOH B. NaOH NaCl Na2CO3
C. NaCl NaOH Na2CO3 D. NaCl Na2CO3 NaOH
【答案】C
【解析】A.由于碳酸钠溶液中的碳酸根离子能与溶液中Mg2+、Ag+、Ba2+均形成沉淀,先加入碳酸钠溶液会出现三种沉淀,不符合每次得到一种沉淀的要求,故A错误;B.由于氢氧化钠溶液中的氢氧根离子能与溶液中的Mg2+、Ag+形成沉淀,先加入氢氧化钠溶液出现象两种沉淀,不符合每次得到一种沉淀的要求,故B错误;C.氯化钠只能与溶液中Ag+形成氯化银沉淀,然后加入的氢氧化钠只与溶液中Mg2+形成氢氧化镁沉淀,最后加入的碳酸钠沉淀溶液中的Ba2+形成碳酸钡沉淀,满足每次只得一种沉淀的要求,故C正确;D.氯化钠溶液沉淀溶液中Ag+后,加入的碳酸钠溶液却能同时沉淀溶液中Mg2+、Ba2+的,不符合每次得到一种沉淀的要求,故D错误;故选C。
19.偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生的巨大能量可作为航天运载火箭的推动力。下列叙述正确的是( )
A. 偏二甲肼(C2H8N2)的摩尔质量为60 g/ mol
B. 6.02×1023个偏二甲肼(C2H8N2)分子的质量约为60 Kg
C. 1 mol偏二甲肼(C2H8N2)的质量为60 g·mol-1
D. 6 g偏二甲肼(C2H8N2)含有NA个偏二甲肼(C2H8N2)分子
【答案】A
【详解】A. 因为1mol偏二甲肼的质量为60g,所以偏二甲肼(C2H8N2)的摩尔质量为60 g/ mol,故A正确;B. 根据n=N/NA=6.02×1023/ 6.02×1023=1mol,m=nM=1mol=60g,故B错误;C. 1 mol偏二甲肼(C2H8N2)的质量为m=nM=1mol=60g 故C错误;D. 6 g-1=0.1mol,含有0.1NA个偏二甲肼(C2H8N2)分子,故D错误;答案:A。
20.下列说法正确的是( )
A. 在标准状况下,11.2 L某气体的质量为22 g,则该气体的相对分子质量是44 g/mol
B. 16 g O2和16 g O3含的氧原子个数一样多
C. 在标准状况下,水、氧气和氮气分子间的平均距离都相等
D. 1 mol氯化钙溶于水配成1 L溶液,所得溶液中Cl-的物质的量浓度为1 mol/L
【答案】B
【解析】试题分析:A、n=11.2L÷22.4L/mol=0.5mol,质量为22 g,则M=22g÷0.5mol=44g/mol,相对分子质量为44,错误;B、O2和 O3都由O元素组成,质量相等时,原子个数相等,正确;C、物质的聚集状态不同,分子间距离不同,标准状况下,氧气和氮气相等,水的最小,错误;D、1 mol氯化钙含有2molCl-,溶于水配成1 L溶液,所得溶液中Cl-的物质的量浓度为2 mol/L,错误。
21.在KCl、FeCl3、Fe2(SO4)3三种盐配成的混合溶液中,若K+为0.15 mol,Fe3+为0.25 mol,Cl-为0.2 mol,则SO42-为( )
A. 0.1 mol B. 0.15 mol C. 0.25 mol D. 0.35 mol
【答案】D
【解析】试题分析:根据电荷守恒可知3n(Fe3+)+n(K+)=2n(SO42-)+n(Cl—),解得n(SO42-)=0.35mol,答案选D。
22.下列物质分类的正确组合是( )
碱
酸
盐
酸性氧化物
A
纯碱
盐酸
烧碱
二氧化硫
B
烧碱
硫酸
食盐
一氧化碳
C
苛性钠
醋酸
石灰石
水
D
苛性钾
碳酸
苏打
三氧化硫
【答案】D
【解析】A、纯碱是碳酸钠,属于盐;烧碱是氢氧化钠,属于碱;选项A错误;B、一氧化碳是不成盐氧化物,不属于酸性氧化物,选项B错误;C、水是中性氧化物,选项C错误;D、苛性钾属于碱,碳酸属于酸,苏打是碳酸钠属于盐,三氧化硫属于酸性氧化物,分类全部正确,选项D正确。答案选D。
23.磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性。制备时将FeSO4和Fe2(SO4)3的溶液等物质的量混合,滴入稍过量的氢氧化钠溶液,随后加入油酸钠溶液,即可生成黑色的分散质粒子直径在5.5 nm~36 nm(1 nm=10-9m)的磁流体。下列说法正确的是( )
A. 所得的分散系属于溶液 B. 所得的分散系能产生丁达尔效应
C. 所得的分散系不能通过滤纸 D. 磁流体微粒的直径比Fe2+小
【答案】B
【分析】根据题意磁流体分散系分散质粒子直径在5.5 nm~36 nm,属于胶体的范畴,根据胶体的性质进行分析。
【详解】A.分散质粒子直径在5.5 nm~36 nm 之间,所得分散系为胶体不是溶液,故A错误;B.该分散系属于胶体,胶体有丁达尔效应,所以当一束强光通过此磁流体时会出现光亮的通路,故B选项是正确的;C.该分散性属于胶体,可以通过滤纸,故C错误;D.磁流体属于胶体,胶粒的直径大于溶液中离子的直径,磁流体微粒的直径比Fe2+大,故D错误;所以答案为B。
24.下列不能用有关胶体的观点解释的现象是( )
A. 在豆浆里加入盐卤做豆腐
B. 在河流入海处易形成沙洲
C. 将一束强光通过蛋白质溶液,能产生丁达尔效应
D. 通过溶解、过滤,可以除去食盐中的少量泥沙
【答案】D
【详解】A.因为豆浆为胶体,盐卤可使其发生聚沉成为固体凝胶,不符合题意,故不选;B.海水中的氯化钠等盐类可使河水中的胶体发生聚沉,渐渐形成沙洲,不符合题意,故不选;C.蛋白质溶液为胶体,具有丁达尔效应,不符合题意,故不选;粗盐中的泥沙不能透过滤纸,可用过滤法将其除去,与胶体无关,符合题意,故可选。答案为D。
二、非选择题(本题包括6小题,共52分)
25.已知半透膜有非常细小的孔,只允许较小的离子、分子通过,胶体粒子不能透过。(提示:碘遇淀粉显蓝色)
把10 mL淀粉胶体和5 mL KCl溶液的混合液体加入到用半透膜制成的袋内,将此袋浸入盛蒸馏水的烧杯中,2 min后,用两支试管各取5 mL烧杯中的液体,并做如下实验:
(1)向其中一支试管里滴加少量AgNO3溶液,其现象是______________________。
(2)向另一支试管里滴加少量碘水,其现象是______________________________。
(3)由上述实验得出的结论是_____________________________________________。
【答案】(1). 出现白色沉淀 (2). 无明显变化 (3). Cl-能透过半透膜,淀粉胶体粒子不能透过半透膜
【分析】淀粉胶体和氯化钠溶液混合后,放入用半透膜制成的袋内,将此袋浸入蒸馏水中后,淀粉胶体不能通过半透膜而留在袋内,但是氯离子和钠离子能通过半透膜而进入烧杯的水中.
【详解】(1)向其中一支试管里滴加少量AgNO3溶液,氯离子可以和银离子反应生成白色沉淀,其现象是出现白色沉淀;答案为:出现白色沉淀。
(2)袋内液体是淀粉胶体,向另一支试管里滴加少量碘水,无明显变化;
答案为:无明显变化。
(3)由上述实验现象得出的结论是Cl-能透过半透膜,淀粉胶体粒子不能透过半透膜;答案为:Cl-能透过半透膜,淀粉胶体粒子不能透过半透膜。
26.(1)同温同压下,同体积的氨气(NH3)和硫化氢(H2S)气体的质量比为________。
(2)同温同压下,氨气和硫化氢气体的密度比为________。
(3)在标准状况下,0.01 mol某气体的质量为0.44 g,则该气体的密度为________g·L−1(保留小数点后两位),该气体的相对分子质量为________。
(4)在标准状况下,14 g CO与2 g H2的混合气体体积为________L。
【答案】(1). 1∶2 (2). 1∶2 (3). 1.96 (4). 44 (5). 33.6
【详解】(1)根据阿伏加德罗定律,同温同压下,相同体积的气体所具有的物质的量相等,因此NH3和H2S的质量之比为17:34=1:2;(2)同温同压下,密度之比等于摩尔质量之比,即两种气体的密度之比为17:34=1:2;(3)该气体的体积为0.01×22.4L=0.224L,根据密度的定义,即该气体的密度为0.44/0.224g·L-1≈1.96g·L-1;根据摩尔质量的定义时M=m/n=0.44/0.01g·mol-1=44g·mol-1,摩尔质量在数值上等于其相对分子质量,即该气体的相对分子质量为44;(4)14gCO的物质的量为14/28mol=0.5mol,2gH2的物质的量为2/2mol=1mol,该混合气体的总物质的量为1.5mol,即气体体积为1.5×22.4L=33.6L。
27.(1)阅读、分析下列两个材料:
材料一
材料二
物质
熔点/℃
沸点/℃
密度/ g/cm3
溶解性
乙二醇(C2H6O2)
-11.5
198
1.11
易溶于水和乙醇
丙三醇(C3H8O3)
17.9
290
1.26
能跟水、酒精以任意比互溶
回答下列问题(填字母序号):
A.蒸馏法 B.萃取法
C.“溶解、结晶、过滤”的方法 D.分液法
①将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用________;
②将乙二醇和丙三醇相互分离的最佳方法是________________________。
(2)阅读材料三
在溶解性方面,Br2(溴)与I2很相似,其稀的水溶液显黄色。在实验室里从溴水(Br2的水溶液)中提取Br2和提取I2的方法相似。
回答下列问题:
①常用的提取方法是________________,化学试剂是________,最主要的仪器是__________。
②若观察发现提取Br2以后的水还有颜色,解决该问题的方法是__________________。
【答案】(1). C (2). A (3). 萃取 (4). 四氯化碳 (5). 分液漏斗 (6). 再进行萃取,直到水呈无色,将各项分离出来的含溴的四氯化碳溶液合并
【详解】①由图可知,氯化钠溶解度受温度影响较小,碳酸钠溶解度受温度影响大,利用冷却热饱和溶液分离,即用热水把固体溶解配制成饱和溶液,等液体冷却后,因为碳酸钠的溶解度随温度变化大,而NaCl小,所以碳酸钠析出,而氯化钠留在母液当中,反复多次也可以提纯,故可用“溶解、结晶、过滤”的方法分离,故答案为:C;
②由表可知乙二醇和丙三醇互溶的液体,沸点相差比较大,可用蒸馏法分离,故答案为:A;
(2)因为碘在CCl4中的溶解度大于在水中的溶解度,且碘与CCl4不反应;水与CCl4不互溶,所以在实验室里从溴水(Br2的水溶液)中提取Br2,采用萃取的方法, 常用萃取的化学试剂是四氯化碳,萃取最主要的仪器是分液漏斗。故答案为:萃取; 四氯化碳;分液漏斗。
②若观察发现提取Br2以后的水还有颜色,说明水中还含有溴,需再进行萃取,直到水为无色,然后将各次分离出来的含溴的四氯化碳溶液合并起来。
故答案为:再进行萃取,直到水为无色,将各次分离出来的含溴的四氯化碳溶液合并起来。
28.实验室欲用NaOH固体配制1.0 mol·L-1的NaOH溶液240 mL:
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却 ⑨摇动
其正确的操作顺序为②①③__________________⑦④。本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、__________________________。
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图所示。
烧杯的实际质量为________g,要完成本实验该同学应称出________g NaOH。
(3)使用容量瓶前必须进行的一步操作是_________________。
(4)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是___________。
A.转移溶液时不慎有少量洒到容量瓶外面
B.定容时俯视刻度线
C.未冷却至室温就将溶液转移到容量瓶并定容
D.定容后塞上瓶塞反复倒转摇匀,静置后,液面低于刻度线,再加水至刻度线
【答案】(1). ⑧⑤⑥⑨ (2). 250 mL容量瓶、胶头滴管 (3). 27.4 (4). 10.0 (5). 查漏 (6). BC
【详解】(1)配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、移液、洗涤、定容、摇匀等其正确的顺序为②①③⑧⑤⑥⑨⑦④:用到的仪器:天平、药匙、玻璃棒、烧杯、胶头滴管、250mL容量瓶,根据题意还缺少的仪器为: 250mL 容量瓶; 和胶头滴管。答案是: 250mL 容量瓶; 和胶头滴管。答案:⑧⑤⑥⑨ 250 mL容量瓶、胶头滴管 。
(2)根据图可以知道:砝码为30g,游码为2.6g,因为用天平称量物质时是左物右码,本实验物质和砝码放反了,所以烧杯的实际质量为30g -2.6g= 27.4 g;要用NaOH固体配制1.0 mol·L-1的NaOH溶液240 mL应选择250mL 容量瓶,需要氢氧化钠质量m=0.25L40g/mol=10g。因此,本题正确答案是:27.4 10.0。
(3)容量瓶带有活塞,使用过程中需要上下颠倒摇动,所以使用前应检查是否漏水; 因此,本题正确答案是:查漏;
(4) A.转移溶液时不慎有少量洒到容量瓶外面,导致溶质的量减小,所配溶液浓度偏低。故A错误;B.定容时俯视刻度线加水的体积减小了,导致溶液浓度偏高,故B符合题意;C.未冷却至室温就将溶液转移到容量瓶并定容导致溶液体积减小,溶液浓度偏高,故C符合题意;D.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线,导致溶液体积偏大,溶液浓度偏低,故不选。答案:BC。
29.某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2。
实验步骤如下:
①把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量试管和药品的总质量为15.95 g。
②连接好实验装置,检查装置的气密性。
③加热,开始反应,直到不再有气体产生为止。
④测量排入量筒中水的体积为285.0 mL,换算成标准状况下氧气的体积为279.7 mL.
⑤准确称量试管和残留物的质量为15.55 g。
根据上述实验过程,回答下列问题:
(1)如何检查装置的气密性?____________________________________________________________________________。
(2)试管中发生的化学反应方程式为:_______________________________________。
(3)以下是测量收集到气体体积必须包括的几个步骤:
①调整量筒的高度使广口瓶和量筒内的液面高度相同
②使试管和广口瓶内气体都冷却至室温
③读取量筒内液体的体积
这三步操作的正确顺序是___________(请填写步骤代码)。
进行③的实验操作时,若仰视读数,则读取氧气的体积________(填“偏大”、“偏小”或“无影响”)。
(4)实验过程中产生氧气的物质的量是________mol;实验测得氧气的摩尔体积是________(保留小数点后两位)。
【答案】(1). 往广口瓶中注满水,塞紧橡胶塞,按装置图连接好装置,用手将试管底部捂热,若观察到广口瓶中长玻璃管内液面上升,松开手后,过一会儿长玻璃管内的液面下降,则证明该装置不漏气。 (2). 2KClO3 2KCl+3O2↑ (3). ②①③ (4). 偏小 (5). 0.0125 (6). 22.38 L·mol-1
【详解】(1)检查装置的气密性的方法:往广口瓶中注满水,塞紧橡胶塞,按装置图连接好装置,用手将试管底部捂热,若观察到广口瓶中长玻璃管内液面上升,松开手后,过一会儿长玻璃管内的液面下降,则证明该装置不漏气。
(2)试管中的反应物为氯酸钾粉末和少量二氧化锰粉末,加热会发生化学反应生成氧气和氯酸钾。其化学反应方程式为2KClO3 2KCl+3O2↑。
(3)测量收集到气体体积必须包括的步骤:②先使试管和广口瓶内气体都冷却至室温,①在调整量筒的高度使广口瓶和量筒内的液面高度相同,③才能读取量筒内液体的体积。三步操作的正确顺序是②①③。读取量筒内液体的体积时,若仰视读数,则读取氧气的体积偏小。答案:②①③ 偏小
(4) 准确称量试管和药品的总质量为15.95 g,准确称量试管和残留物的质量为15.55 g,根据质量守恒定律,产生氧气的质量为m=15.95 g-15.55 g=0.40g,根据n=m/M=0.40g/32gmol-1=0.0125mol;由测量排入量筒中水的体积为285.0 mL,换算成标准状况下氧气的体积为279.7 mL,根据Vm=V/n=(279.7 mL10-3)/0.0125mol=22.38 L·mol-1.答案:22.38 L·mol-1。
相关资料
更多








