
【化学】河南省林州市第一中学2019-2020学年高一10月月考试题
展开河南省林州市第一中学2019-2020学年高一10月月考试题
考试时间:90分钟;试卷满分:100分
可能用到的原子量:H 1,C 12,N 14,O 16,S 32,Cl 35.5,K 39.
第I卷(选择题)
一、单选题(共20小题每小题3分,共60分)
1.为了除去粗盐中的少量泥沙和Ca2+、Mg2+、SO42-等杂质离子,先将粗盐溶于水,过滤,然后对滤液进行4项操作:①过滤,②加适量盐酸 ,③加过量的NaOH和Na2CO3混合溶液④加过量BaCl2溶液。上述4项操作的正确顺序为( )
A.②③④① B.④②③① C.④③①② D.②①③④
2.同温同压下,质量相同的CO2、H2、O2、CH4、SO2五种气体,下列说法错误的是( )
A.所占的体积由大到小的顺序是:H2>CH4>O2>CO2>SO2
B.所含分子数由多到少的顺序是:H2>CH4>O2>CO2>SO2
C.密度由大到小的顺序是:SO2>CO2>O2>CH4>H2
D.所含的电子数由多到少的顺序是:CO2>SO2>CH4>O2>H2
3.标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是( )
A.
B.
C.
D.=1000Vρ/ (17V+22400)
4.一定温度下,某物质在水中的溶解度为S,计算该温度下这种饱和溶液中溶质的物质的量浓度,必不可少的物理量是( )
①溶液中溶质的摩尔质量 ②溶液中溶质和溶剂的质量比 ③溶液的密度 ④溶液的体积
A.①② B.②③ C.①③ D.②④
5.在标准状况下,将22.4LHCl完全溶于1L水中(水的密度近似为1g/mL),溶液的密度为ρg/cm3(ρ>1),溶液的体积为VmL,溶质的质量分数为w,溶质的物质的量浓度为c mol/L.下列叙述中正确的是( )
①w=×100% ②c=1mol•L﹣1 ③向上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5w④向上述溶液中再加入VmL水后,所得溶液的质量分数小于0.5w
A.①②③ B.①③④ C.①③ D.①④
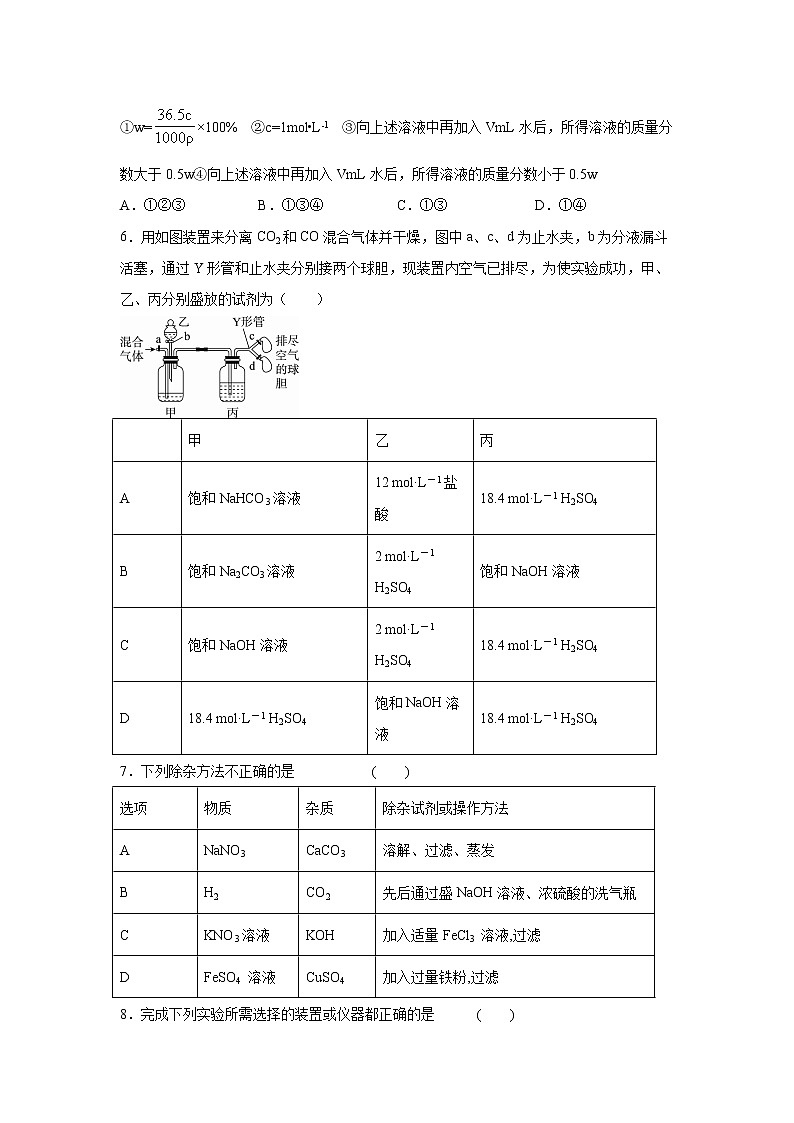
6.用如图装置来分离CO2和CO混合气体并干燥,图中a、c、d为止水夹,b为分液漏斗活塞,通过Y形管和止水夹分别接两个球胆,现装置内空气已排尽,为使实验成功,甲、乙、丙分别盛放的试剂为( )
| 甲 | 乙 | 丙 |
A | 饱和NaHCO3溶液 | 12 mol·L-1盐酸 | 18.4 mol·L-1 H2SO4 |
B | 饱和Na2CO3溶液 | 2 mol·L-1 H2SO4 | 饱和NaOH溶液 |
C | 饱和NaOH溶液 | 2 mol·L-1 H2SO4 | 18.4 mol·L-1 H2SO4 |
D | 18.4 mol·L-1 H2SO4 | 饱和NaOH溶液 | 18.4 mol·L-1 H2SO4 |
7.下列除杂方法不正确的是 ( )
选项 | 物质 | 杂质 | 除杂试剂或操作方法 |
A | NaNO3 | CaCO3 | 溶解、过滤、蒸发 |
B | H2 | CO2 | 先后通过盛NaOH溶液、浓硫酸的洗气瓶 |
C | KNO3溶液 | KOH | 加入适量FeCl3 溶液,过滤 |
D | FeSO4 溶液 | CuSO4 | 加入过量铁粉,过滤 |
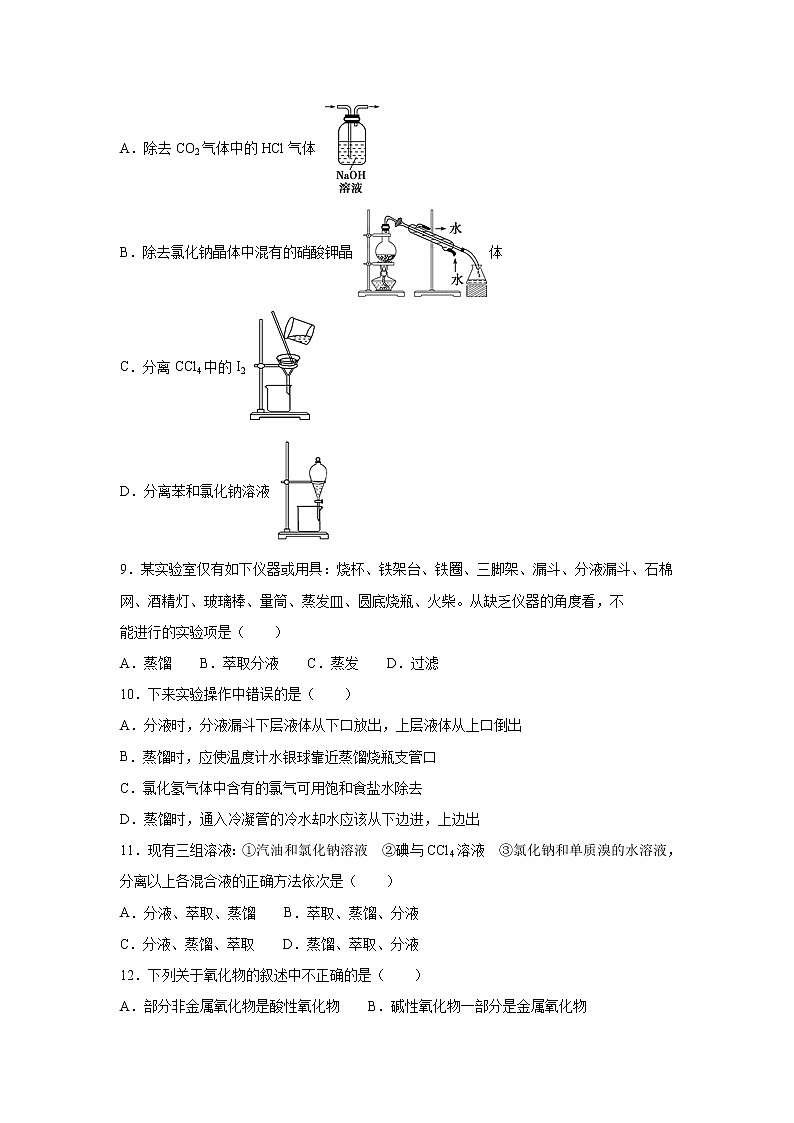
8.完成下列实验所需选择的装置或仪器都正确的是 ( )
A.除去CO2气体中的HCl气体
B.除去氯化钠晶体中混有的硝酸钾晶体
C.分离CCl4中的I2
D.分离苯和氯化钠溶液
9.某实验室仅有如下仪器或用具:烧杯、铁架台、铁圈、三脚架、漏斗、分液漏斗、石棉网、酒精灯、玻璃棒、量筒、蒸发皿、圆底烧瓶、火柴。从缺乏仪器的角度看,不
能进行的实验项是( )
A.蒸馏 B.萃取分液 C.蒸发 D.过滤
10.下来实验操作中错误的是( )
A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
C.氯化氢气体中含有的氯气可用饱和食盐水除去
D.蒸馏时,通入冷凝管的冷水却水应该从下边进,上边出
11.现有三组溶液:①汽油和氯化钠溶液 ②碘与CCl4溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
12.下列关于氧化物的叙述中不正确的是( )
A.部分非金属氧化物是酸性氧化物 B.碱性氧化物一部分是金属氧化物
C.酸性氧化物能强碱反应生成盐和水 D.部分碱性氧化物能与水反应生成相应的碱
13.下图表示的一些物质或概念间的从属关系中正确的是 ( )
| X | Y | Z |
A | 过氧化钠 | 碱性氧化物 | 氧化物 |
B | 硫酸 | 化合物 | 电解质 |
C | 淀粉溶液 | 胶体 | 分散系 |
D | 置换反应 | 氧化还原反应 | 离子反应 |
14.高一学生小强的化学笔记中有如下内容:
①物质按照组成可以分为单质和化合物
②单质又可分为金属单质和非金属单质
③化合物主要包括:酸、碱、盐和氧化物
④按照分散质粒子直径大小可将分散系分为溶液、浊液和胶体
⑤溶液呈电中性,胶体带有电荷
你认为他的笔记中有几处错误( )
A.二处 B.三处 C.四处 D.五处
15.有一瓶14%的KOH溶液,加热蒸发掉100g水后,变为28%的KOH溶液80mL,这80mL溶液的物质的量浓度为 )( )
A.5mol/L B.6mol/L C.6.25mol/L D.6.75mol/L
16.下列各组物质中,分子数不相同的是( )
A.同温同压下2 L SO2和2 L CO2 B.9g水和标准状况下11.2 L CO2
C.标准状况下1mol氧气和22.4 L乙醇 D.0.2mol氯气和7.3g氯化氢气体
17.常温下有①0.112L水;②3.01×1023个氯化氢分子;③13.6 g H2S气体;④0.2 mol氨气,下列对这四种物质的关系由小到大排列正确的是( )
A.分子数:①③②④ B.密度:④①③②
C.质量①④③ D.氢原子数:②④③①
18.同温同压下,等质量的氧气和二氧化碳相比较,下列叙述正确的是( )
A.质子数之比为1∶1 B.氧原子数比为8∶11
C.物质的量之比为8∶11 D.原子个数比1∶1
19.下列各组物质可按溶解、过滤、蒸发的操作顺序进行分离的是( )
A.氧化铜与氧化铁 B.硝酸钾与硝酸钠
C.四氯化碳与汽油 D.硫酸钠与氯化银
20.如图是10mL量筒的一部分,数字xy之间相差2 mL,若x=5,则量筒所盛液体的体积是( )
A.4.4 mL B.3.8 mL C.3.6 mL D.4.7 mL
第II卷(非选择题)
二、填空题(共20空,每空2分,共计40分。)
21.(10分)选取下列实验方法分离物质,将最佳分离方法的序号填在横线上。
A.萃取分液法 B.升华法 C.分液法 D.蒸馏法 E.过滤法
(1)__________分离饱和食盐水与沙子的混合物。
(2)______________分离水和汽油的混合物。
(3)_________分离四氯化碳(沸点为76.75 ℃)和甲苯(沸点为110.6 ℃)的混合物。
(4)_________分离碘水中的碘
(5)_________分离氯化钠固体和碘固体的混合物
22.(16分)(1)在标准状况下,CO和CO2的混合气体共28L,质量为51g。其中CO2的质量为_____g,混合气体中CO的物质的量分数为____。混合气体的平均摩尔质量为_______。
(2)同温同压下,同质量的NH3和H2S气体体积比为______,原子个数之比为______,密度之比为________。
(3)在120℃时分别进行如下四个反应(除S外其它物质均为气体):
A.2H2S+O2=2H2O+2S↓ B.2H2S+3O2=2H2O+2SO2
C.C2H4+3O2=2H2O+2CO2 D.C4H8+6O2=4H2O+4CO2
若反应在压强恒定、容积可变的容器内进行,反应前后气体密度(d)和气体体积(V)分别符合关系式d前>d后和V前<V后的是___________;符合d前>d后和V前>V后的是 ___________(填写反应的代号)。
23.(14分)KOH是实验室里常用的一种试剂,实验室里配置KOH溶液时,既可以使用浓溶液稀释法配制也可以使用固体KOH来配制。实验室现在需要配制480mL 2.0mol/L的KOH溶液,请回答下列问题:
(1)若用固体KOH配置,则需用托盘天平称取KOH的质量________________g
(2)若用10mol/L KOH的浓溶液来配置,则使用量筒量取该溶液的体积为_____________mL
(3)容量瓶上需标有以下五项中的__________________________。
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(4)浓溶液稀释法中配制KOH过程中,若使用量筒量取一定体积的浓KOH溶液时,读数时俯视刻度线,则所配制溶液的物质的量浓度会_________(填偏高、偏低或不变)
(5)请填空完成该实验的实验步骤
① ,② , ③溶解转移 ,④ ,⑤定容摇匀。
【参考答案】
1.C2.D3.A4.C5.C6.C7.C8.D9.A10.C11.C12.B13.C14.B15.C16.C
17.D18.A19.D20.C
21. E C D A B
22.44 20% 40.8g/mol 2:1 8:3 1:2 D A
23.56 100 ①③⑤ 偏低 ①计算 ②称量 ④洗涤转移








