
2020届二轮复习 实验操作与结论分析 作业(江苏专用) 练习
展开实验操作与结论分析
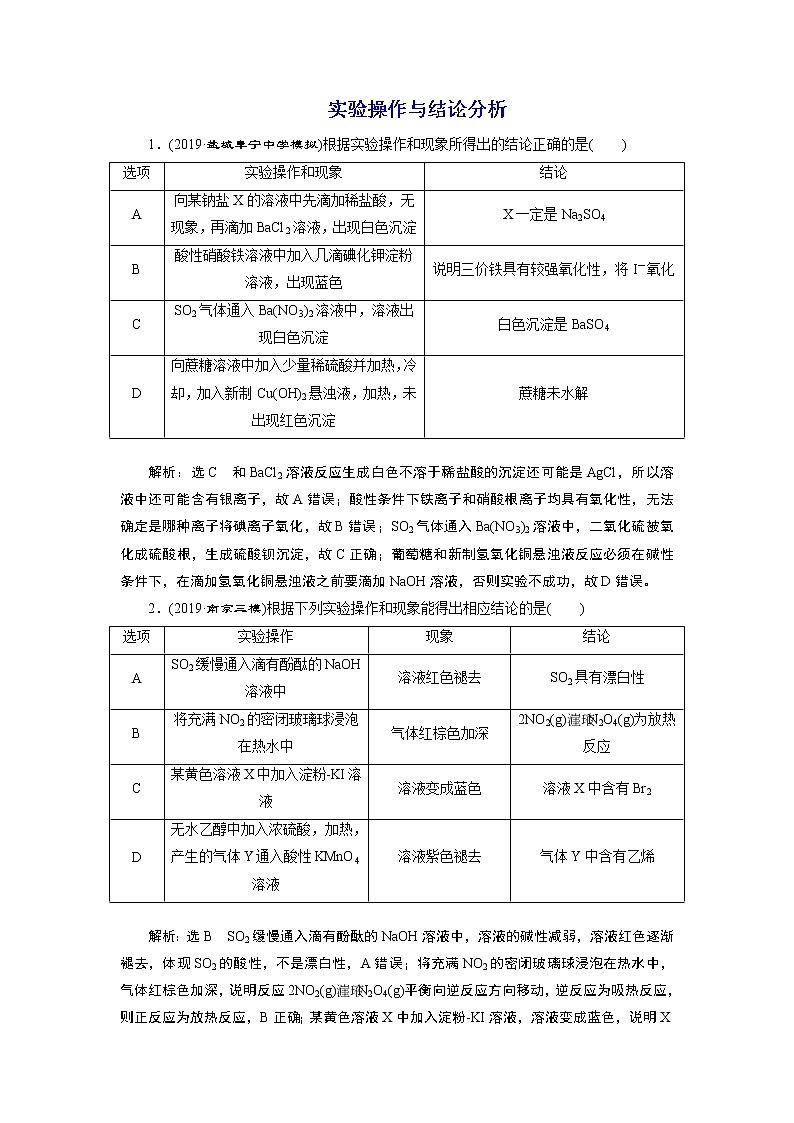
1.(2019·盐城阜宁中学模拟)根据实验操作和现象所得出的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 向某钠盐X的溶液中先滴加稀盐酸,无现象,再滴加BaCl2溶液,出现白色沉淀 | X一定是Na2SO4 |
B | 酸性硝酸铁溶液中加入几滴碘化钾淀粉溶液,出现蓝色 | 说明三价铁具有较强氧化性,将I-氧化 |
C | SO2气体通入Ba(NO3)2溶液中,溶液出现白色沉淀 | 白色沉淀是BaSO4 |
D | 向蔗糖溶液中加入少量稀硫酸并加热,冷却,加入新制Cu(OH)2悬浊液,加热,未出现红色沉淀 | 蔗糖未水解 |
解析:选C 和BaCl2溶液反应生成白色不溶于稀盐酸的沉淀还可能是AgCl,所以溶液中还可能含有银离子,故A错误;酸性条件下铁离子和硝酸根离子均具有氧化性,无法确定是哪种离子将碘离子氧化,故B错误;SO2气体通入Ba(NO3)2溶液中,二氧化硫被氧化成硫酸根,生成硫酸钡沉淀,故C正确;葡萄糖和新制氢氧化铜悬浊液反应必须在碱性条件下,在滴加氢氧化铜悬浊液之前要滴加NaOH溶液,否则实验不成功,故D错误。
2.(2019·南京三模)根据下列实验操作和现象能得出相应结论的是( )
选项 | 实验操作 | 现象 | 结论 |
A | SO2缓慢通入滴有酚酞的NaOH溶液中 | 溶液红色褪去 | SO2具有漂白性 |
B | 将充满NO2的密闭玻璃球浸泡在热水中 | 气体红棕色加深 | 2NO2(g)N2O4(g)为放热反应 |
C | 某黄色溶液X中加入淀粉KI溶液 | 溶液变成蓝色 | 溶液X中含有Br2 |
D | 无水乙醇中加入浓硫酸,加热,产生的气体Y通入酸性KMnO4溶液 | 溶液紫色褪去 | 气体Y中含有乙烯 |
解析:选B SO2缓慢通入滴有酚酞的NaOH溶液中,溶液的碱性减弱,溶液红色逐渐褪去,体现SO2的酸性,不是漂白性,A错误;将充满NO2的密闭玻璃球浸泡在热水中,气体红棕色加深,说明反应2NO2(g)N2O4(g)平衡向逆反应方向移动,逆反应为吸热反应,则正反应为放热反应,B正确;某黄色溶液X中加入淀粉KI溶液,溶液变成蓝色,说明X具有氧化性,可能含有Br2、Fe3+等,C错误;无水乙醇中加入浓硫酸,加热,产生的气体Y通入酸性KMnO4溶液,溶液紫色褪去,由于乙醇挥发,也能使酸性KMnO4溶液紫色褪去,故使酸性KMnO4溶液紫色褪去的不一定是乙烯,D错误。
3.(2019·南通一模)下列设计的实验方案能达到实验目的的是( )
A.检验亚硫酸钠溶液是否变质:取少量溶液,向其中加入硝酸酸化的硝酸钡溶液
B.制取乙酸乙酯:向试管中加入碎瓷片,再依次加入3 mL乙醇、2 mL浓硫酸和2 mL乙酸,用酒精灯加热,将产生的蒸气经导管通到饱和氢氧化钠溶液的上方
C.除去溴化钠溶液中混有的碘化钠:向溶液中加入稍过量溴水,充分反应后,加入四氯化碳,振荡后静置、分液,取上层溶液
D.探究温度对反应速率的影响:将2支均装有5 mL 0.1 mol·L-1硫代硫酸钠溶液的试管分别置于冰水和热水中,再同时向试管中加入5 mL 0.1 mol·L-1稀硫酸
解析:选CD 由于硝酸会把SO氧化生成SO,不能用硝酸酸化的硝酸钡溶液检验亚硫酸钠溶液是否变质,A错误;制取乙酸乙酯时,将产生的蒸气经导管通到饱和碳酸钠溶液的上方,B错误;除去溴化钠溶液中混有的碘化钠:向溶液中加入稍过量溴水,使碘离子氧化,充分反应后,加入四氯化碳,萃取出溶液中的I2和过量的Br2,振荡后静置、分液,上层溶液即为溴化钠溶液,C正确;保持其它条件不变,只改变温度可探究温度对反应速率的影响,则D正确。
4.根据下列实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 实验结论 |
A | 向酸性含碘废水中加入淀粉溶液,然后滴入少量Na2SO3溶液,废水立刻变蓝色 | 该废水中可能含IO |
B | 向Fe(NO3)3溶液中加入铁粉,充分振荡,再滴加少量盐酸酸化后,滴入1滴KSCN溶液,溶液变红 | 原Fe(NO3)3只有部分被Fe还原 |
C | 向1溴丙烷中加入KOH溶液,加热并充分振荡,然后取少量液体滴入AgNO3溶液,出现棕黑色沉淀 | 1溴丙烷中混有杂质 |
D | Al2(SO4)3溶液蒸发结晶后得到白色固体 | 该固体成分为Al2O3 |
解析:选A Na2SO3具有还原性,酸性含碘废水中加入淀粉和Na2SO3溶液后变蓝色,即有I2生成,S元素的化合价升高,则I元素化合价一定降低,即可能含IO,故A正确;加入的盐酸使NO具有了强氧化性,将Fe2+氧化为Fe3+,遇KSCN溶液变红色,因此Fe(NO3)3不一定是部分被Fe还原,故B错误;滴加AgNO3溶液,出现棕黑色沉淀,可能是KOH与AgNO3反应生成AgOH,AgOH不稳定又生成Ag2O,不能说明1溴丙烷中混有杂质,故C错误;由于H2SO4是难挥发的酸,故Al2(SO4)3溶液蒸干后仍然得到Al2(SO4)3固体,故D错误。
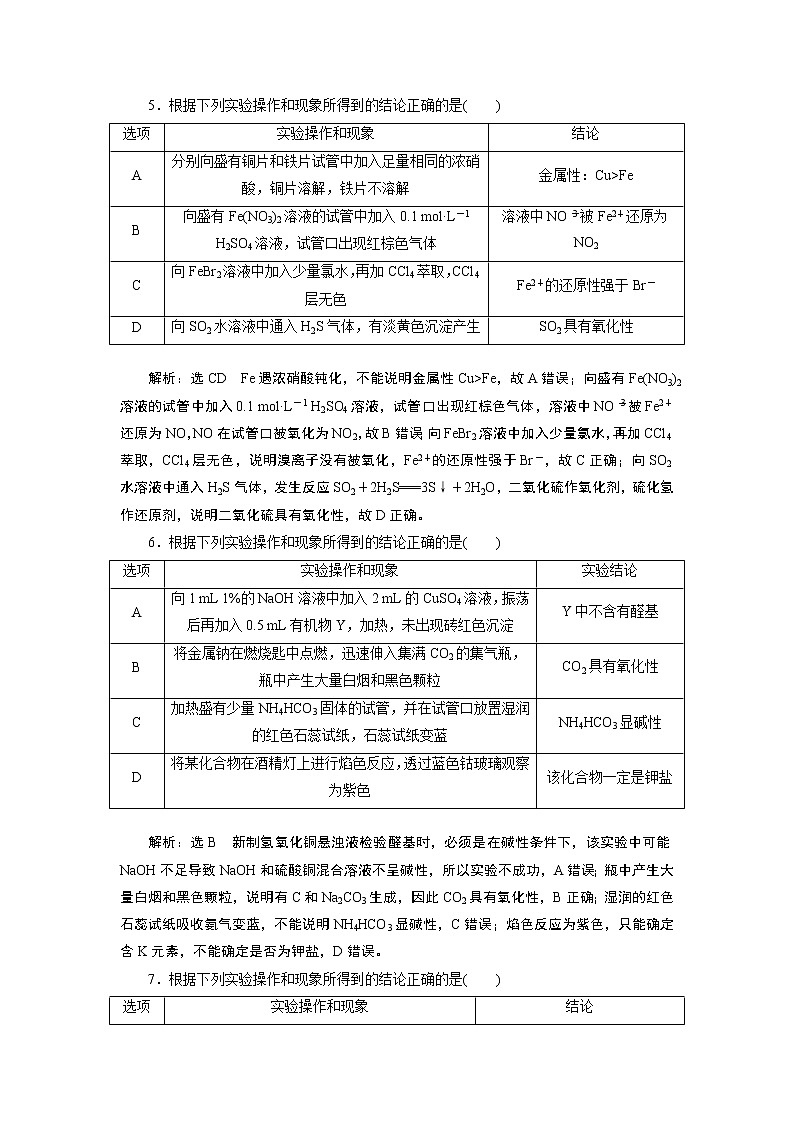
5.根据下列实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 分别向盛有铜片和铁片试管中加入足量相同的浓硝酸,铜片溶解,铁片不溶解 | 金属性:Cu>Fe |
B | 向盛有Fe(NO3)2溶液的试管中加入0.1 mol·L-1 H2SO4溶液,试管口出现红棕色气体 | 溶液中NO被Fe2+还原为NO2 |
C | 向FeBr2溶液中加入少量氯水,再加CCl4萃取,CCl4层无色 | Fe2+的还原性强于Br- |
D | 向SO2水溶液中通入H2S气体,有淡黄色沉淀产生 | SO2具有氧化性 |
解析:选CD Fe遇浓硝酸钝化,不能说明金属性Cu>Fe,故A错误;向盛有Fe(NO3)2溶液的试管中加入0.1 mol·L-1 H2SO4溶液,试管口出现红棕色气体,溶液中NO被Fe2+还原为NO,NO在试管口被氧化为NO2,故B错误;向FeBr2溶液中加入少量氯水,再加CCl4萃取,CCl4层无色,说明溴离子没有被氧化,Fe2+的还原性强于Br-,故C正确;向SO2水溶液中通入H2S气体,发生反应SO2+2H2S===3S↓+2H2O,二氧化硫作氧化剂,硫化氢作还原剂,说明二氧化硫具有氧化性,故D正确。
6.根据下列实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 实验结论 |
A | 向1 mL 1%的NaOH溶液中加入2 mL的CuSO4溶液,振荡后再加入0.5 mL有机物Y,加热,未出现砖红色沉淀 | Y中不含有醛基 |
B | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶,瓶中产生大量白烟和黑色颗粒 | CO2具有氧化性 |
C | 加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸,石蕊试纸变蓝 | NH4HCO3显碱性 |
D | 将某化合物在酒精灯上进行焰色反应,透过蓝色钴玻璃观察为紫色 | 该化合物一定是钾盐 |
解析:选B 新制氢氧化铜悬浊液检验醛基时,必须是在碱性条件下,该实验中可能NaOH不足导致NaOH和硫酸铜混合溶液不呈碱性,所以实验不成功,A错误;瓶中产生大量白烟和黑色颗粒,说明有C和Na2CO3生成,因此CO2具有氧化性,B正确;湿润的红色石蕊试纸吸收氨气变蓝,不能说明NH4HCO3显碱性,C错误;焰色反应为紫色,只能确定含K元素,不能确定是否为钾盐,D错误。
7.根据下列实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 相同条件下,分别测量0.1 mol·L-1和0.01 mol·L-1醋酸溶液的导电性,前者的导电性强 | 醋酸浓度越大,电离程度越大 |
B | 向Co2O3固体中滴加浓盐酸,有黄绿色气体生成 | 氧化性: Co2O3>Cl2 |
C | 向淀粉溶液中滴加少量稀硫酸,水浴加热一段时间后冷却,向溶液中滴加碘水,溶液变蓝 | 淀粉未发生水解 |
D | 常温下,分别测量浓度均为0.1 mol·L-1的Na2S溶液和NaClO溶液的pH,前者的pH大 | 酸性: HClO>H2S |
解析:选B 溶液的导电性与离子浓度有关,与电离程度无必然关系,A错误;黄绿色气体为Cl2,发生反应Co2O3+6HCl===2CoCl2+Cl2↑+3H2O,可知Co2O3的氧化性强于Cl2,B正确;碘水变蓝说明水解后的溶液中仍然含有淀粉,可能是未完全水解,C错误;由于Na2S溶液的pH大,故S2-水解生成HS-的程度大,根据“越弱越水解”可知,酸性HClO>HS-,D错误。
8.根据下列实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 实验结论 |
A | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色 | 该溶液中一定不含K+ |
B | 将稀盐酸滴入硅酸钠溶液中,充分振荡,有白色沉淀产生 | 非金属性:Cl>Si |
C | 向淀粉溶液中加入稀硫酸并加热,再加入银氨溶液,水浴加热,未见有银镜产生 | 淀粉没有水解 |
D | 相同条件下,在两支试管中各加入4 mL 0.01 mol·L-1 KMnO4和2 mL 0.1 mol·L-1 H2C2O4,再向其中一支试管中快速加入少量MnSO4固体,加有MnSO4的试管中溶液褪色较快 | MnSO4对该反应有催化作用 |
解析:选D 用铂丝进行焰色反应,火焰呈黄色,说明一定含有Na元素,可能含有K元素,要判断是否含有K元素要透过蓝色钴玻璃观察,A错误;元素最高价氧化物对应水化物的酸性越强,其非金属性越强,HCl不是Cl元素的最高价氧化物对应水化物,B错误;检验淀粉是否水解时,应先加入碱将稀H2SO4中和后再加银氨溶液,C错误;加有MnSO4的试管中溶液褪色较快,说明MnSO4对该反应有催化作用,D正确。
9.下列设计的实验方案能达到实验目的的是( )
A.制备银氨溶液:向2%的氨水中逐滴加入足量的2%的AgNO3溶液
B.除去MgCl2溶液中少量FeCl3:向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌,充分反应后过滤
C.比较Ag2CO3与AgCl溶度积大小:向浓度均为0.1 mol·L-1的Na2CO3和NaCl的混合溶液中滴加0.1 mol·L-1 AgNO3溶液,观察现象
D.验证Fe3+与I-的反应有一定限度:向5 mL 0.1 mol·L-1 KI溶液中滴入0.1 mol·L-1 FeCl3溶液5~6滴,加2 mL CCl4振荡,静置后取上层清液滴加KSCN溶液,观察现象
解析:选BD 制备银氨溶液时应将氨水逐滴加入到AgNO3溶液中,A错误;加入Mg(OH)2调节溶液的pH,可以使FeCl3生成Fe(OH)3而除去,B正确;由于Ag2CO3和AgCl电离出的阴、阳离子个数比不同,无法通过生成沉淀的先后来比较Ksp的大小,C错误;加入CCl4后振荡,溶液呈紫红色,说明有I2生成,加入KSCN后溶液变为红色,说明Fe3+未反应完,D正确。
10.下列实验现象与对应结论均正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 燃着的镁条伸入盛CO2的集气瓶中 | 镁条继续燃烧 | 镁有比较强的还原性 |
B | 用容量瓶配制溶液时,定容后摇匀 | 液面低于刻度线 | 浓度一定偏高 |
C | 向某溶液中加入酸化的硝酸钡溶液 | 有白色沉淀生成 | 原溶液中含有SO |
D | 将刚切开的钠块露置在空气中 | 表面变暗 | 钠表面生成Na2O2 |
解析:选A B项中,操作和现象都正确,浓度是准确的;C项中,如果原溶液中有亚硫酸根也会被硝酸氧化生成SO,有同样的现象;D项中,结论错误,生成的是Na2O。
11.(2019·南通七市三模)下列设计的实验方案能达到实验目的的是( )
A.检验乙烯是否具有还原性:向乙醇中加入少量浓硫酸并加热,将所得的气体通入酸性KMnO4溶液
B.除去NaHCO3溶液中混有的Na2CO3:向含有Na2CO3的NaHCO3溶液中加入适量CaCl2溶液,过滤
C.检验海带中是否含有碘元素:将干海带剪碎、灼烧成灰,用蒸馏水浸泡后过滤,向滤液中加入2~3滴淀粉溶液,再滴加少量新制氯水
D.比较水和乙醇分子中羟基氢原子的活泼性:相同温度下,取等体积水、乙醇,向其中分别加入相同大小的金属
解析:选CD 向乙醇中加入少量浓硫酸并加热,所得的气体可能含有乙烯、乙醚、乙醇、SO2、CO2等,将所得的气体通入酸性KMnO4溶液,KMnO4的紫红色褪去,能使KMnO4的紫红色褪去的有乙烯、乙醇、SO2等,故不能说明乙烯具有还原性,A错误;向含有Na2CO3的NaHCO3溶液中加入适量CaCl2溶液,过滤可以除去Na2CO3,但引入了新杂质NaCl,故不可用此方法,正确的方法是向溶液中通入足量的CO2,B错误;将干海带剪碎、灼烧成灰,用蒸馏水浸泡后过滤,滤液中含I-,向滤液中加入2~3滴淀粉溶液,溶液不变色,再滴加少量新制氯水,I-被氧化成I2,使淀粉变蓝,故此方法能检验海带中是否含有碘元素,C正确;通过观察产生气泡的速率可以比较水和乙醇分子中羟基氢原子的活泼性,D正确。
12.下列实验操作和现象与预期实验目的或结论一致的是( )
选项 | 实验操作和现象 | 预期实验目的或结论 |
A | 用洁净的铂丝蘸取某食盐试样,在酒精灯火焰上灼烧,火焰显黄色 | 说明该食盐不是加碘盐 |
B | 银氨溶液中滴入少量组成为C2H4O2的液态有机物,水浴微热,有银镜出现 | 可确定该有机物一定是甲酸甲酯 |
C | 向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡:II2+I- |
D | 浓硫酸与乙醇170 ℃共热,制得的气体通入酸性高锰酸钾溶液,溶液紫色褪去 | 制得的气体产物为乙烯 |
解析:选C 钾的焰色反应能被钠的焰色反应所掩盖,观察钾的焰色反应要透过蓝色钴玻璃,则该实验中不能确定是否含KIO3,A错误;银氨溶液中滴入少量组成为C2H4O2的液态有机物,水浴微热,有银镜出现,一定含—CHO,可能为HOCH2CHO或甲酸甲酯,B错误;向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀,则KI3的溶液中含I2、I-,即KI3溶液中存在平衡为II2+I-,C正确;生成的乙烯中混有乙醇、SO2等杂质,均能被氧化,故应先除去杂质气体后,再通入酸性高锰酸钾溶液,观察到溶液紫色很快褪去,证明反应生成了乙烯,D错误。








