2020届二轮复习 元素及其化合物 学案(全国通用) (1)
展开专题五 元素及其化合物
主干知识梳理
常见元素及其化合物的转化关系
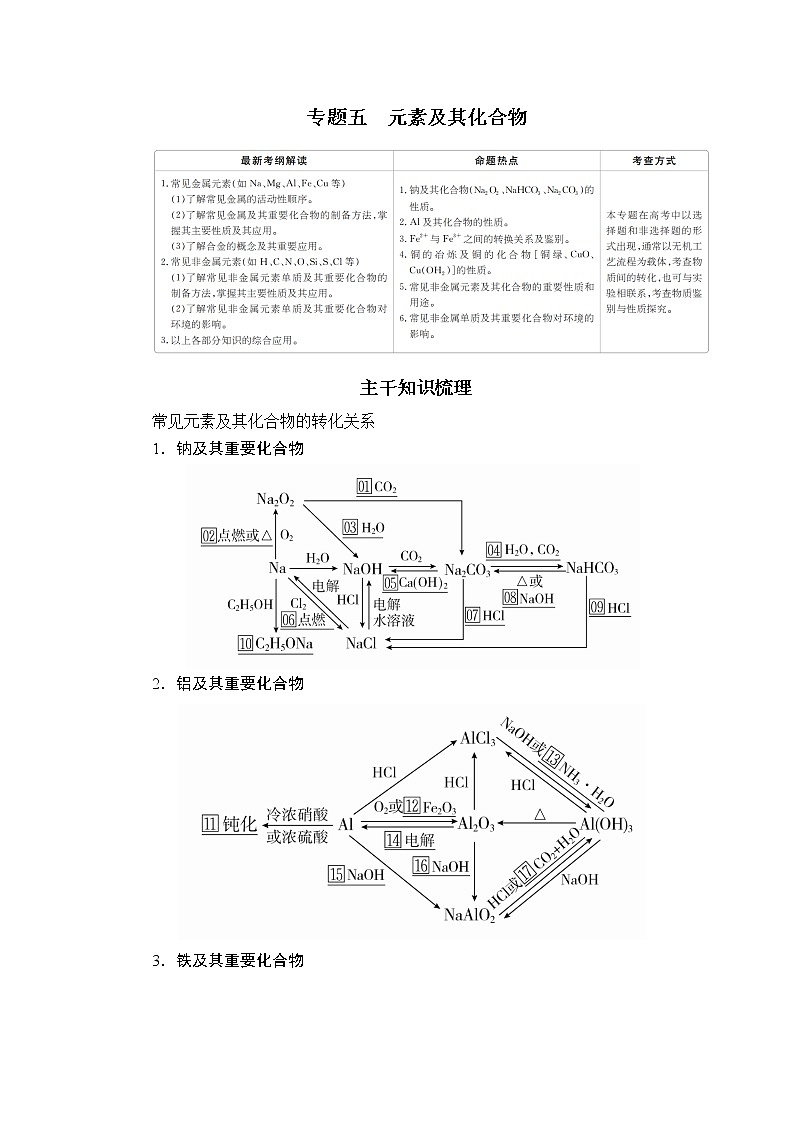
1.钠及其重要化合物
2.铝及其重要化合物
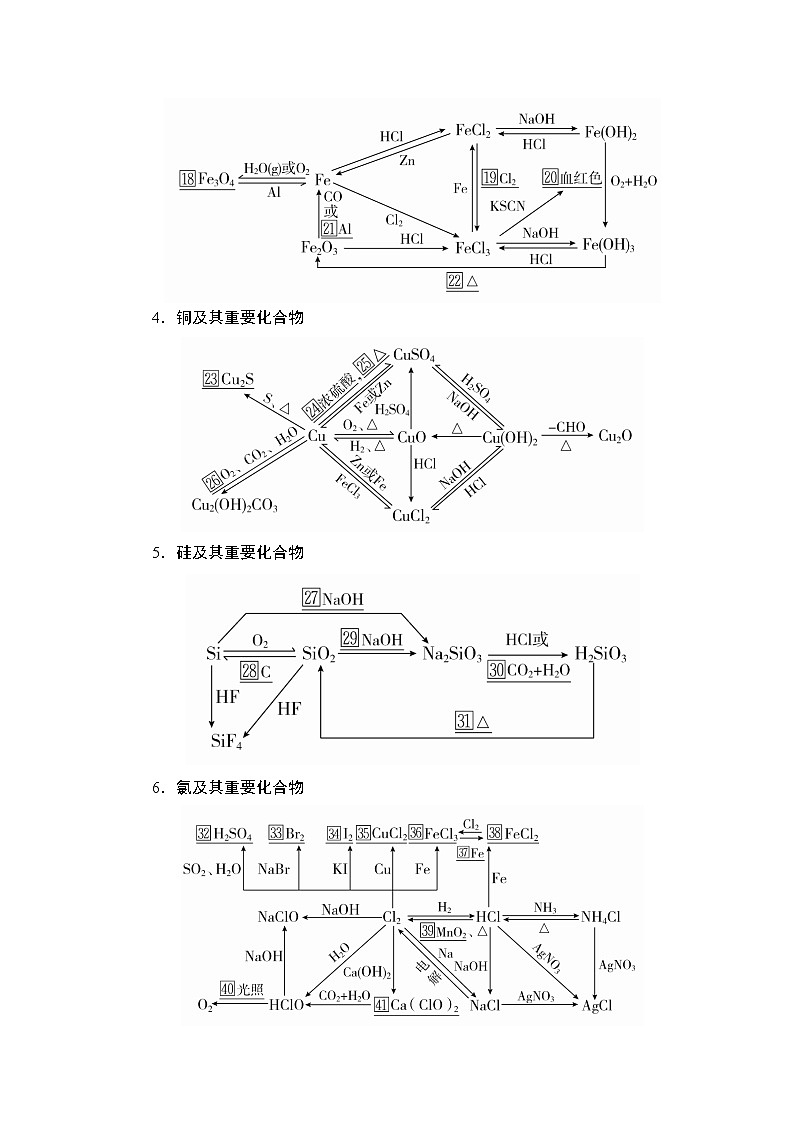
3.铁及其重要化合物
4.铜及其重要化合物
5.硅及其重要化合物
6.氯及其重要化合物
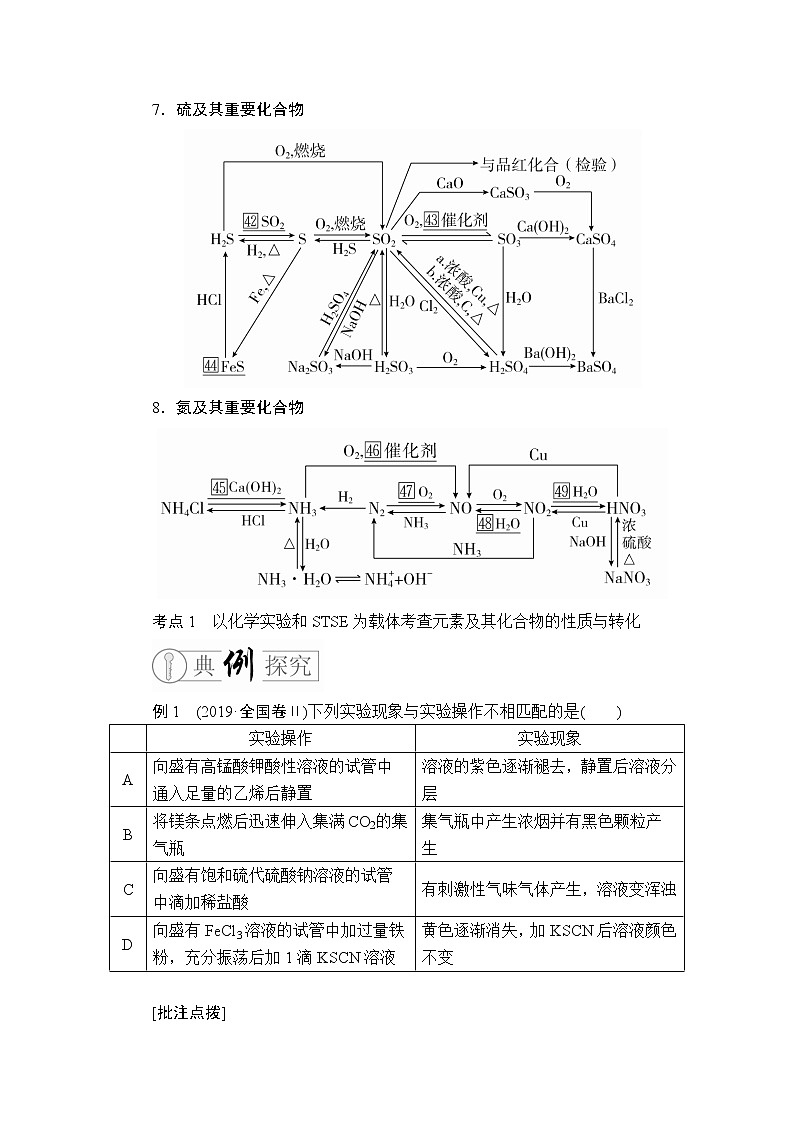
7.硫及其重要化合物
8.氮及其重要化合物
考点1 以化学实验和STSE为载体考查元素及其化合物的性质与转化
例1 (2019·全国卷Ⅱ)下列实验现象与实验操作不相匹配的是( )
| 实验操作 | 实验现象 |
A | 向盛有高锰酸钾酸性溶液的试管中通入足量的乙烯后静置 | 溶液的紫色逐渐褪去,静置后溶液分层 |
B | 将镁条点燃后迅速伸入集满CO2的集气瓶 | 集气瓶中产生浓烟并有黑色颗粒产生 |
C | 向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸 | 有刺激性气味气体产生,溶液变浑浊 |
D | 向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液 | 黄色逐渐消失,加KSCN后溶液颜色不变 |
[批注点拨]
[解析] 乙烯与酸性高锰酸钾溶液反应生成Mn2+(紫色褪去)和CO2、H2O,静置后溶液不分层;2Mg+CO22MgO+C;Na2S2O3+2HCl===2NaCl+S↓+SO2↑+H2O;2FeCl3+Fe===3FeCl2,Fe2+不能使KSCN显色,故答案为A。
[答案] A
一、金属及其化合物
1.掌握常见物质的颜色
Na2O(白色)、Na2O2(淡黄色)、MgO(白色)、Al2O3(白色)、Fe2O3(红棕色)、FeO(黑色)、Fe3O4(黑色)、CuO(黑色)、Cu(OH)2(蓝色)、Fe(OH)2(白色)、Fe(OH)3(红褐色)。
2.熟记四种物质的俗名
Na2CO3—纯碱、苏打,NaHCO3—小苏打,
KAl(SO4)2·12H2O—明矾,CuSO4·5H2O—胆矾、蓝矾。
3.知道十一种物质的重要用途
钠——制Na2O2、冶炼Ti等金属、钠钾合金作原子反应堆导热剂
铁粉——袋装食品中的脱氧剂
生石灰(CaO)——袋装食品中的干燥剂
氧化铁(Fe2O3)——红色涂料、冶炼铁
氧化铝(Al2O3)——耐火材料、冶炼铝
氢氧化铝——中和胃酸
明矾(KAl(SO4)2·12H2O)——净水剂
氯化铁——印刷电路板回收铜、净水剂
小苏打(NaHCO3)——治疗胃酸过多、发酵粉、灭火剂
纯碱(Na2CO3)——去油污
高铁酸钠(Na2FeO4)——杀菌、消毒、净水
4.掌握两个数据
等量的铝与足量的NaOH溶液、盐酸反应,产生H2的物质的量之比为1∶1,消耗NaOH、HCl的物质的量之比为1∶3。
5.掌握常见认识误区
(1)Na2O2的认识误区
①Na2O2不是碱性氧化物。
②Na2O2与CO2或H2O反应时,Na2O2既是氧化剂又是还原剂。
③过氧化钠中阴离子为O。
(2)铝及其重要化合物“两性”的理解
①铝可与强酸、强碱反应,但铝不能叫两性元素。
②Al2O3、Al(OH)3分别属于两性氧化物、两性氢氧化物,但它们只能与强酸、强碱反应。
③既能与酸反应生成气体,又能与碱反应生成气体的物质未必一定是Al,还可能是(NH4)2CO3或NH4HCO3等。
(3)Fe3+、Fe2+的检验误区
①溶液中加入KSCN溶液,溶液变红色,只能说明溶液中含有Fe3+,无法证明是否含有Fe2+。
②当溶液中含有Fe3+时,若要检验是否含Fe2+只能利用Fe2+的还原性,如加入KMnO4溶液,看紫色是否褪去。
③某溶液中加入碱溶液后,最终得到红褐色沉淀,并不能断定该溶液中一定含有Fe3+,也可能含有Fe2+。
二、非金属及其化合物
1.Si与强碱溶液的反应
非金属单质与碱液反应一般无H2放出,但Si除外:
Si+2NaOH+H2O===Na2SiO3+2H2↑。
2.SiO2的性质
二氧化硅存在以下两个反应:①SiO2+4HF===SiF4↑+2H2O;②SiO2+2NaOH===Na2SiO3+H2O,但二氧化硅不是两性氧化物。
3.浓度变化对反应的影响
(1)Cu+H2SO4(稀)―→不反应;
Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O。
(2)MnO2+HCl(稀)―→不反应;
MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑。
(3)3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O;
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O。
4.注意区分SO2的还原性和漂白性
如SO2使溴水褪色体现了SO2的还原性;而SO2的漂白性是由于它溶于水与有色物质直接化合,形成不稳定的无色化合物。
5.NH3的实验室制法
(1)反应原理:2NH4Cl+Ca(OH)22NH3↑+CaCl2+2H2O。
(2)实验装置:固体+固体气体。
(3)净化措施:用碱石灰干燥。
(4)收集方法:用向下排空气法收集。
(5)验满方法:用湿润的红色石蕊试纸或蘸有浓盐酸的玻璃棒靠近试管口。
6.氯及其化合物中的热点
(1)HClO、HClO2、HClO3、HClO4酸性依次增强,但氧化性依次减弱。
(2)Cl2的实验室制法,氧化剂可以为
7.卤素化合物以次氯酸盐为重点
(1)ClO-类似NO,酸性环境氧化性增强,但ClO-又不同于NO,任何环境都体现氧化性,如ClO-与I-、Fe2+均不能共存。
(2)ClO-能水解,因HClO酸性很弱,ClO-水解显碱性,如ClO-+H2OOH-+HClO。
8.两大强酸与金属反应的有关规律
(1)硝酸与金属反应时存在着如下几条规律,可作为硝酸与金属反应计算的依据:
①反应中生成的NO和NO2气体的物质的量之和等于反应中被还原的硝酸的物质的量。
②反应中生成的NO和NO2的物质的量与生成的硝酸盐中NO的物质的量之和等于参加反应的硝酸的物质的量。
③反应所生成的氮的氧化物与O2混合后被水恰好完全吸收时,消耗的O2的量决定于反应的金属的物质的量,定量关系可依据得失电子守恒确定。
(2)硫酸与金属反应的规律
①稀硫酸具有弱氧化性,与金属活动性顺序表中排在氢后面的金属不反应,其氧化性由溶液中的H+表现;浓硫酸具有强氧化性,能氧化绝大多数金属,其氧化性由H2SO4分子中的+6价S表现,是强氧化性酸。
②浓硫酸与足量活泼金属反应时,其还原产物除SO2外,还有H2。这是因为随着反应的进行,硫酸不断消耗,水不断生成,硫酸的浓度逐渐变小,浓硫酸变成了稀硫酸,此时由H+表现氧化性,生成H2。
③浓硫酸与金属活动性顺序表中排在氢后面的金属反应时,不论金属是否足量,酸均不可能消耗完,还原产物只有SO2。
1.(2019·A10联考段考)下列说法错误的是( )
A.H2O2使氯水浅黄绿色褪去,体现了H2O2的漂白性
B.过量的铁在纯氧气中燃烧后所得固体,加稀盐酸溶解,再滴加KSCN溶液可能不变红色
C.向NaAlO2和Na2SiO3的混合溶液中通入过量的CO2,可以得到两种沉淀
D.浓硫酸和蔗糖混合产生的气体通入足量酸性KMnO4溶液中,气体不可能完全被吸收
答案 A
解析 H2O2使氯水浅黄绿色褪去,得到O2和Cl-,体现H2O2的还原性,并非漂白性,A错误;铁与氧气反应得到Fe3O4,Fe3O4再和盐酸反应得到FeCl3和FeCl2溶液,过量的Fe和Fe3+反应得到Fe2+,故滴加KSCN溶液可能不变血红色,B正确;NaAlO2与CO2反应得到Al(OH)3沉淀,Na2SiO3和CO2反应得到H2SiO3沉淀,C正确;浓硫酸和蔗糖混合产生的气体有SO2和CO2,SO2可以被酸性KMnO4溶液吸收,而CO2不能被酸性KMnO4溶液吸收,D正确。
2.(2019·河北武邑高三调研)甲、乙、丙、丁、戊五种物质是中学化学常见的物质,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去)。下列说法正确的是( )
A.若甲可以与NaOH溶液反应放出H2,则丙一定是两性氧化物
B.若甲为短周期中最活泼的金属,且戊为碱,则丙生成戊一定是氧化还原反应
C.若丙、丁混合产生大量白烟,则乙可能会使高锰酸钾溶液褪色
D.若甲、丙、戊都含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为甲<丙<戊
答案 D
解析 甲为单质,若甲可以与NaOH溶液反应放出H2,则甲为Al或Si,所以丙可能是氧化铝,也可能是二氧化硅,不一定是两性氧化物,故A错误;若甲为短周期中最活泼的金属,且戊为碱,则甲为Na,乙为氧气,所以丙可以为氧化钠或过氧化钠,当丙为氧化钠时,丙生成戊不是氧化还原反应,故B错误;丙、丁混合产生白烟,则丙、丁可为HCl和NH3或HNO3和NH3等,甲、乙均为单质,则乙可能是氯气、氢气或氮气,都不能使高锰酸钾溶液褪色,故C错误;若甲、丙、戊含有同一种元素,例如当甲为S、乙为氧气、丙为二氧化硫、丁为HClO等具有强氧化性的物质、戊为硫酸时,则含S元素的物质中S的化合价由低到高的顺序为甲<丙<戊,故D正确。
考点2 以无机化工流程图为载体考查元素及其化合物的性质与转化
例2 (2019·全国卷Ⅰ)硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工业。一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:
回答下列问题:
(1)在95 ℃“溶浸”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为_______________________。
(2)“滤渣1”的主要成分有__________。为检验“过滤1”后的滤液中是否含有Fe3+,可选用的化学试剂是________。
(3)根据H3BO3的解离反应:H3BO3+H2OH++B(OH),Ka=5.81×10-10,可判断H3BO3是__________酸;在“过滤2”前,将溶液pH调节至3.5,目的是_______________________。
(4)在“沉镁”中生成Mg(OH)2·MgCO3沉淀的离子方程式为_______________________,
母液经加热后可返回________工序循环使用。由碱式碳酸镁制备轻质氧化镁的方法是________。
[批注点拨]
[解析] 首先根据逆推法推出过滤1滤液中含有的成分,由沉镁得过滤1滤液中含Mg2+。由过滤2→H3BO3结合问题(3)推出过滤1滤液中含B(OH),再由硼镁矿的成分推知能溶于(NH4)2SO4溶液的是Mg2B2O5·H2O,故滤渣1为SiO2、Fe2O3、Al2O3。
(1)能溶解Mg2B2O5·H2O的实质是(NH4)2SO4产生的NH与H2O反应生成H+和NH3·H2O。其中H+的消耗使的NH向水解的方向进行,从而产生“气体”——NH3;NH3与NH4HCO3溶液反应生成(NH4)2CO3,产生的CO使Mg2+沉淀(沉镁)。
(2)检验“过滤1”滤液中是否含Fe3+可用试剂KSCN溶液,若变红,则含Fe3+,不变红,则不含Fe3+。
(3)根据H3BO3+H2OB(OH)+H+可知H3BO3是一元弱酸,调pH=3.5是为了让[B(OH)4]-转化为弱酸H3BO3从溶液中析出。
(4)根据流程图结合问题(1)和“过滤2”的成分可知反应物为MgSO4和(NH4)2CO3,则反应的离子方程式为2Mg2++3CO+2H2O===Mg(OH)2·MgCO3↓+2HCO[或2Mg2++2CO+H2O===Mg(OH)2·MgCO3↓+CO2↑],同时得到母液(NH4)2SO4溶液循环使用,用于溶浸硼镁矿;难溶的金属的氢氧化物和碳酸盐高温焙烧能分解生成金属氧化物、水和CO2。
[答案] (1)NH4HCO3+NH3===(NH4)2CO3
(2)SiO2、Fe2O3、Al2O3 KSCN
(3)一元弱 转化为H3BO3,促进析出
(4)2Mg2++3CO+2H2O===Mg(OH)2·MgCO3↓+2HCO[或2Mg2++2CO+H2O===Mg(OH)2·MgCO3↓+CO2↑] 溶浸 高温焙烧
1.原料预处理的五种措施
研磨 | 减小固体的颗粒度,增大固体与液体或气体的接触面积,加快反应速率 |
水浸 | 与水接触反应或溶解 |
酸浸 | 与酸接触反应或溶解,使可溶性金属离子进入溶液,不溶物通过过滤除去 |
灼烧 | 除去可燃性杂质或使原料初步转化,如从海带中提取碘时的灼烧就是为了除去可燃性杂质 |
煅烧 | 改变结构,使一些物质能溶解,并使一些杂质在高温下氧化、分解,如煅烧高岭土 |
2.物质提纯的六种方法
方法 | 目的 |
水溶法 | 除去可溶性杂质 |
酸溶法 | 除去碱性杂质 |
碱溶法 | 除去酸性杂质 |
氧化剂或还原剂法 | 除去还原性或氧化性杂质 |
加热灼烧法 | 除去受热易分解或易挥发的杂质 |
调节pH法 | 如除去酸性铜盐溶液中的Fe3+等 |
3.审题技巧
无机化工流程题中经常会出现一些表述性词语,这些表述性词语常为隐性信息,它可以暗示我们审题所应考虑的角度。常见的有:
(1)“控制较低温度”——常考虑物质的挥发、物质的不稳定性等。
(2)“加过量试剂”——常考虑反应完全或增大转化率、产率等。
(3)“能否加其他物质”——常考虑会不会引入杂质或是否影响产品的纯度。
(4)“在空气中或在其他气体中”——主要考虑O2、H2O、CO2或其他气体是否参与反应或达到防氧化、防水解、防潮解等目的。
(5)“控制pH”——常考虑防水解、促进生成沉淀或除去杂质等。
(6)“用某些有机试剂清洗”——常考虑降低物质溶解度,有利于析出、减少损耗和提高利用率等。
4.无机化工流程题的解题步骤
第一步:要通过学过的化学知识明确原料和产品(包括副产品)间的转化关系,即箭头方向所代表的含义。
第二步:分析流程中的每一步骤,从几个方面了解流程:①反应物是什么;②发生了什么反应;③该反应造成了什么后果,对制造产品有什么作用。抓住一个关键点:一切反应或操作都是为获得产品而服务的。
第三步:由于该类试题多与实际的工业生产相联系,有些问题就需要从生产成本、物质的循环利用、环境污染等角度进行考虑。
第四步:注意从题设问题中获取信息,帮助解题。
3.(2018·全国卷Ⅰ)焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛。回答下列问题:
(1)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。写出该过程的化学方程式:__________________________________。
(2)利用烟道气中的SO2生产Na2S2O5的工艺为:
①pH=4.1时,Ⅰ中为________溶液(写化学式)。
②工艺中加入Na2CO3固体,并再次充入SO2的目的是______________________________。
答案 (1)2NaHSO3===Na2S2O5+H2O
(2)①NaHSO3 ②得到NaHSO3过饱和溶液
解析 (1)亚硫酸氢钠过饱和溶液经结晶脱水生成焦亚硫酸钠,根据原子守恒可知反应的方程式为2NaHSO3===Na2S2O5+H2O。
(2)①碳酸钠饱和溶液吸收SO2后的溶液显酸性,说明生成物是酸式盐,即Ⅰ中为NaHSO3溶液。②要制备焦亚硫酸钠,需要制备亚硫酸氢钠过饱和溶液,因此工艺中加入碳酸钠固体、并再次充入二氧化硫的目的是得到NaHSO3过饱和溶液。
4.(2019·安徽舒城高三统考)铁是人类较早使用的金属之一。运用铁及其化合物的有关知识,回答下列问题:
(1)铁和铁合金是生活中的常用材料,下列叙述中正确的是________。
A.纯铁硬度比生铁高
B.纯铁耐腐蚀性强,不易生锈
C.不锈钢是铁合金,只含金属元素
D.铁在一定条件下,可与水蒸气反应
E.铁在冷的浓硫酸或浓硝酸中钝化,加热也不反应
(2)向沸水中逐滴滴加1 mol·L-1FeCl3溶液,至液体呈透明的红褐色,该反应的离子方程式为__________________________。
(3)高铁酸钠Na2FeO4是一种新型消毒净水剂。
①高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH===2Na2FeO4+3X+5H2O,则X的化学式为____________。
②高铁酸钠在水中可以发生如下反应:4FeO+10H2O4Fe(OH)3+8OH-+3O2↑。高铁酸钠能够杀菌消毒是因为它具有________性,使用高铁酸盐处理饮用水的优点是______________________________。
③下列物质能作饮用水净水剂的有________。
A.KAl(SO4)2·12H2O B.[Fe(OH)(SO4)]n
C.ClO2 D.“84”消毒液
答案 (1)BD
(2)Fe3++3H2OFe(OH)3(胶体)+3H+
(3)①NaCl ②强氧化 杀菌消毒、净水同时完成,无毒绿色环保
③AB
解析 (1)生铁属于合金,比纯铁硬度高,A错误;纯铁不易形成原电池,耐腐蚀性强,不易生锈,B正确;不锈钢是铁合金,含有碳元素,C错误;铁在一定条件下,可与水蒸气反应,生成四氧化三铁和氢气,D正确;铁在冷的浓硫酸或浓硝酸中钝化,加热会发生反应,E错误。
(2)向沸水中逐滴滴加1 mol·L-1 FeCl3溶液,至液体呈透明的红褐色,该反应的离子方程式为Fe3++3H2OFe(OH)3(胶体)+3H+。
(3)①高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH===2Na2FeO4+3X+5H2O,根据得失电子守恒和质量守恒,则X的化学式为NaCl。②高铁酸钠在水中可以发生如下反应:4FeO+10H2O4Fe(OH)3+8OH-+3O2↑。高铁酸钠能够杀菌消毒是因为它具有强氧化性,生成的氢氧化铁有吸附性,能净水,故使用高铁酸盐处理饮用水的优点是杀菌消毒、净水同时完成,无毒绿色环保。③KAl(SO4)2·12H2O水解生成的氢氧化铝胶体和[Fe(OH)(SO4)]n水解生成的氢氧化铁胶体都吸附水中的杂质,从而起净水作用,ClO2和“84”消毒液只能杀菌消毒,不能净水。








