
2020届二轮复习 分子结构与性质 学案(浙江专用)
展开第2讲 分子结构与性质
【考纲点击】
1.化学键与分子结构:(1)理解离子键的形成,能根据离子化合物的结构特征解释其物理性质;(2)了解共价键的形成、极性、类型(σ键和π键),了解配位键的含义;(3)能用键能、键长、键角等说明简单分子的某些性质;(4)了解杂化轨道理论及简单的杂化轨道类型(sp、sp2、sp3);(5)能用价层电子对互斥理论或杂化轨道理论推测简单分子或离子的空间结构。2.分子间作用力与物质的性质:(1)了解范德华力的含义及对物质性质的影响;(2)了解氢键的含义,能列举存在氢键的物质,并能解释氢键对物质性质的影响。
一、“两大理论”与微粒构型
1.中心原子杂化类型和分子空间构型的相互判断
分子(A为 中心原子) | 中心原子孤 电子对数 | 中心原子 杂化方式 | 分子构型 | 示例 |
AB2 | 0 | sp | 直线形 | BeCl2 |
1 | sp2 | V形 | SO2 | |
2 | sp3 | V形 | H2O | |
AB3 | 0 | sp2 | 平面三角形 | BF3 |
1 | sp3 | 三角锥形 | NH3 | |
AB4 | 0 | sp3 | 正四面体形 | CH4 |
2.等电子原理
(1)等电子体特征
原子总数相同、价电子总数相同的分子或离子具有相似的化学键特征。物理性质相似,化学性质不同。
(2)常见等电子体
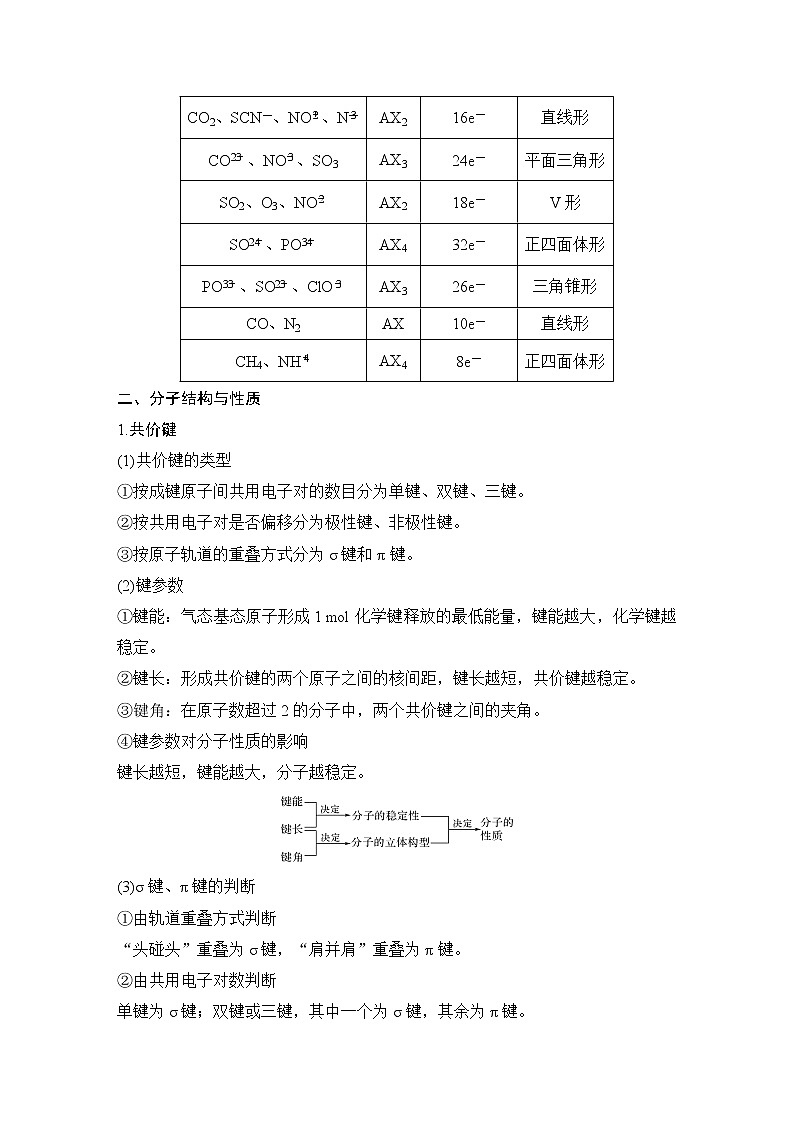
粒子 | 通式 | 价电子总数 | 立体构型 |
CO2、SCN-、NO、N | AX2 | 16e- | 直线形 |
CO、NO、SO3 | AX3 | 24e- | 平面三角形 |
SO2、O3、NO | AX2 | 18e- | V形 |
SO、PO | AX4 | 32e- | 正四面体形 |
PO、SO、ClO | AX3 | 26e- | 三角锥形 |
CO、N2 | AX | 10e- | 直线形 |
CH4、NH | AX4 | 8e- | 正四面体形 |
二、分子结构与性质
1.共价键
(1)共价键的类型
①按成键原子间共用电子对的数目分为单键、双键、三键。
②按共用电子对是否偏移分为极性键、非极性键。
③按原子轨道的重叠方式分为σ键和π键。
(2)键参数
①键能:气态基态原子形成1 mol化学键释放的最低能量,键能越大,化学键越稳定。
②键长:形成共价键的两个原子之间的核间距,键长越短,共价键越稳定。
③键角:在原子数超过2的分子中,两个共价键之间的夹角。
④键参数对分子性质的影响
键长越短,键能越大,分子越稳定。
(3)σ键、π键的判断
①由轨道重叠方式判断
“头碰头”重叠为σ键,“肩并肩”重叠为π键。
②由共用电子对数判断
单键为σ键;双键或三键,其中一个为σ键,其余为π键。
③由成键轨道类型判断
s轨道形成的共价键全部是σ键;杂化轨道形成的共价键全部为σ键。
2.配位键与配合物
(1)配位键
①配位键的形成:成键原子一方提供孤电子对,另一方提供空轨道形成的共价键;
②配位键的表示:常用“―→”来表示配位键,箭头指向接受孤电子对的原子,如NH可表示为,在NH中,虽然有一个N—H键形成的过程与其他3个N—H键形成的过程不同,但是一旦形成之后,4个共价键就完全相同。
(2)配合物
如[Cu(NH3)4]SO4
配位体有孤电子对,如H2O、NH3、CO、F-、Cl-、CN-等。中心原子有空轨道,如Fe3+、Cu2+、Zn2+、Ag+等。
3.分子性质
(1)分子构型与分子极性的关系
(2)溶解性
①“相似相溶”规律:非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂,若存在氢键,则溶剂和溶质之间的氢键作用力越大,溶解性越好。
②“相似相溶”还适用于分子结构的相似性,如乙醇和水互溶,而戊醇在水中的溶解度明显减小。
(3)无机含氧酸分子的酸性
无机含氧酸可写成(HO)mROn,如果成酸元素R相同,则n值越大,R的正电性越高,使R—O—H中O的电子向R偏移,在水分子的作用下越易电离出H+,酸性越强,如HClO<HClO2<HClO3<HClO4。
4.范德华力、氢键、共价键的比较
| 范德华力 | 氢键 | 共价键 |
概念 | 分子间普遍存在的一种相互作用力,但不是化学键 | 已经与电负性很大的原子(N、O、F)形成共价键的氢原子与另一个电负性很大的原子(N、O、F)之间的作用力 | 原子间通过共用电子对形成的化学键 |
存在范围 | 分子或原子(稀有气体)之间 | 氢原子与氟、氮、氧原子(分子内、分子间) | 相邻原子间 |
特征 | 无方向性、无饱和性 | 有方向性、有饱和性 | 有方向性、有饱和性 |
强度比较 | 共价键>氢键>范德华力 | ||
影响强度的因素 | ①随着分子极性和相对分子质量的增大而增大 ②组成和结构相似的物质,相对分子质量越大,范德华力越大 | 对于A—H…B—,A、B的电负性越大,B原子的半径越小,氢键键能越大 | 成键原子半径越小,键长越短,键能越大,共价键越稳定 |
对物质性质的影响 | ①影响物质的熔沸点、溶解度等物理性质 ②组成和结构相似的物质,随相对分子质量的增大,物质的熔沸点升高 | 分子间氢键的存在,使物质的熔沸点升高,在水中的溶解度增大 | ①影响分子的稳定性,共价键键能越大,分子稳定性越强 ②影响原子晶体的熔沸点、硬度 |
角度一 “两大理论”与微粒构型
1.(1)[2019·课标全国Ⅰ,35(2)]乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是________、________。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是____________________________
______________________________________________________,
其中与乙二胺形成的化合物稳定性相对较高的是________(填“Mg2+”或“Cu2+”)。
(2)[2019·课标全国Ⅱ,35(1)]元素As与N同族。预测As的氢化物分子的立体结构为________,其沸点比NH3的________(填“高”或“低”),其判断理由是______________________________________________________
______________________________________________________。
答案 (1)sp3 sp3 乙二胺的两个N提供孤对电子给金属离子形成配位键 Cu2+
(2)三角锥形 低 NH3分子间存在氢键
2.[2018·全国Ⅰ,35(3)]LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是________、中心原子的杂化形式为________。LiAlH4中存在________(填标号)。
A.离子键 B.σ键
C.π键 D.氢键
答案 正四面体 sp3 AB
3.[2018·全国Ⅱ,35(2)(4)](1)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是________________。
(2)气态三氧化硫以单分子形式存在,其分子的立体构型为________形,其中共价键的类型有________种;固体三氧化硫中存在如图所示的三聚分子,该分子中S原子的杂化轨道类型为________。
解析 (1)价层电子对数包括成键电子对数和孤电子对数,H2S中S的成键电子对数为2,孤电子对数为=2,故价层电子对数为4(或价层电子对数为=4),同理,SO2中S的价层电子对数为=3,SO3中S的价层电子对数为=3,H2S中S的价层电子对数不同于SO2、SO3。
(2)气态SO3为单分子,分子中S无孤电子对,其分子的立体构型为平面三角形,S和O之间形成双键,故共价键有σ键和π键两种。固态SO3为三聚分子,分子中每个S与4个O成键,S无孤电子对,故原子的杂化轨道类型为sp3。
答案 (1)H2S (2)平面三角 2 sp3杂化
4.[2018·全国Ⅲ,35(4)]《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为________,C原子的杂化形式为________。
解析 CO中碳原子的价层电子对数为3,中心碳原子采取sp2杂化,故CO的空间构型为平面三角形。
答案 平面三角形 sp2杂化
5.[2018·江苏化学,21(1)(3)(4)](1)SO中心原子轨道的杂化类型为________;NO的空间构型为________(用文字描述)。
(2)与O3分子互为等电子体的一种阴离子为________(填化学式)。
(3)N2分子中σ键与π键的数目比n(σ)∶n(π)=________。
解析 (1)SO中S原子的价层电子对数为4,所以采取sp3杂化。NO中氮原子上无孤对电子,成键电子对数为3,即N采取sp2杂化,NO的空间构型为平面正三角形。(2)等电子体是指价电子总数和原子数均相同的分子、离子或原子团,O3与NO均为3原子18价电子的粒子,故二者互为等电子体。(3)N2分子中含有1个σ键和2个π键。
答案 (1)sp3 平面(正)三角形 (2)NO (3)1∶2
6.(1)[2017·课标全国Ⅰ,35(3)]X射线衍射测定等发现,I3AsF6中存在I离子。I离子的几何构型为________,中心原子的杂化形式为________。
(2)[2017·课标全国Ⅲ,35(2)]CO2和CH3OH分子中C原子的杂化形式分别为________和________。
(3)[2016·全国卷Ⅰ,37(5)节选]Ge单晶具有金刚石结构,其中Ge原子的杂化方式为________。
(4)[2016·全国卷Ⅲ,37(3)]AsCl3分子的立体构型为________,其中As的杂化轨道类型为________。
答案 (1)V形 sp3 (2)sp sp3 (3)sp3 (4)三角锥形 sp3
角度二 微粒作用与分子性质
7.(1)[2019·课标全国Ⅲ,35(2)(3)]①FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为________,其中Fe的配位数为________。
②苯胺()的晶体类型是________。苯胺与甲苯()的相对分子质量相近,但苯胺的熔点(-5.9 ℃)、沸点(184.4 ℃)分别高于甲苯的熔点(-95.0 ℃)、沸点(110.6 ℃),原因是_______________________________
______________________________________________________。
(2)[2018·课标全国Ⅱ,35(3)]如图为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为________________________________
______________________________________________________。
(3)[2018·全国卷Ⅲ,35(3)]ZnF2具有较高的熔点(872 ℃),其化学键类型是________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是______________________________________________________。
(4)[Fe(H2O)6]2+与NO反应生成的[Fe(NO)(H2O)5]2+中,NO以N原子与Fe2+形成配位键。请在[Fe(NO)(H2O)5]2+结构示意图的相应位置补填缺少的配体。
[Fe(NO)(H2O)5]2+结构示意图
(5)[2017·课标全国Ⅲ,35(4)]硝酸锰是制备CO2+3H2=== CH3OH+H2O反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在________。
(6)[2017·课标全国Ⅲ,35(3)]研究发现,在CO2低压合成甲醇反应(CO2+3H2―→CH3OH+H2O)所涉及的4种物质中,沸点从高到低的顺序为______________________________________________________,
原因是______________________________________________________。
答案 (1)① 4 ②分子晶体 苯胺分子之间存在氢键
(2)S8相对分子质量大,分子间作用力强
(3)离子键 ZnF2为离子化合物,ZnCl2、ZnBr2、ZnI2的化学键以共价键为主、极性较小
(4)
(5)离子键、π键
(6)H2O>CH3OH>CO2>H2 水含氢键比甲醇中多;CO2与H2均为非极性分子,CO2相对分子质量较大,范德华力大
8.[2017·课标全国Ⅱ,35(3)]经X射线衍射测得化合物R的晶体结构,其局部结构如图所示。
(1)从结构角度分析,R中两种阳离子的相同之处为________,不同之处为________。(填标号)
A.中心原子的杂化轨道类型
B.中心原子的价层电子对数
C.立体结构
D.共价键类型
(2)R中阴离子N中的σ键总数为________个。分子中的大π键可用符号Π表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π),则N中的大π键应表示为____________。
(3)图中虚线代表氢键,其表示式为(NH)N—H…Cl、________、________。
答案 (1)ABD C (2)5 Π (3)(H3O+)O—H…N(N) (NH)N—H…N(N)
9.[2016·课标全国Ⅰ,37(2)(3)]锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因是____________________。
(2)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因______________________________________________________。
| GeCl4 | GeBr4 | GeI4 |
熔点/℃ | -49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
答案 (1)锗的原子半径大,原子之间形成的σ单键较长,p-p轨道肩并肩重叠的程度很小或几乎不能重叠,难以形成π键
(2)GeCl4、GeBr4、GeI4的熔、沸点依次增高。原因是分子结构相似,相对分子质量依次增大,分子间作用力逐渐增强
10.[2016·课标全国Ⅱ,37(2)]硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是________。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为________,提供孤电子对的成键原子是________。
③氨的沸点________(填“高于”或“低于”)膦(PH3),原因是________;氨是________分子(填“极性”或“非极性”),中心原子的轨道杂化类型为________。
答案 ①正四面体 ②配位键 N
③高于 NH3分子间可形成氢键 极性 sp3
1.(1)“分子机器设计和合成”的研究对象之一为“分子开关”,“分子开关”与大环主体分子苯芳烃、杯芳烃等有关。
①上图为对叔丁基杯[4]芳烃,由4个羟基构成杯底,羟基间的相互作用力是________。对叔丁基杯[4]芳烃中碳原子的杂化方式有________。
②杯芳烃可用于某些ⅢB族元素金属离子如57La3+及21Sc2+的萃取,基态Sc2+核外电子排布式为________。
(2)SO2与SO3的键角相比,键角更大的是________,将纯液态SO3冷却到289.8 K时凝固得到一种螺旋状单链结构的固体,其结构如图,此固态SO3中S原子的杂化轨道类型是________。该结构中S—O键键长有两类,一类键长约140 pm,另一类键长约为160 pm,较短的键为________(填图中字母)。
解析 (1)①O的非金属性很强,在羟基之间存在氢键;对叔丁基杯[4]芳烃中含有苯环和饱和烃基,故碳原子的杂化方式有sp2和sp3;②Sc是21号元素,Sc原子核外有21个电子,失去2个电子变成Sc2+,根据构造原理可知Sc2+核外电子排布式为1s22s22p63s23p63d1或[Ar]3d1。
(2)SO2中S原子采取sp2杂化,含有一对孤对电子,分子构型为V形,SO3中S原子采取sp2杂化,无孤对电子,分子构型为平面三角形,孤对电子与成键电子对间的排斥作用大于成键电子对间的排斥作用,故SO3的键角大于SO2;由图可知,该固态SO3中S原子形成4个σ键,无孤对电子,采取sp3杂化,a为氧硫双键,键能较大,键长较短,另一类为配位键,为单键,键能较小,键长较长,即较短的键为a
答案 (1)①氢键 sp2、sp3
②1s22s22p63s23p63d1或[Ar]3d1
(2)SO3 sp3 a
2.(1)BF3与一定量的水形成晶体Q[(H2O)2·BF3],Q在一定条件下可转化为R:
晶体Q中各种微粒间的作用力不涉及________(填序号)。
a.离子键 b.共价键
c.配位键 d.金属键
e.氢键 f.范德华力
(2)已知苯酚()具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)__________ ___________________________Ka(苯酚)(填“>”或“<”),其原因是__________________________________________________。
答案 (1)ad
(2)< 中形成分子内氢键,使其更难电离出H+
3.碳、硫和钒的相关化合物,在药物化学及催化化学等领域应用广泛。回答下列问题:
(1)基态钒原子原子的结构示意图为______________________________。
(2)VO中V原子的孤电子对数为________,一个VO中含有________个σ键。
(3)2-巯基烟酸氧钒配合物(图1)是副作用很小的有效调节血糖的新型药物:
①该药物中N原子的杂化方式是________。
②X、Y、W三种物质在水中的溶解性由大到小的顺序为________,原因是______________________________________________________
______________________________________________________。
已知:多原子分子中,若原子都在同一平面上且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”(或大π键)。大π键可用Π表示,其中m、n分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为Π。
③下列微粒中存在“离域π键”的是________。
A.O3 B.SO C.H2S D.NO
④CS2分子中大π键可以表示为________。
(4)偏钒酸铵加热分解生成五氧化二钒、氨气、水。偏钒酸铵的阴离子呈图所示的无限链状结构,则偏钒酸铵的化学式为________。
解析 (1)钒为23号元素,钒的原子结构示意图为。
(2)VO中V原子的孤电子对数==0,一个VO中含有4个σ键。
(3)①该药物中N原子形成2个σ键,1个π键,N原子的价层电子对数=孤电子对数+σ键电子对数=1+2=3,所以N原子采取sp2杂化。
③从题目表述来看,形成离域π键的条件是:原子都在同一平面上且这些原子有相互平行的p轨道。根据价层电子对互斥理论,O3为平面三角形,SO为正四面体,H2S为V形,NO为平面三角形,因此SO中一定不存在离域π键;H2S中H原子没有p轨道,也不存在离域π键;O3和NO中原子均在同一平面且都有p轨道,可以形成离域π键。
④CS2中原子均在同一平面且都有p轨道,因此可以形成三中心四电子的离域π键Π。
(4)由链状结构可知偏钒酸铵阴离子中V与O的原子个数比为1∶3,且V元素的化合价为+5,O元素化合价为-2,则阴离子为VO,故偏钒酸铵的化学式为NH4VO3。
答案 (1)
(2)0 4 (3)①sp2 ②X>W>Y X中含有羧基,可以与水分子形成氢键,增强水溶性;Y中含有酯基和苯环,W中含有酯基,都不利于在水中的溶解 ③AD ④Π
(4)NH4VO3








