

2020届二轮复习 非金属及其化合物(一) 学案(全国通用)
展开专题十四 非金属及其化合物(一)
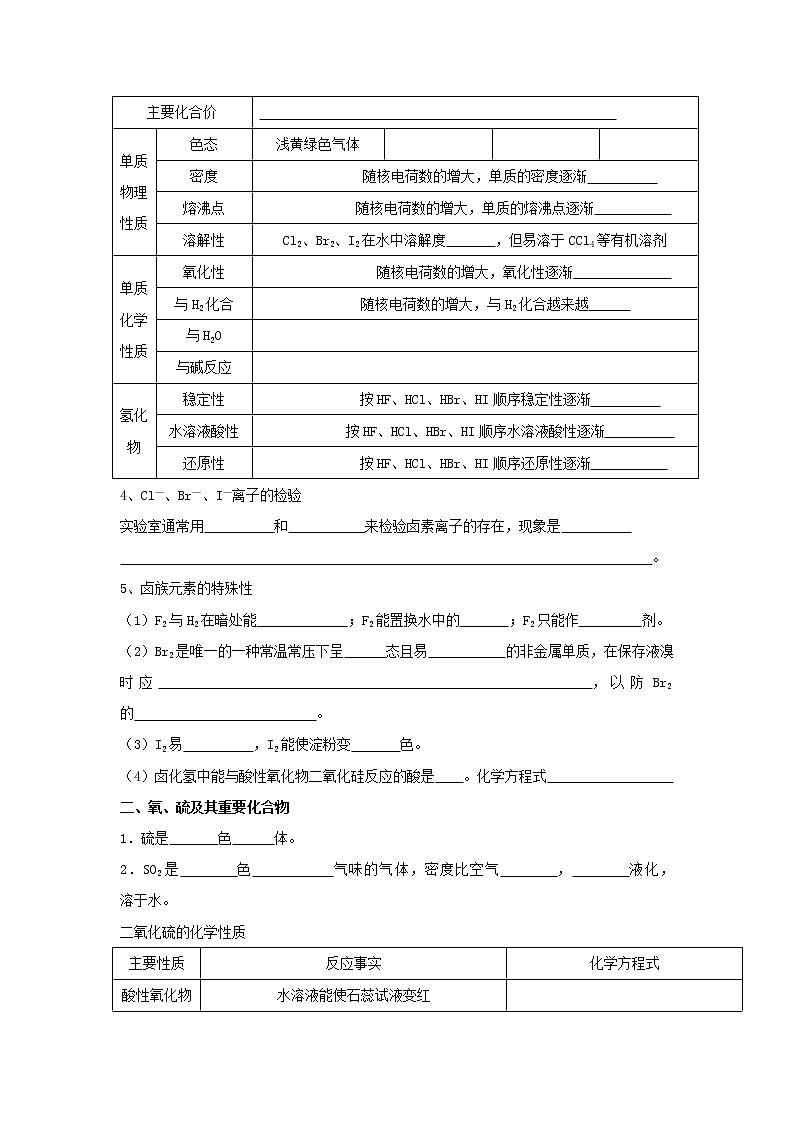
一、氯及其化合物 卤族元素
1.熟练写出这些方程式
(1)与单质的化合反应
2Fe+3Cl22FeCl3 Cu + Cl2 CuCl2 H2+Cl22HCl(安静燃烧,发苍白色火焰)
(2)与水反应: H2O+Cl2HCl+HClO
(3)与碱反应: 实验室吸收多余氯气 2NaOH+Cl2=NaCl+NaClO+H2O
工业制取漂白粉2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O
若加热, Cl2+ NaOH → NaCl+ NaClO3 + H2O
(4)与还原性物质反应
NaBr + Cl2 —— KI + Cl2 ——
FeCl2 + Cl2 —— SO2 + Cl2 + H2O——
H2S + Cl2 ——
(5)与有机化合物的反应
CH4 + Cl2 CH2=CH2 + Cl2 ——
2. 液氯、新制氯水和久置氯水的比较
物质 | 液氯 | 新制氯水 | 久置氯水 |
所属类别 | 单质 | 混合物 | 混合物 |
颜色 | 黄绿色 | 浅黄绿色 | 无色 |
组成粒子 | Cl2 |
| H+、Cl-、H2O |
主要性质 |
|
|
|
3. 卤族元素及其单质、氢化物的结构、性质比较
元素名称 | 氟 | 氯 | 溴 | 碘 | |||||
元素符号 |
|
|
|
| |||||
周期表中位置 | 周期 |
|
|
|
| ||||
族 |
| ||||||||
原子结构 | 相同点 | 原子最外层都是 个电子,半径是同周期中 | |||||||
不同点 | 随着核电荷数的增大,电子层数逐渐 ,半径逐渐 | ||||||||
主要化合价 |
| ||||||||
单质物理性质 | 色态 | 浅黄绿色气体 |
|
|
| ||||
密度 | 随核电荷数的增大,单质的密度逐渐 | ||||||||
熔沸点 | 随核电荷数的增大,单质的熔沸点逐渐 | ||||||||
溶解性 | Cl2、Br2、I2在水中溶解度 ,但易溶于CCl4等有机溶剂 | ||||||||
单质化学性质 | 氧化性 | 随核电荷数的增大,氧化性逐渐 | |||||||
与H2化合 | 随核电荷数的增大,与H2化合越来越 | ||||||||
与H2O |
| ||||||||
与碱反应 |
| ||||||||
氢化物 | 稳定性 | 按HF、HCl、HBr、HI顺序稳定性逐渐 | |||||||
水溶液酸性 | 按HF、HCl、HBr、HI顺序水溶液酸性逐渐 | ||||||||
还原性 | 按HF、HCl、HBr、HI顺序还原性逐渐 | ||||||||
4、Cl—、Br—、I—离子的检验
实验室通常用 和 来检验卤素离子的存在,现象是
。
5、卤族元素的特殊性
(1)F2与H2在暗处能 ;F2能置换水中的 ;F2只能作 剂。
(2)Br2是唯一的一种常温常压下呈 态且易 的非金属单质,在保存液溴时应 ,以防Br2的 。
(3)I2易 ,I2能使淀粉变 色。
(4)卤化氢中能与酸性氧化物二氧化硅反应的酸是 。化学方程式
二、氧、硫及其重要化合物
1.硫是 色 体。
2.SO2是 色 气味的气体,密度比空气 , 液化, 溶于水。
二氧化硫的化学性质
主要性质 | 反应事实 | 化学方程式 |
酸性氧化物的通性 | 水溶液能使石蕊试液变红 |
|
工业上常用氨水来吸收二氧化硫 |
| |
能使Ba(OH)2溶液变浑浊 |
| |
能与CaO发生化合反应 |
| |
能与饱和NaHCO3溶液作用 |
| |
还原性 | 工业用接触氧化法制SO3 |
|
使氯水的黄绿色褪去 |
| |
氧化性 | 与H2S混合有黄色固体析出 | SO2+2H2S=3S↓+2H2O |
漂白性 | 能使品红溶液 ,加热后 。原因: | |
3.SO3是酸性氧化物。写出反应方程式:
SO3与H2O (工业制 );
SO3与NaOH ;SO3与CaO 。
4. 硫酸的化学性质
思考:如何稀释浓硫酸? 浓硫酸不能用来干燥哪些气体?为什么?并请举例说明。
回忆“黑面包”实验,描述实验步骤、现象及原因,浓硫酸表现的性质?
浓硫酸在有机反应中还有哪些应用?请举例说明。
5.常见的硫酸盐的化学式 胆矾(又叫蓝矾) 绿矾
明矾 (常用于 )
6.SO42—的检验:操作顺序?现象?
【智能训练】
1.下列现象或事实可用同一原理解释的是( )
A、浓硫酸和浓盐酸长期暴露在空气中浓度降低 B、氯水和活性炭使红墨水褪色
C、漂白粉和水玻璃长期暴露在空气中变质 D、乙炔和乙烯使溴的四氯化碳溶液褪色
2.市售“家用消毒液发生器”是以精盐和自来水为原料。通电时,发生器内的电极板上产生大量气泡(同时使产生的气体充分与电解液接触),所制得的混合液具有强烈的杀菌能力,且不致对人体造成伤害。该发生器配制消毒液所涉及到的化学反应有( )
①2NaCl+2H2O 2NaOH+H2↑+Cl2↑ ②Cl2+2NaOH═NaCl+NaClO+H2O
③H2+Cl2═2HCl ④Cl2+H2O═HCl+HClO ⑤2HClO═2HCl+O2
A.①④⑤ B.①② C.③④⑤ D.②③④
3.下列说法正确的是( )
A.非金属元素R所形成的含氧酸盐(MaROb)中的R元素必定呈现正价
B.只有非金属能形成含氧酸或含氧酸盐
C.除稀有气体外的非金属元素都能生成不同价态的含氧酸
D.非金属的最高价含氧酸都具有强氧化性
4.氯气是一种重要的工业原料。工业上利用反应在3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法正确的是( )
A 若管道漏气遇氨就会产生白烟 B 该反应利用了Cl2的强还原性
C 该反应中NH3被还原 D 生成1molN2有3mol电子转移
5.下列推断合理的是( )
A.明矾[KAl(SO4)2·12H2O]在水中能形成Al(OH)3胶体,可用作净水剂
B.金刚石是自然界中硬度最大的物质,不可能与氧气发生反应
C.浓H2SO4有强氧化性,不能与Cu发生剧烈反应
D.将SO2通入品红溶液,褪色后加热恢复原色;将SO2通入溴水,褪色后加热也能恢复原色
6.对下列实验事实的解释正确的是( )
| 现象 | 解释 |
A | KI淀粉溶液中通入Cl2,溶液变蓝 | Cl2能与淀粉发生显色反应 |
B | 浓HNO3在光照条件下变黄 | 浓HNO3不稳定,生成有色产物能溶于浓硝酸 |
C | 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 说明该溶液中含有SO42- |
D | 铜片放入浓硫酸中,无明显变化 | 说明铜在冷的浓硫酸中发生钝化 |
7.下列各组气体中,在通常情况下既能用浓硫酸又能用碱石灰干燥的有( )
A.SO2、O2、N2 B.HCl、Cl2、CO2 C.CH4、H2、CO D.SO2、Cl2、O2
8.下列离子方程式书写不正确的是( )
A.氯水和碘化钾反应:Cl2+2I-=2Cl-+I2
B.二氧化锰和浓盐酸制氯气:MnO2+4H++2Cl-Mn2++Cl2↑+2H2O
C.氢氧化钙溶液吸收氯气:Cl2+2OH-=Cl-+ClO-+H2O
D.氯气和水反应:Cl2+H2O=2H++Cl-+ClO-
9.能实现下列物质间直接转化的元素是( )
A.硅 B.硫 C.铜 D.铁
10.下列关于氯的说法正确的是( )
A.Cl2具有很强的氧化性,在化学反应中只能作氧化剂
B.若35 17Cl、37 17若Cl为不同的核素,有不同的化学性质
C.实验室制备Cl2,可用排饱和食盐水集气法收集
D.1.12LCl2含有1.7NA个质子(NA 表示阿伏伽德罗常数)
11.对某酸性溶液(可能含有Br-、SO42-、H2SO3、NH4+等微粒)。分别进行如下实验:①加热时放出的气体可使品红溶液褪色②加碱调pH至碱性后,加热时放出的气体可使润湿的红色石蕊试纸变蓝③加入氯水时,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀NHO3。对于上述微粒不能确认其在原溶液中是否存在的是( )
A.Br- B.SO42- C.H2SO3 D.NH4+
12.某校同学为探究Br2、I2和Fe3+的氧化性强弱,进行了如下实验。
①取少量KI溶液于试管中,先加入溴水,振荡,再加入CCl4, 振荡后静置,观察到下层液体呈紫红色;②取少量FeSO4溶液于试管中,先加入溴水,振荡,再继续滴加两滴KSCN溶液,振荡,观察到溶液呈血红色。
(1)写出实验②中发生的离子方程式______________ ______ ;
(2)由上述两个实验,对物质的氧化性可以得出的正确结论是(填序号)_______;
A.Br2>I2 B.Fe3+>Br2 C.Br2>Fe3+ D.I->Br-
(3)已知Fe3+的氧化性强于I2,请你从所给试剂中选择所需试剂,设计一个实验证明。
①FeCl3溶液 ②碘水 ③KI溶液 ④稀H2SO4 ⑤淀粉液
实验操作和现象:
实验结论:
13. 有关物质存在如图所示的转化关系(部分产物已省略)。
通常C为气体单质,G为紫黑色固体单质。实验室中,
可用固体E在B的催化下加热制取气体单质H。请
回答下列问题:
(1)反应①的化学方程式为
(2)反应②的离子方程式为
(3)写出另外一种实验室制取H的化学方程式
(4)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的Ksp=7.0×10—9。将等体积的D溶液与Pb(NO3)2溶液混合,若D的浓度为1×10—2mo1/L ,则生成沉淀所需Pb(NO3)2溶液的最小浓度为 。
参考答案
一、1.⑶3 6 5 1 3
⑷2NaBr + Cl2 = 2NaCl+Br2 2KI + Cl2 =2KCl+I2 2FeCl2 + Cl2=2FeCl3
SO2 + Cl2 + 2H2O=H2SO4+2HCl H2S + Cl2 =2HCl+S
⑸CH3Cl+HCl CH2Cl—CH2Cl
2.H2O、Cl2、HClO、H+、Cl-、ClO-、OH-
强氧化性; 强氧化性、酸性; 酸性
3.F、Cl、Br、I; 二、三、四、五; ⅦA; 7,最小; 增多,增大
—1、0、+1、+3、+5、+7; 黄绿色气体,深红棕色液体,紫黑色固体;
增大;升高;不大;减弱;难;
2F2+2H2O=4HF+O2 X2+H2O=HX+HXO(X=Cl、Br、I)
X2+2OH- =X— + XO— + H2O;减弱;增强;增强
4.AgNO3溶液,稀硝酸;生成不溶于稀硝酸的白色沉淀(Cl—)、浅黄色沉淀(Br—)、
黄色沉淀(I—)。
5.⑴剧烈化合;氧;氧化 ⑵液;挥发;保存在棕色细口瓶中并加水水封;挥发
⑶升华;蓝 ⑷HF SiO2+4HF=SiF4↑+2H2O
二、1.黄;晶 2.无;有刺激性;大;易;易
SO2+H2OH2SO3H++HSO3—;2NH3·H2O+SO2=(NH4)2SO3 +H2O;
Ba(OH)2+SO2=BaSO3↓+H2O; CaO+SO2=CaSO3;
2NaHCO3+SO2=Na2SO3+H2O+2CO2↑;2SO2+O2 2SO3
SO2+Cl2+2H2O=H2SO4+2HCl;
褪色; 恢复原色;SO2与有色物质化合生成不稳定的无色物质,受热又分解为原来
的有色物质。
3.SO3+H2O=H2SO4;H2SO4;SO3+2NaOH=Na2SO4+H2O;SO3+CaO=CaSO4
4.思考①:将浓硫酸沿器壁缓缓注入水中,并用玻璃棒不断搅拌,使产生的热量迅速散失。
②碱性、还原性气体;浓硫酸有酸性和强氧化性。
③(必修一P101)蔗糖变黑,体积膨胀,变成疏松多孔的海绵状的炭,并放出有刺激
性气味的气体。浓硫酸表现了强氧化性和脱水性。
④实验室制取乙烯,催化剂、脱水剂;制取乙酸乙酯,催化剂、吸水剂
5. CuSO4·5H2O FeSO4·7H2O KAl(SO4)2·12H2O
6.先加入足量的稀盐酸,再加入BaCl2溶液,产生白色沉淀。
【智能训练】
1.D 2.B 3.A 4.A 5.A 6.B 7.C 8.D 9.B 10.C 11.B
12. (1)2Fe++Br2 = 2Fe3+ +2Br- Fe3++3SCN—=Fe(SCN)3 (2)A、C
(3)取少量FeCl3溶液于试管中,依次加入KI溶液和淀粉液,振荡,淀粉液变蓝,
证明Fe3+氧化性强于I2。
13. (1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
(2)6I-+ClO3-+6H+=3I2+Cl-+3H2O
(3)2H2O22H2O+O2↑或2KMnO4K2MnO4+MnO2+O2↑(4)5.6×10-4mol·L-1








