

2019届二轮复习 原电池的电极方程式 作业(全国通用) 练习
展开原电池的电极方程式
1.实验发现,298K时,在FeCl3酸性溶液中加少量锌粒后,Fe3立即被还原成Fe2。某夏令营兴趣小组根据该实验事实设计了如图所示原电池装置。下列有关说法正确的是( )
A.该原电池的正极反应是Zn-2e-===Zn2
B.左烧杯中溶液的红色逐渐褪去
C.该电池铂电极上有气泡出现
D.该电池总反应为3Zn+ 2Fe3===2Fe+ 3Zn2
【解析】该电池的总反应为Zn+ 2Fe3 ===2Fe2+ Zn2,所以左烧杯Pt为正极,电极反应为Fe3+ e-===Fe2,右烧杯Zn为负极,电极反应为Zn-2e-===Zn2。由于左烧杯中的Fe3被还原为Fe2,所以左烧杯中溶液的红色逐渐褪去。
【答案】B
2.一种三室微生物燃料电池污水净化系统原理如下图所示,图中有机废水中有机物可用C6H10O5表示。下列有关说法正确的是( )
A.b电极为该电池的负极
B.b电极附近溶液的pH减小
C.a电极反应式:C6H10O5-24e-+ 7H2O===6CO2↑+ 24H+
D.中间室:Na+ 移向左室,Cl-移向右室
【解析】b电极上硝酸根离子得电子生成N2,发生还原反应,故b电极应为正极,A错误;b电极反应式:2NO+ 10e-+ 6H2O===N2↑+ 12OH-,故b电极附近溶液的pH增大,B错误;原电池工作时阳离子向正极移动,阴离子向负极移动,D错误。
【答案】C
3.一个完整的氧化还原反应方程式可以拆开,写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2Fe3+ Cu===2Fe2+ Cu2,可拆写为氧化反应式:Cu-2e-===Cu2,还原反应式:2Fe3+2e-===2Fe2。据此,回答下列问题:
(1)将反应3Cu+ 8H+2NO===3Cu2+ 2NO↑+ 4H2O拆写为两个“半反应式”,还原反应式:________
____________________________________。
(2)此原理可用于电化学。锌锰碱性电池广泛应用于日常生活,电池的总反应式为Zn(s)+ 2MnO2(s)+ 2H2O(l)===Zn(OH)2(s)+ 2MnOOH(s)。该电池的正极反应式为___________________________________。
【解析】(1)反应3Cu+ 8H+ 2NO===3Cu2+ 2NO↑+ 4H2O,其中Cu元素的化合价升高,被氧化,N元素的化合价降低,被还原,还原反应式为8H+ 2NO+ 6e-===2NO↑+ 4H2O;(2)电池的总反应式为Zn(s)+ 2MnO2(s)+ 2H2O(l) ===Zn(OH)2(s)+ 2MnOOH(s),其中锰元素的化合价降低,发生还原反应,该电池的正极反应式为2MnO2+ 2H2O+ 2e-===2MnOOH+ 2OH-
【答案】(1)8H+ 2NO+ 6e-===2NO↑+ 4H2O
(2)2MnO2+ 2H2O+ 2e-===2MnOOH+ 2OH-
1.某原电池装置如图所示。下列有关叙述中正确的是( )
(盐桥中装有含琼胶的KCl饱和溶液)
A.Fe作正极,发生氧化反应
B.负极反应:2H+ 2e-===H2↑
C.工作一段时间后,两烧杯中溶液pH均不变
D.工作一段时间后,NaCl溶液中c(Cl-)增大
【解析】此原电池的负极是铁,发生氧化反应,正极是石墨,H在此发生还原反应,右池中氢离子在石墨棒上被还原为H2不断逸出,使溶液酸性减弱,所以溶液的pH有变化。
【答案】D
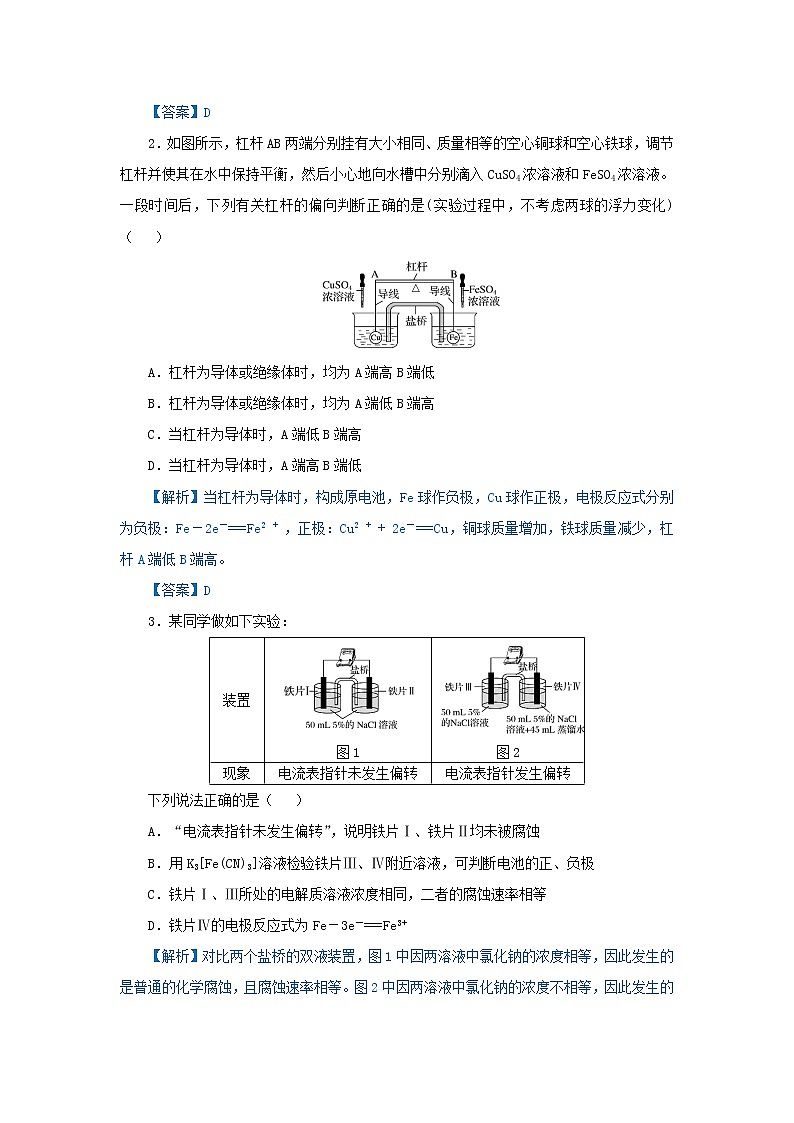
2.如图所示,杠杆AB两端分别挂有大小相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中分别滴入CuSO4浓溶液和FeSO4浓溶液。一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑两球的浮力变化)( )
A.杠杆为导体或绝缘体时,均为A端高B端低
B.杠杆为导体或绝缘体时,均为A端低B端高
C.当杠杆为导体时,A端低B端高
D.当杠杆为导体时,A端高B端低
【解析】当杠杆为导体时,构成原电池,Fe球作负极,Cu球作正极,电极反应式分别为负极:Fe-2e===Fe2,正极:Cu2+ 2e-===Cu,铜球质量增加,铁球质量减少,杠杆A端低B端高。
【答案】D
3.某同学做如下实验:
装置 | 图1 | 图2 |
现象 | 电流表指针未发生偏转 | 电流表指针发生偏转 |
下列说法正确的是( )
A.“电流表指针未发生偏转”,说明铁片Ⅰ、铁片Ⅱ均未被腐蚀
B.用K3[Fe(CN)3]溶液检验铁片Ⅲ、Ⅳ附近溶液,可判断电池的正、负极
C.铁片Ⅰ、Ⅲ所处的电解质溶液浓度相同,二者的腐蚀速率相等
D.铁片Ⅳ的电极反应式为Fe-3e-===Fe3+
【解析】对比两个盐桥的双液装置,图1中因两溶液中氯化钠的浓度相等,因此发生的是普通的化学腐蚀,且腐蚀速率相等。图2中因两溶液中氯化钠的浓度不相等,因此发生的是电化学腐蚀,且浓度大的一极是负极,发生的反应是Fe-2e-===Fe2+ ,可以用K3[Fe(CN)3]检验Fe2+ 的存在,若产生蓝色沉淀,就证明含有Fe2+ ,B正确。
【答案】B
4.利用人工光合作用合成甲酸的原理为2CO2+ 2H2O2HCOOH+ O2,装置如下图所示。下列说法不正确的是( )
A.该装置将太阳能转化为化学能和电能
B.电极1周围pH增大
C.电极2上发生的反应为CO2+2H+ +2e-===HCOOH
D.H+ 由电极1室经过质子膜流向电极2室
【解析】在太阳能作用下CO2和H2O转化为HCOOH和O2,并且有电子流动,太阳能转化为化学能和电能,A正确;电极1流出电子,反应式是2H2O-4e-===4H+ +O2↑,周围pH减小,B错误;根据总反应方程式推出电极2上发生的反应为CO2+2H+ +2e-===HCOOH,C正确;电极1反应产生H+ ,电极2反应消耗H+ ,故H+ 由电极1室经过质子膜进入电极2室,D正确。
【答案】B
5.我国科学家研发出一种新型的锂离子电池,放电时有关离子转化关系如下图所示,下列说法正确的是( )
A.Li+ 透过膜除允许 Li+ 通过外,还允许H2O分子通过
B.放电时,进入贮罐的液体发生反应:S2O+ 2Fe2+ ===2Fe3+ + 2SO
C.充电时,钛电极与外电源的负极相连
D.充电时,电池内部发生的总反应为 Li+ Fe3+ === Li+ + Fe2+
【解析】Li+ 透过膜只允许Li+ 通过,故A错误;钛电极是电池的正极,充电时,应该与外电源的正极相连,故C错误;放电时电池总反应为Li+ Fe3+ ===Li+ +Fe2+ ,则充电时发生的总反应为Li+ +Fe2+ Li+Fe3+ ,故D错误。
【答案】B
6.一种以NaBH4和H2O2为原料的新型电池的工作原理如图所示。下列说法错误的是( )
A.电池的正极反应为H2O2+ 2e-===2OH-
B.电池放电时Na+ 从a极区移向b极区
C.电子从电极b经外电路流向电极a
D.b极室的输出液经处理后可输入a极室循环利用
【解析】由图分析可知,通入a电极的为BH,其中的B失电子,化合价升高,生成BO,因此a为电池的负极。b为电池的正极,H2O2中O由−1价降到-2价发生还原反应,反应式为H2O2+ 2e===2OH,A正确;原电池工作时,电解质溶液中的阳离子由负极区向正极区移动,B正确;电子由负极流出,正极流入,即a→b,C错误;正极区产生的OH-经处理后输入a极室可循环使用,D正确。
【答案】C
7.“直接煤燃料电池”能够将煤中的化学能高效、清洁地转化为电能。用熔融Na2CO3作电解质的直接煤燃料电池的工作原理如下图所示。下列有关说法正确的是( )
A.该电池的总反应为C+ O2===CO2
B.煤直接燃烧发电比直接煤燃料电池发电的能量利用率高
C.进入反应室的煤块粉碎成粉末状对反应速率和限度均无影响
D.电子由电极b沿导线流向电极a,入口A加入的物质为煤粉
【解析】A项,在原电池中阴离子移向电源负极,由图中CO移向左边可知a为负极,电极反应为C+2CO-4e-===3CO2,b为正极,电极反应为O2+ 2CO2+4e-===2CO,所以该电池的总反应为C+O2===CO2,故A正确;B项,煤直接燃烧发电会有部分化学能转变为热能、光能,所以比直接煤燃料电池发电的能量利用率低,故B错误;C项,将煤块粉碎成粉末状,有利于在电极a附近参与反应,加快了反应速率,故C错误;D项,a为负极,电子由负极a沿导线流向正极b,故D错误。
【答案】A
8.液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如下图所示。下列有关叙述正确的是( )
A.该燃料电池放电时,正极发生氧化反应,pH变大
B.a极的反应式:N2H4+ 4OH--4e-===N2↑+ 4H2O
C.放电时,电流从a极经过负载流向b极
D.其中的离子交换膜需选用阳离子交换膜
【解析】根据原电池的工作原理,正极得电子,发生还原反应,通空气的一极为正极,反应式为O2+2H2O+ 4e-===4OH-,pH增大,故A错误;通肼的一极为负极,反应式为N2H4+4OH--4e-===N2↑+4H2O,故B正确;根据原电池的工作原理,电子从负极经外电路流向正极,电流的方向和电子移动的方向相反,即电流从b极经过负载流向a极,故C错误;根据电极反应式,OH-应从正极流向负极,交换膜应选用阴离子交换膜,故D错误。
【答案】B
9.微生物电池是指在微生物的作用下将化学能转化为电能的装置,下图是利用一种微生物将废水中的尿素[CO(NH2)2]转化为对环境无害物质的装置。下列叙述错误的是( )
A.M电极有CO2和N2生成
B.H+ 透过质子交换膜由左向右移动
C.微生物促进了反应中电子的转移
D.N电极反应式为O2+2H2O+4e-===4OH-
【解析】因为是质子交换膜,因此反应的环境呈酸性,有O2的一边(N)是正极反应区,即O2+ 4H+ + 4e===2H2O。尿素[CO(NH2)2]转化为对环境无害物质,M极反应为CO(NH2)2+ H2O-6e-===CO2↑+ N2↑+ 6H+ ,H+ 应该透过质子交换膜由左向右移动;在微生物的作用下,此装置构成原电池,加速了反应的进行,促进了反应中电子的转移。综上,A、B、C正确,D错误。
【答案】D
10.科学家预言,燃料电池是21世纪获得电能的重要途径。甲醇燃料电池是采用铂或碳化钨作电极催化剂,在硫酸电解质溶液中直接加入纯化后的甲醇,同时向一个电极通入空气。试回答以下问题:
(1)配平电池放电时发生的化学方程式:
CH3OH+____O2―→____CO2+____H2O。
(2)在硫酸电解质溶液中,CH3OH失去电子,此电池的正极发生的反应是___________________,负极发生的反应是_____________。
(3)电解质溶液中的H+ 向________极移动,向外电路释放电子的电极是________极。
【解析】(1)根据得失电子守恒配平反应方程式,注意CH3OH中的H显+1价,O显-2价。(2)电极反应的书写应注意电解质溶液,本题给出的是酸性溶液。(3)由电极反应可知,H+ 在正极被消耗,在负极生成,所以H+ 向正极移动。
【答案】(1)2 3 2 4
(2)3O2+12H+ +12e-===6H2O
2CH3OH+2H2O−12e-===2CO2+12H+
(3)正 负
11.用零价铁(Fe)去除水体中的硝酸盐(NO)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO的反应原理如图所示。
作负极的物质是________。正极的电极反应式是______________。
(2)将足量铁粉投入水体中,经24小时测定NO的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
pH=4.5时,NO的去除率低,其原因是_________________________。
【解析】(1)根据图可知,Fe失电子,使NO还原为NH,故Fe作负极,结合电子守恒、电荷守恒和元素守恒写出正极的电极反应式:NO+8e-+10H+ ===NH+3H2O。(2)pH越大,Fe3+ 越容易水解生成不导电的FeO(OH),阻碍反应进行,所以NO去除率低;pH越小,越容易生成疏松、能导电的Fe3O4,所以NO去除率高。
【答案】(1)Fe NO+8e-+10H+ ===NH+3H2O
(2)pH越大,Fe3+越易水解成FeO(OH),FeO(OH)不导电,阻碍电子转移
12.锂电池应用越来越广泛,大致可分为两类:锂金属电池和锂离子电池。锂空气电池比锂离子电池具有更高的能量密度,因为其正极(以多孔碳为主)很轻,且氧气从环境中获取而不用保存在电池里。其工作原理如图,电池总反应为4Li+O2+2H2O===4LiOH。
请回答下列问题:
(1)该电池的正极反应式是_____________________________________________。
(2)在负极的有机电解液和正极的水性电解液之间,用只能通过锂离子的固体电解质隔开,使用该固
体电解质的优点有___________________________________。
(3)正极使用水性电解液的优点是______________________________。
【解析】(1)O2+2H2O+4e-===4OH-。(2)在负极的有机电解液和空气极的水性电解液之间,用只能通过锂离子的固体电解质隔开,既可防止两种电解液发生混合,又可防止水和氧气与负极的锂金属发生反应。
(3)该电池正极若使用非水性电解液,则生成的是固体氧化锂(Li2O),而使用水性电解液时,生成的氢氧化锂(LiOH)溶于水,这样就不会引起空气极的碳孔堵塞。
【答案】(1)O2+2H2O+4e-===4OH-
(2)既可防止两种电解液混合,又可防止水和氧气等和负极的锂金属发生反应
(3)可防止正极的碳孔堵塞








