
2019高考化学高分突破二轮复习专题二十二物质的检验与鉴别、分离与提纯学案
展开专题二十二 物质的检验与鉴别、分离与提纯
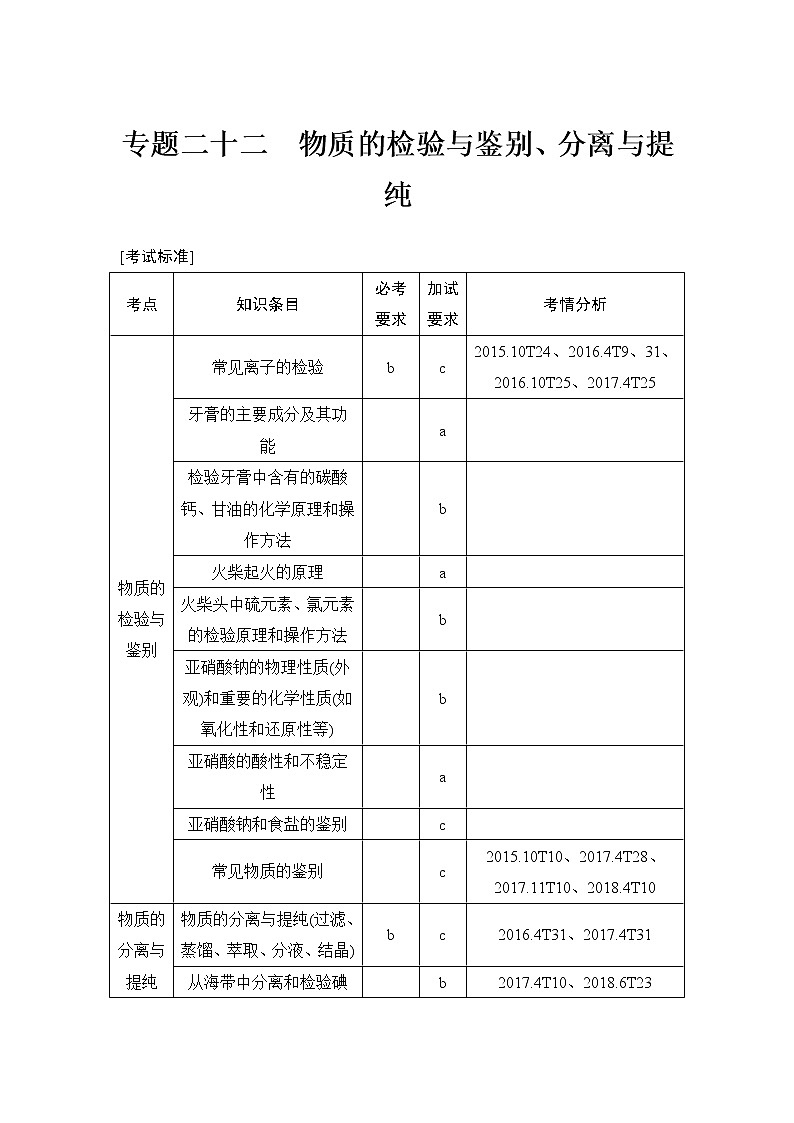
[考试标准]
考点 | 知识条目 | 必考要求 | 加试要求 | 考情分析 |
物质的检验与鉴别 | 常见离子的检验 | b | c | 2015.10T24、2016.4T9、31、2016.10T25、2017.4T25 |
牙膏的主要成分及其功能 |
| a |
| |
检验牙膏中含有的碳酸钙、甘油的化学原理和操作方法 |
| b |
| |
火柴起火的原理 |
| a |
| |
火柴头中硫元素、氯元素的检验原理和操作方法 |
| b |
| |
亚硝酸钠的物理性质(外观)和重要的化学性质(如氧化性和还原性等) |
| b |
| |
亚硝酸的酸性和不稳定性 |
| a |
| |
亚硝酸钠和食盐的鉴别 |
| c |
| |
常见物质的鉴别 |
| c | 2015.10T10、2017.4T28、2017.11T10、2018.4T10 | |
物质的分离与提纯 | 物质的分离与提纯(过滤、蒸馏、萃取、分液、结晶) | b | c | 2016.4T31、2017.4T31 |
从海带中分离和检验碘元素的原理及操作流程 |
| b | 2017.4T10、2018.6T23 | |
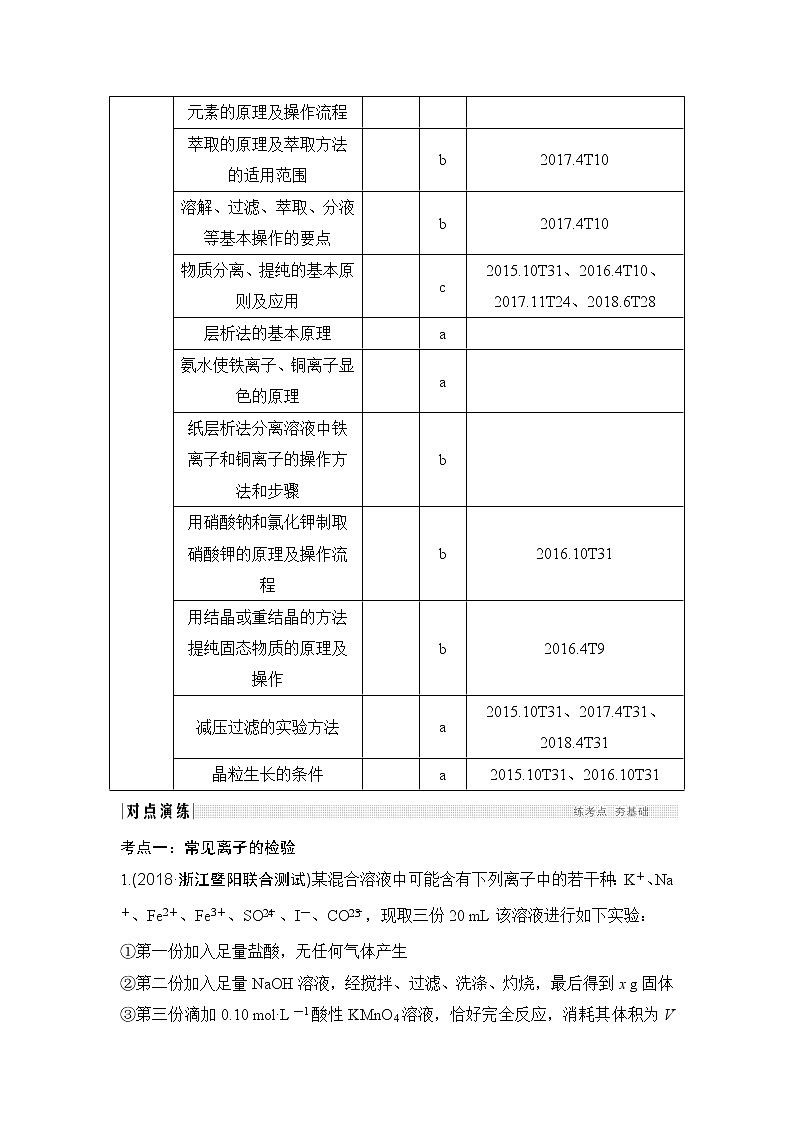
萃取的原理及萃取方法的适用范围 |
| b | 2017.4T10 | |
溶解、过滤、萃取、分液等基本操作的要点 |
| b | 2017.4T10 | |
物质分离、提纯的基本原则及应用 |
| c | 2015.10T31、2016.4T10、2017.11T24、2018.6T28 | |
层析法的基本原理 |
| a |
| |
氨水使铁离子、铜离子显色的原理 |
| a |
| |
纸层析法分离溶液中铁离子和铜离子的操作方法和步骤 |
| b |
| |
用硝酸钠和氯化钾制取硝酸钾的原理及操作流程 |
| b | 2016.10T31 | |
用结晶或重结晶的方法提纯固态物质的原理及操作 |
| b | 2016.4T9 | |
减压过滤的实验方法 |
| a | 2015.10T31、2017.4T31、2018.4T31 | |
晶粒生长的条件 |
| a | 2015.10T31、2016.10T31 |
考点一:常见离子的检验
1.(2018·浙江暨阳联合测试)某混合溶液中可能含有下列离子中的若干种:K+、Na+、Fe2+、Fe3+、SO、I-、CO,现取三份20 mL该溶液进行如下实验:
①第一份加入足量盐酸,无任何气体产生
②第二份加入足量NaOH溶液,经搅拌、过滤、洗涤、灼烧,最后得到x g固体
③第三份滴加0.10 mol·L-1酸性KMnO4溶液,恰好完全反应,消耗其体积为V mL
④另用洁净的铂丝蘸取该混合溶液置于浅色火焰上灼烧,发现火焰呈现黄色
根据上述实验,以下说法正确的是( )
A.由实验②、③可判定原混合溶液中是否存在I-
B.由实验①可推断原混合溶液中是否含有SO
C.由实验③可判定原混合溶液中是否含有Fe2+
D.原混合溶液中只存在Na+、Fe3+、SO,不可能存在K+、CO
解析 ①第一份加入足量盐酸,无任何气体产生,说明溶液中不含CO离子,Fe3+和I-不能同时存在;②第二份加入足量NaOH溶液生成沉淀,说明溶液中含有Fe2+或Fe3+离子,或二者都有,根据最后得到x g固体,为氧化铁,可知总共含有的铁元素的物质的量为×2= mol;③第三份滴加0.10 mol·L-1酸性KMnO4溶液,消耗其体积为V mL,说明溶液中含有还原性离子,含有Fe2+离子或I-中的一种或两种,KMnO4的物质的量为V×10-4mol,根据得失电子守恒,Fe2+离子或I-的物质的量之和为5V×10-4 mol;④另用洁净的铂丝蘸取该混合溶液置于浅色火焰上灼烧,发现火焰呈现黄色,说明含有Na+离子,但不能确定是否含有K+离子,须通过蓝色钴玻璃观察判断。A.碘离子和亚铁离子与高锰酸根反应的比例是相同的,高锰酸根折算成亚铁离子,若折算后亚铁离子的物质的量不大于 mol,即5V×10-4mol≤ mol,说明溶液中含有铁离子,则没有碘离子,若折算后亚铁离子的物质的量大于 mol,即5V×10-4mol> mol,说明溶液中没有铁离子,则含有碘离子,因此由实验②、③可判定原混合溶液中是否存在I-,故A正确;B.根据实验①无法推断原混合溶液中是否含有SO,故B错误;C.根据实验③无法判定原混合溶液中是否含有Fe2+,只能判断含有Fe2+离子或I-中的一种或两种,故C错误;D.根据上述分析,无法判断原混合溶液中是否存在K+,故D错误;故选A。
答案 A
考点二:牙膏成分的检验(加试)
2.(2017·温州瑞安质检)检验某牙膏中不溶于水的成分是否含有Al(OH)3,可采用的方法是( )
A.取滤渣加入稀氨水中,不能溶解
B.取滤渣加入NaOH溶液中,能溶解
C.取滤渣加入稀盐酸中,能溶解
D.将滤渣平分成两等份,分别加入NaOH溶液和稀盐酸中,均能溶解
解析 Al(OH)3具有两性,能与强酸和强碱反应。
答案 D
考点三:火柴头某成分的检验与鉴别(加试)
3.(2018·桐乡一中模拟)火柴头燃烧可产生SO2,下列检验SO2的装置正确的是( )
解析 A.会把KMnO4溶液抽入注射器内;C.会把KMnO4溶液压出试管外;D.无法把火柴燃烧产生的气体抽入试管内。
答案 B
考点四:常见物质的鉴别
4.(2018·山东青岛质检)下列各组物质,不用其他试剂即可鉴别的是( )
A.NaCl、NaBr、KI三种无色溶液
B.HCl、NaCl、NaNO3、Na2CO3四种溶液
C.NaBr、HCl、KCl三种溶液
D.淀粉、淀粉碘化钾、碘化钾、溴水四种溶液
解析 NaCl、NaBr、KI三种无色溶液要用AgNO3溶液鉴别,选项A不符合题意;HCl、NaCl、NaNO3、Na2CO3四种溶液两两混合,有气泡产生的是HCl和Na2CO3两种溶液,剩余的是NaCl和NaNO3两种溶液,需再用AgNO3溶液鉴别,选项B不符合题意;NaBr、HCl、KCl三种溶液需先用Na2CO3溶液鉴别出HCl,再用AgNO3溶液鉴别,选项C不符合题意;淀粉、淀粉碘化钾、碘化钾、溴水四种溶液中溴水有颜色,溴水与碘化钾溶液反应生成碘单质,溶液颜色加深,溴水与淀粉碘化钾溶液反应生成碘单质,碘单质与淀粉反应使溶液呈蓝色,剩余的为淀粉,选项D符合题意。
答案 D
考点五:物质的分离和提纯
5.下列除杂方案错误的是( )
选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
A | C2H5OH | H2O(l) | 新制的生石灰 | 蒸馏 |
B | Cl2 | HCl(g) | 饱和食盐水、浓H2SO4 | 洗气 |
C | NH4Cl溶液 | Fe3+(aq) | NaOH溶液 | 过滤 |
D | 溴苯 | Br2 | NaOH溶液 | 振荡后分液 |
解析 氧化钙与水反应生成氢氧化钙,乙醇易汽化,用蒸馏的方法可除去杂质H2O(l),A方案正确;HCl(g)易溶于水,而Cl2在饱和食盐水中的溶解度较小,B方案正确;氯化铵能与氢氧化钠反应,C方案错误;Br2能与NaOH溶液反应生成易溶于水难溶于溴苯的盐,D方案正确。
答案 C
考点六:利用结晶的方法制备提纯物质
6.实验室以一种工业废渣[含80%~90%的Ca(OH)2,其余为焦炭等不溶物]为原料,制备KClO3的实验过程如下:
几种物质的溶解度如图甲:
(1)反应Ⅰ的目的是制备Ca(ClO3)2,写出该反应的化学方程式:___________________________________________________________
___________________________________________________________;
在通入Cl2和O2比例、废渣量均一定的条件下,为使Cl2转化完全,可采取的合理措施是___________________________________________________________。
(2)若过滤时滤液出现浑浊,其可能的原因是________(填字母)。
A.滤纸已破损
B.漏斗中液面高于滤纸边缘
C.滤纸未紧贴漏斗内壁
(3)所加试剂Y选用KCl而不用KNO3的原因是_______________________
___________________________________________________________。
(4)已知:4KClO33KClO4+KCl;2KClO32KCl+3O2↑。实验室可用KClO3制备高纯KClO4固体,实验中必须使用的用品有:热过滤装置(如图乙所示)、冰水。
①热过滤装置中玻璃漏斗的下端露出热水浴部分不宜过长。其原因是___________________________________________________________。
②请补充完整由KClO3制备高纯KClO4固体的实验方案:向坩埚中加入一定量KClO3,___________________________________________________________,
在低温下干燥得KClO4固体。
解析 (1)废渣的主要成分为Ca(OH)2,反应Ⅰ中通入Cl2和O2参加反应生成Ca(ClO3)2,Cl元素化合价升高,O元素化合价降低,根据Cl、O元素得失电子守恒配平反应。缓慢通入Cl2、O2可以使其充分反应,使得Cl2转化率增大,“搅拌”可以增大反应的接触面积,气体的溶解度随温度升高而减小,所以反应过程中要控制温度。(2)滤纸破损,会有少量滤渣从破损处流下;液面高于滤纸时,会有滤渣从滤纸与漏斗缝隙处流下;滤纸没有紧贴漏斗内壁,不会造成滤渣从漏斗中流下。(3)从溶解度曲线知,在蒸发浓缩、冷却结晶时,KNO3会析出很多,所以不可以用KNO3代替KCl。(4)①玻璃漏斗的下端短,则不会有冷却时析出的结晶物堵塞导管。②KClO3在400 ℃时才会分解生成KClO4,不能达到600 ℃,充分反应后生成KClO4和KCl,从溶解度曲线知,相同温度下,KClO4的溶解度比KCl的小,故采用蒸发浓缩,趁热过滤而除去KCl,KClO4在漏斗内,再用冷水洗涤KClO4晶体即可。
答案 (1)2Ca(OH)2+2Cl2+5O2===2Ca(ClO3)2+2H2O
缓慢通入Cl2、O2(或搅拌浆料或控制合适的温度)
(2)AB (3)防止产物KClO3中含有较多的KNO3杂质
(4)①防止滤液冷却析出的晶体堵塞漏斗 ②控制温度400 ℃,使KClO3充分分解,将所得固体溶于水并煮沸至有大量固体析出,用热过滤装置过滤,并用冰水洗涤滤渣2~3次
易错点一 过滤操作中的易错点
过滤是最常见的沉淀分离方法,部分沉淀的分离还可以采用倾析法。当沉淀(晶体)的比重较大或结晶的颗粒较大,静置后能很快沉降时,则可采用倾析法进行分离。
过滤操作要做到“一贴、二低、三靠”。“一贴”是指滤纸紧贴漏斗内壁,不残留气泡;“二低”是指滤纸边缘略低于漏斗边缘,液面低于滤纸边缘(防止液体过滤不净);“三靠”是指倾倒时烧杯口要紧靠玻璃棒,玻璃棒下端靠在三层滤纸处,漏斗下端长的那侧管口紧靠烧杯内壁。
[易错训练1] 某氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作。下列说法中正确的是( )
A.起始滤液的pH=7
B.试剂Ⅰ为Ba(NO3)2溶液
C.步骤②中加入试剂Ⅱ的目的是除去Ba2+
D.图示的步骤中必须要经过2次过滤操作
解析 结合题中流程图可知,实验过程中先将样品溶于水,过滤后,向滤液中加入试剂Ⅰ(BaCl2溶液),使Ba2+与SO反应生成BaSO4沉淀,过滤后再向滤液中加入试剂Ⅱ(K2CO3溶液),以除去引入的Ba2+,过滤掉生成的BaCO3沉淀后再向滤液中加入盐酸,以除去引入的CO,最后加热蒸干Q可得纯净的KCl晶体。起始时滤液中含有K2CO3,由于CO水解而使滤液显碱性,A项错误;试剂Ⅰ不能为Ba(NO3)2溶液,否则会引入难以除去的NO,B项错误;图示中的2次过滤操作可以合并为1次,D项错误。
答案 C
易错点二 萃取分液中的认识误区
1.萃取分液的基本要求:
两种溶剂互不溶,溶解程度大不同。
充分振荡再静置,下放上倒要分清。
2.萃取分液中的四步操作:加萃取剂→振荡放气→静置分层→分液。
[易错训练2] (2016·金华外国语学校高二期末模拟)用下列装置进行相应实验,能达到实验目的的是( )
A.用图1所示装置制取干燥的氨气
B.用图2所示装置除去碳酸氢钠固体中的少量碳酸钠
C.用图3所示装置将溶液定容到100 mL
D.用图4所示装置分离出溴苯
解析 NH3不能用浓硫酸干燥,A项错误;碳酸氢钠受热易分解,碳酸钠不易分解,B项错误;配制一定物质的量浓度的溶液定容时应用玻璃棒引流,当液面接近刻度线1~2 cm改用胶头滴管,C项错误;水与溴苯互不相溶,且溴苯密度比水大,可用分液法分离两者混合液,D项正确。
答案 D
易错点三 蒸馏操作中的易错点
蒸馏装置中4注意:温度计位置、冷却水的流向、是否垫石棉网、是否加沸石。
[易错训练3] (2017·浙江衢州二中)下列实验装置设计正确、且能达到目的的是( )
A.实验Ⅰ:可用于吸收氨气,并能防止倒吸
B.实验Ⅱ:静置一段时间,小试管内有晶体析出
C.实验Ⅲ:配制一定物质的量浓度的稀硫酸
D.实验Ⅳ:海水的淡化
解析 A.氨气极易溶于水,有缓冲装置的能防止倒吸,该装置中苯没有缓冲作用,所以不能防止倒吸,故A错误;B.浓硫酸具有吸水作用,可导致有晶体析出,故B正确;C.浓硫酸稀释时放出大量的热,导致配制溶液不准确,容量瓶只能配制溶液,不能稀释或溶解药品,故C错误;D.冷凝管中冷却水应下进上出,故D错误。
答案 B
易错点四 不清楚物质分离与提纯中的操作“判断”
1.判断沉淀是否洗涤干净
可根据沉淀上可能检出的杂质,向最后一次洗出液中加入适宜的试剂来检验沉淀是否洗净。如过滤Na2SO4、BaCl2两溶液恰好完全反应后的混合物时,要检验沉淀是否洗净,应选择AgNO3溶液,若向最后一次洗出液中加入AgNO3溶液时无沉淀(AgCl)生成,则说明沉淀已洗涤干净。
2.判断蒸发浓缩过程中溶液是否达到饱和
在蒸发浓缩过程中,若在液面出现了晶膜,说明溶液已经达到饱和。
3.判断操作中沉淀剂是否过量
静置,取少量上层清液,继续滴加沉淀剂,若无沉淀,则说明已沉淀完全;反之,需要继续滴加沉淀剂直至过量。
[易错训练4] (2018·浙江金华十校联考)某兴趣小组制备肥皂的过程如下:
请回答:
(1)加入乙醇的目的是____________________________________;
“ 后续操作”指________________________________________。
(2)证明牛油已反应完全的方法是___________________________。
解析 本题考查物质的制备、物质的提纯等知识,(1)牛油溶于乙醇,因此加入乙醇的目的是溶解牛油,有利用后续反应;牛油属于油脂,在氢氧化钠溶液中发生水解反应,然后加入食盐,降低有机物的溶解度使之析出,然后用药匙将固体物质取出,用滤纸或纱布沥干,挤压成块;(2)牛油不溶于水,因此检验牛油已经完全反应的方法是用玻璃棒蘸取黏稠液,滴入装有热水的试管中,振荡,若无油滴浮在水面上,证明牛油已反应完全。
答案 (1)溶解牛油,利于后续反应 用药匙将固体物质取出,用滤纸或纱布沥干,挤压成块(过滤、烘干也给分) (2)用玻璃棒蘸取黏稠液,滴入装有热水的试管中,振荡,若无油滴浮在水面上,证明牛油已反应完全
易错点五 不能准确掌握物质分离、提纯的原则
1.不引入新杂质。如果引入杂质则在后续操作中必须除杂。
2.不损耗、不减少被提纯的物质。
3.实验操作要简便易行。
4.加入试剂的顺序要合理。用化学方法除去溶液中的杂质时,要使被分离的物质或离子尽可能除净,需要加入过量的分离试剂,在多步分离过程中,后加的试剂应能够把前面所加入的无关物质或离子除去。
[易错训练5] (2018·桐乡一中高二模拟)海洋动物海鞘中含有种类丰富、结构新颖的次生代谢产物,是海洋抗肿瘤活性物质的重要来源之一。一种从海鞘中提取具有抗肿瘤活性的天然产物的流程如下:
下列关于该流程中各步骤的说法中,错误的是( )
选项 | 步骤 | 采用装置 | 主要仪器 |
A | ① | 过滤装置 | 漏斗 |
B | ② | 分液装置 | 分液漏斗 |
C | ③ | 蒸发装置 | 坩埚 |
D | ④ | 蒸馏装置 | 蒸馏烧瓶 |
解析 由流程可知,步骤①是分离固液混合物,其操作为过滤,需要漏斗、烧杯等仪器;步骤②是分离互不相溶的液体混合物,需进行分液,要用到分液漏斗等仪器;步骤③是从溶液中得到固体,操作为蒸发,需要蒸发皿等仪器;步骤④是从有机化合物中,利用沸点不同用蒸馏的方法得到甲苯,需要蒸馏烧瓶等仪器,则错误的为C,故答案选C。
答案 C
1. (2018·浙江11月选考)下列实验合理的是( )
A.用湿润的pH试纸测定CH3COONa溶液的pH
B.用蒸馏的方法分离乙醇(沸点为78.3 ℃)和苯(沸点为80.1 ℃)的混合物
C.用淀粉KI试纸鉴别碘水和FeCl3溶液
D.用Na2CO3溶液鉴别CaCl2溶液、NaCl溶液和稀硫酸
解析 A项,在测量pH时,pH试纸不能润湿,否则可能引起误差;B项,由于乙醇和苯的沸点相差不大,所以不能用蒸馏的方法进行分离;C项,由于Fe3+能把I-氧化成I2,所以不能用淀粉KI试纸鉴别碘水和FeCl3溶液;D项,CaCl2和Na2CO3反应有白色沉淀生成,NaCl与Na2CO3不反应,而稀硫酸与Na2CO3反应有气泡冒出,现象各不相同,能用Na2CO3溶液鉴别这三种溶液。
答案 D
2.(2017·浙江11月)某兴趣小组查阅资料得知:连苯三酚的碱性溶液能定量吸收O2,CuCl的盐酸溶液能定量吸收CO,且易被O2氧化。拟设计实验方案,采用上述两种溶液和KOH溶液逐一吸收混合气体(由CO2、CO、N2和O2组成)的相应组分。有关该方案设计,下列说法不正确的是( )
A.采用上述3种吸收剂,气体被逐一吸收的顺序应该是CO2、O2和CO
B.其他两种吸收剂不变,O2的吸收剂可以用灼热的铜网替代
C.CO的吸收必须在吸收O2后进行,因为CuCl的盐酸溶液会被O2氧化
D.在3种气体被逐一吸收后,导出的气体中可能含有HCl
解析 题干中要求,逐一吸收相应组分,即一种溶液吸收一种气体,连苯三酚的碱性溶液能吸收O2之外,因为其碱性,还能与CO2反应;CuCl的盐酸溶液能吸收CO之外,还能被O2氧化;为满足题意,吸收O2前需要先吸收CO2,吸收CO前需吸收O2,所以气体被逐一吸收的顺序应该是CO2、O2和CO,所以A,C正确;若用灼热的铜网代替连苯三酚的碱性溶液,会发生2Cu+O22CuO,CO+CuOCO2+Cu,又产生了CO2,故B错误;由于盐酸易挥发,最后一个吸收液为CuCl的盐酸溶液,导出气体中可能含有HCl,故D正确。
答案 B
3.(2017·江苏化学,13)根据下列实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 实验结论 |
A | 向苯酚溶液中滴加少量浓溴水、振荡,无白色沉淀 | 苯酚浓度小 |
B | 向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解 | 部分Na2SO3被氧化 |
C | 向20%蔗糖溶液中加入少量稀H2SO4,加热;再加入银氨溶液,未出现银镜 | 蔗糖未水解 |
D | 向某黄色溶液中加入淀粉KI溶液,溶液呈蓝色 | 溶液中含Br2 |
解析 A项,无白色沉淀,说明苯酚过量,生成的三溴苯酚溶解于苯酚中,错误;B项,加入足量稀盐酸,不溶解的沉淀为BaSO4,说明部分Na2SO3被氧化为Na2SO4,正确;C项,银镜反应需要在碱性条件下进行,加银氨溶液前,应先加NaOH中和H2SO4,错误;D项,溶液呈蓝色,说明I-被氧化为I2,说明溶液中含有氧化性物质,不一定是溴,也可能是Fe3+等,错误。
答案 B
4. (2018·浙江11月选考)通过实验得出的结论正确的是( )
A.将某固体试样完全溶于盐酸,再滴加BaCl2溶液,出现白色沉淀,则该固体试样中存在SO
B.将某固体试样完全溶于盐酸,再滴加KSCN溶液,没有出现血红色,则该固体试样中不存在Fe3+
C.在某固体试样加水后的溶液中,滴加NaOH溶液,没有产生使湿润红色石蕊试纸变蓝的气体,该固体试样中仍可能存在NH
D.在某固体试样加水后的上层清液中,滴加盐酸出现白色沉淀,再加NaOH溶液沉淀溶解,则该固体试样中存在SiO
解析 A项,若该固体是K2SO3和KNO3也会出现这样的现象;B项,若该固体是Cu、Fe2O3或Fe、Fe2O3的混合物,溶于盐酸后,Fe3+被Cu或Fe还原,滴加KSCN溶液后,不会出现血红色现象;C项,在检验NH时,应滴加浓NaOH并加热,才能生成NH3,从而确定是否含有NH;D项,根据现象变化,该固体中也可能存在AlO。
答案 C








