
浙江省2021高考化学一轮复习专题三专项突破4化学工艺流程题的分析教案
展开专项突破4 化学工艺流程题的分析
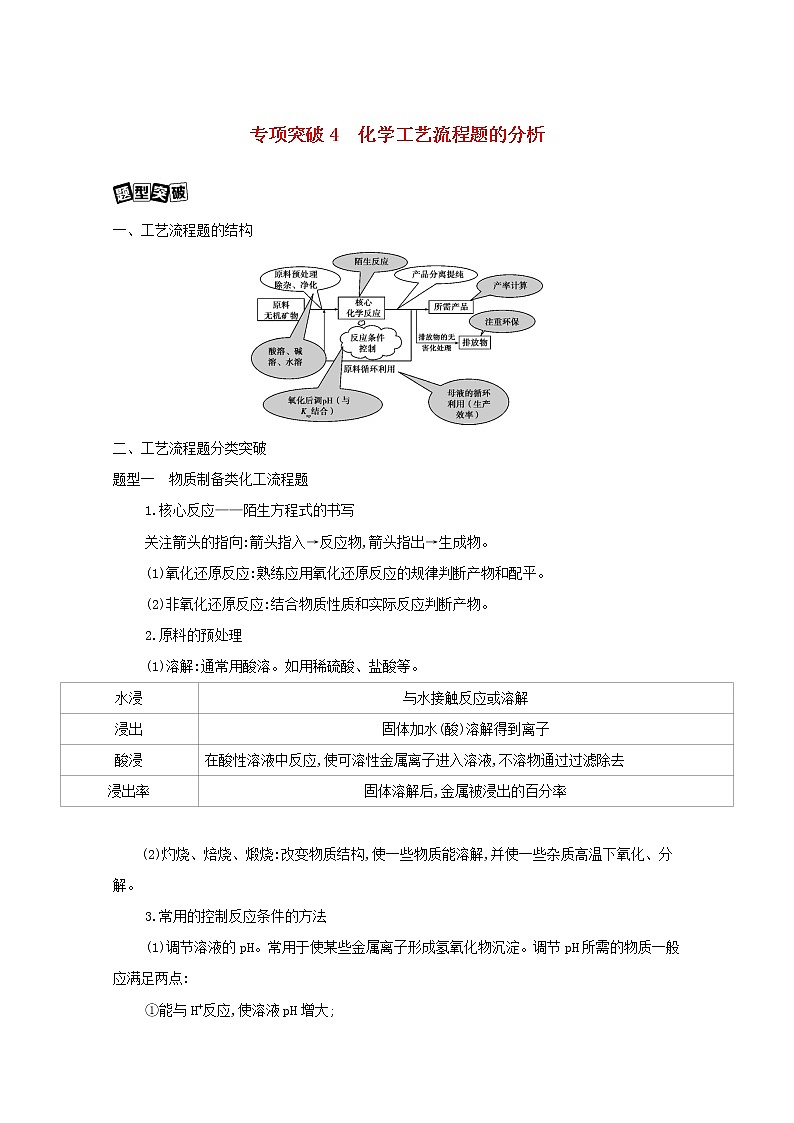
一、工艺流程题的结构
二、工艺流程题分类突破
题型一 物质制备类化工流程题
1.核心反应——陌生方程式的书写
关注箭头的指向:箭头指入→反应物,箭头指出→生成物。
(1)氧化还原反应:熟练应用氧化还原反应的规律判断产物和配平。
(2)非氧化还原反应:结合物质性质和实际反应判断产物。
2.原料的预处理
(1)溶解:通常用酸溶。如用稀硫酸、盐酸等。
水浸 | 与水接触反应或溶解 |
浸出 | 固体加水(酸)溶解得到离子 |
酸浸 | 在酸性溶液中反应,使可溶性金属离子进入溶液,不溶物通过过滤除去 |
浸出率 | 固体溶解后,金属被浸出的百分率 |
(2)灼烧、焙烧、煅烧:改变物质结构,使一些物质能溶解,并使一些杂质高温下氧化、分解。
3.常用的控制反应条件的方法
(1)调节溶液的pH。常用于使某些金属离子形成氢氧化物沉淀。调节pH所需的物质一般应满足两点:
①能与H+反应,使溶液pH增大;
②不引入新杂质。
例如:若要除去Cu2+中混有的Fe3+,可加入CuO、CuCO3、Cu(OH)2、Cu2(OH)2CO3等物质来调节溶液的pH,不可加入NaOH溶液、氨水等。
(2)控制温度。根据需要升温或降温,改变反应速率或使平衡向需要的方向移动。
(3)趁热过滤。防止某物质降温时析出。
(4)冰水洗涤。洗去晶体表面的杂质离子,并减少晶体在洗涤过程中的溶解损耗。
题型二 提纯类化工流程题
1.明确常用的提纯方法
(1)水溶法:除去可溶性杂质。
(2)酸溶法:除去碱性杂质。
(3)碱溶法:除去酸性杂质。
(4)氧化剂或还原剂法:除去还原性或氧化性杂质。
(5)加热灼烧法:除去受热易分解或易挥发的杂质。
(6)调节溶液的pH法:如除去酸性溶液中的Fe3+等。
2.明确常用的分离方法
(1)过滤:分离难溶物和易溶物,根据特殊需要采用趁热过滤或者抽滤等方法。
(2)萃取和分液:利用溶质在互不相溶的溶剂里的溶解度不同分离物质,如用四氯化碳或苯萃取溴水中的溴单质。
(3)蒸发结晶:提取溶解度随温度变化不大的溶质,如NaCl。
(4)冷却结晶:提取溶解度随温度变化较大的溶质、易水解的溶质或结晶水合物,如KNO3、FeCl3、CuCl2、CuSO4·5H2O、FeSO4·7H2O等。
(5)蒸馏或分馏:分离沸点不同且互溶的液体混合物,如分离乙醇和甘油。
(6)冷却法:利用气体液化的特点分离气体,如合成氨工业采用冷却法分离混合气体中的氨气。
1.(2019河南八市重点高中联考)三氧化铬(CrO3)又叫铬酸酐,是一种暗红色固体,溶于水会生成铬酸(H2CrO4),200 ℃以上会部分分解生成氧化铬(Cr2O3)。
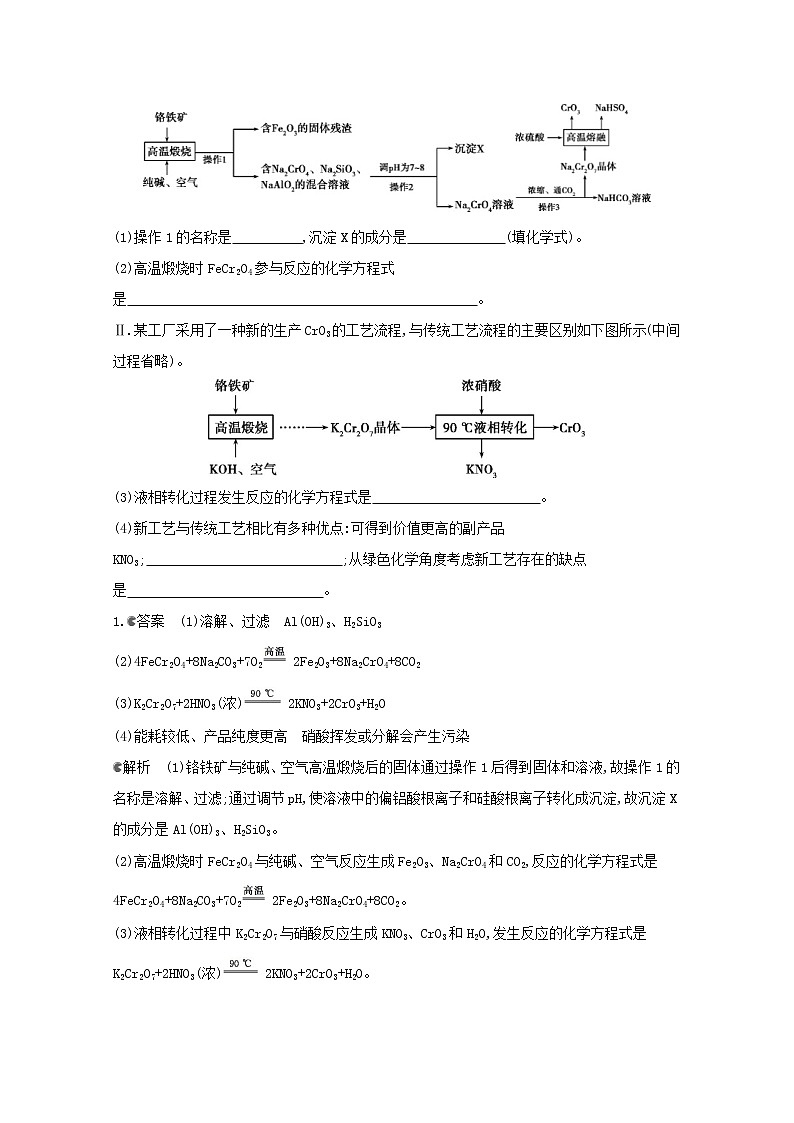
Ⅰ.下图是用铬铁矿(主要成分是FeCr2O4,含Al2O3、SiO2等杂质)生产CrO3的传统工艺流程,请回答相关问题。
(1)操作1的名称是 ,沉淀X的成分是 (填化学式)。
(2)高温煅烧时FeCr2O4参与反应的化学方程式是 。
Ⅱ.某工厂采用了一种新的生产CrO3的工艺流程,与传统工艺流程的主要区别如下图所示(中间过程省略)。
(3)液相转化过程发生反应的化学方程式是 。
(4)新工艺与传统工艺相比有多种优点:可得到价值更高的副产品KNO3; ;从绿色化学角度考虑新工艺存在的缺点是 。
1.答案 (1)溶解、过滤 Al(OH)3、H2SiO3
(2)4FeCr2O4+8Na2CO3+7O2 2Fe2O3+8Na2CrO4+8CO2
(3)K2Cr2O7+2HNO3(浓) 2KNO3+2CrO3+H2O
(4)能耗较低、产品纯度更高 硝酸挥发或分解会产生污染
解析 (1)铬铁矿与纯碱、空气高温煅烧后的固体通过操作1后得到固体和溶液,故操作1的名称是溶解、过滤;通过调节pH,使溶液中的偏铝酸根离子和硅酸根离子转化成沉淀,故沉淀X的成分是Al(OH)3、H2SiO3。
(2)高温煅烧时FeCr2O4与纯碱、空气反应生成Fe2O3、Na2CrO4和CO2,反应的化学方程式是4FeCr2O4+8Na2CO3+7O2 2Fe2O3+8Na2CrO4+8CO2。
(3)液相转化过程中K2Cr2O7与硝酸反应生成KNO3、CrO3和H2O,发生反应的化学方程式是K2Cr2O7+2HNO3(浓) 2KNO3+2CrO3+H2O。
(4)新工艺最后一步需要温度是90 ℃,传统工艺是高温,因此新工艺能耗较低;CrO3 200 ℃以上会部分分解生成Cr2O3,因此新工艺所得CrO3纯度更高;从绿色化学角度考虑新工艺存在的缺点是硝酸挥发或分解会产生污染。
2.(2019陕西西北工业大学附中适应性训练)某工业废水中含有CN-和Cr2等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
回答下列问题:
(1)步骤②中,CN-被ClO-氧化为CNO-的离子方程式为 。
(2)步骤③的反应为S2+Cr2+H+ S+Cr3++H2O(未配平),则每反应0.1 mol Cr2时,消耗S2 mol。
(3)含Cr3+的废水可以加入熟石灰进一步处理,目的是 。
(4)在25 ℃下,将a mol·L-1的NaCN溶液与0.01 mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,则a 0.01(填“>”“<”或“=”);用含a的代数式表示HCN的电离常数Ka= 。
2.答案 (1)CN-+ClO- CNO-+Cl- (2)0.075 (3)调节废水pH,使其转化成Cr(OH)3沉淀除去 (4)> (100a-1)×10-7
解析 (1)碱性条件下,CN-与NaClO发生氧化还原反应生成CNO-、Cl-,离子反应为CN-+ClO- CNO-+Cl-。
(2)步骤③的反应为S2+Cr2+H+ S+Cr3++H2O,S2中S元素的化合价由+2价升高到+6价生成S,Cr2中Cr元素的化合价由+6价降低到+3价生成Cr3+,根据得失电子守恒,S2和Cr2的物质的量之比为3∶4,则每反应0.1 mol Cr2时,消耗S2为0.075 mol。
(3)含Cr3+废水有毒,调节废水pH,使其转化成Cr(OH)3沉淀除去。
(4)由于反应后测得溶液pH=7,当a=0.01时,恰好反应,生成了HCN溶液,显酸性,则氰化钠应该多些,故a>0.01;由电荷守恒c(Na+)+c(H+)=c(OH-)+c(CN-)+c(Cl-)及pH=7,可知c(H+)=c(OH-)=10-7 mol·L-1,c(CN-)=c(Na+)-c(Cl-)=a/2 mol·L-1-0.01/2 mol·L-1,再根据物料守恒:c(CN-)+c(HCN)=c(Na+)=a/2 mol·L-1;Ka===(100a-1)×10-7。
3.(2019广东深圳中学适应性考试)铬是一种银白色金属,化学性质稳定,在化合物中常见+2、+3和+6价等价态。工业上以铬铁矿(主要成分为FeO·Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产金属铬和重铬酸钠晶体Na2Cr2O7·2H2O(已知Na2Cr2O7是一种强氧化剂),其主要工艺流程如下:
查阅资料得知:常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为Cr。
回答下列问题:
(1)工业上常采用热还原法制备金属铬,写出以Cr2O3为原料,利用铝热反应制取金属铬的化学方程式: 。
(2)酸化滤液D时,不选用盐酸的原因是 。
(3)固体E的主要成分是Na2SO4,根据下图分析操作a为 、 、洗涤、干燥。
(4)已知含+6价铬的污水会污染环境,电镀厂产生的镀铜废水中往往含有一定量的Cr2。
含Cr2的废水 含Cr3+的废水Cr(OH)3沉淀
①Cr(OH)3的化学性质与Al(OH)3相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为 (用离子方程式表示)。
②用下列溶液代替上述流程中的Na2S2O3溶液,其中最佳的是 (填选项序号)。
A.FeSO4溶液 B.浓硫酸
C.酸性KMnO4溶液 D.Na2SO3溶液
③上述流程中,每消耗0.1 mol Na2S2O3转移0.8 mol e-,则加入Na2S2O3溶液时发生反应的离子方程式为 。
(5)某工厂废水中含1.00×10-3 mol/L的Cr2,某研究性学习小组为了变废为宝,处理废水得到磁性材料Cr0.5Fe1.5FeO4(Cr元素的化合价为+3,Fe元素的化合价依次为+3、+2)。欲使1 L该废水中的Cr2完全转化为Cr0.5Fe1.5FeO4。理论上需要加入 g FeSO4·7H2O。(已知FeSO4·7H2O的摩尔质量为278 g/mol)
3.答案 (1)Cr2O3+2Al Al2O3+2Cr (2)Cr2会氧化Cl-生成氯气,造成污染 (3)蒸发结晶 趁热过滤 (4)①Cr(OH)3+OH- Cr+2H2O ②D ③3S2+4Cr2+26H+ 8Cr3++6S+13H2O (5)2.78
解析 (1)利用铝热反应制取金属铬的化学方程式:Cr2O3+2Al Al2O3+2Cr。
(2)酸化滤液D时,不选用盐酸的原因是Na2Cr2O7是一种强氧化剂,Cr2会氧化Cl-生成氯气,造成污染。
(3)Na2Cr2O7和Na2SO4的溶解度随温度变化情况存在明显差异,故可利用结晶的方法进行分离,实际操作为蒸发结晶、趁热过滤。
(4)①Cr(OH)3的化学性质与Al(OH)3相似,也能溶解在NaOH溶液中,因此加入NaOH溶液时要控制溶液的pH不能过高,过高说明NaOH明显过量,会溶解Cr(OH)3生成NaCrO2。
②Na2S2O3的作用是还原剂,同时氧化产物为Na2SO4,没有引入新的杂质,可用Na2SO3代替。
③每消耗0.1 mol Na2S2O3转移0.8 mol e-,说明其氧化产物全部为Na2SO4,此时发生反应的离子方程式为3S2+4Cr2+26H+ 8Cr3++6S+13H2O。
(5)根据Cr0.5Fe1.5FeO4中,Cr∶Fe=0.5∶2.5=1∶5,有n(FeSO4·7H2O)=1.00×10-3 mol/L×1 L×2×5=10-2 mol,故其质量为2.78 g。
4.(2019江苏苏锡常镇四市二模)以软锰矿(主要成分为MnO2)和硫锰矿(主要成分为MnS)为原料制备硫酸锰晶体的工艺流程如下:
(1)滤渣中存在一种非金属单质,则酸浸过程中的化学方程式为 。
(2)实验常用氧化还原法测定MnSO4·H2O晶体的纯度,原理如下:
2Mn2++N+4P+2H+ 2[Mn(PO4)2]3-+N+H2O
N+N N2↑+2H2O
[Mn(PO4)2]3-+Fe2+ Mn2++[Fe(PO4)2]3-
称取MnSO4·H2O样品1.000 0 g,溶于适量水中,以磷酸作配位剂,加入过量硝酸铵,在220~240 ℃下充分反应。然后以苯基代邻氨基苯甲酸作指示剂,用0.100 0 mol·L-1硫酸亚铁铵标准溶液滴定生成的[Mn(PO4)2]3-至终点。重复操作3次,记录数据如下表:
滴定次数 | 0.100 0 mol·L-1(NH4)2Fe(SO4)2标准溶液读数/mL | |
滴定前 | 滴定后 | |
1 | 0.10 | 20.20 |
2 | 1.32 | 21.32 |
3 | 1.05 | 20.95 |
已知:Fe2++N+2H+ Fe3++NO↑+H2O。
①测定过程中,硝酸铵的作用是 和 。
②若滴定过程中硫酸亚铁铵标准溶液不是新配制的,所测定的MnSO4·H2O晶体的纯度将会 (填“偏高”“偏低”或“不变”)。
③计算样品中MnSO4·H2O的质量分数(写出计算过程)。
4.答案 (1)MnO2+MnS+2H2SO4 2MnSO4+S+2H2O
(2)①将试样中的二价锰氧化成三价锰 与产生的亚硝酸根反应,消除对滴定的影响
②偏高
③消耗(NH4)2Fe(SO4)2标准溶液的平均体积为20.00 mL。
2MnSO4·H2O~2[Mn(PO4)2]3-~2Fe2+
n(MnSO4·H2O)=n(Fe2+)=20.00 mL×10-3 L·mL-1×0.100 0 mol·L-1=2×10-3 mol
样品中MnSO4·H2O的质量分数为×100%=33.8%
解析 (1)根据流程图分析,MnO2和MnS在稀硫酸中反应生成一种非金属单质,同时产生MnSO4,则“酸浸”时反应的化学方程式为MnO2+MnS+2H2SO4 2MnSO4+S+2H2O。
(2)①由原理:2Mn2++N+4P+2H+ 2[Mn(PO4)2]3-+N+H2O、N+N N2↑+2H2O可推测,硝酸铵的作用是将试样中的二价锰氧化成三价锰和与产生的亚硝酸根反应,消除对滴定的影响。
②若滴定过程中硫酸亚铁铵标准溶液不是新配制的,部分Fe2+被氧化为Fe3+,滴定时消耗的标准溶液偏多,故所测定的MnSO4·H2O晶体的纯度将会偏高。
5.软锰矿的主要成分为MnO2,还含有Fe2O3、MgO、Al2O3、CaO、SiO2等杂质,工业上用软锰矿制取MnSO4·H2O的流程如下:
已知:①部分金属阳离子完全沉淀时的pH如下表。
金属阳离子 | Fe3+ | Al3+ | Mn2+ | Mg2+ |
完全沉淀时的pH | 3.2 | 5.2 | 10.4 | 12.4 |
②温度高于27 ℃时,MnSO4晶体的溶解度随温度的升高而逐渐降低。
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为 。
(2)第1步除杂中加入H2O2的目的是 。
(3)第1步除杂中形成滤渣1的主要成分为 (填化学式),调pH至5~6所加的试剂,可选择 (填以下试剂的序号字母)。
a.CaO b.MgO
c.Al2O3 d.氨水
(4)第2步除杂,主要是将Ca2+、Mg2+转化为相应氟化物沉淀除去,写出MnF2除去Mg2+的离子方程式: 。
(5)采用“趁热过滤”操作的原因是 。
(6)取少量MnSO4·H2O溶于水,配成溶液,测其pH发现该溶液显酸性,原因是 (用离子方程式表示)。
5.答案 (1)MnO2+SO2 S+Mn2+
(2)将Fe2+氧化为Fe3+
(3)Al(OH)3、Fe(OH)3 ab
(4)MnF2+Mg2+ Mn2++MgF2
(5)减少MnSO4·H2O在水中的溶解,得到更多产品
(6)Mn2++2H2O Mn(OH)2+2H+
解析 (1)“浸出”过程中MnO2与SO2发生氧化还原反应,离子方程式为MnO2+SO2 S+Mn2+。
(2)第1步除杂中加入H2O2的目的是将溶液中的Fe2+氧化为Fe3+,以便于形成Fe(OH)3沉淀,过滤将沉淀除去。
(3)第1步除杂时调节溶液的pH在5~6,可以使溶液中的Al3+、Fe3+分别形成Al(OH)3、Fe(OH)3沉淀,所以形成滤渣1的主要成分为Al(OH)3、Fe(OH)3;在调pH至5~6时,为了不引入新的杂质离子,所加的试剂应该可以与酸发生反应,可选择含有Ca2+、Mg2+的化合物CaO、MgO,a、b正确。
(4)第2步除杂,主要是将Ca2+、Mg2+转化为相应氟化物沉淀除去,MnF2除去Mg2+的离子方程式是MnF2+Mg2+ Mn2++MgF2。
(5)由已知②温度高于27 ℃时,MnSO4晶体的溶解度随温度的升高而逐渐降低可知,采用“趁热过滤”操作可以减少MnSO4·H2O在水中的溶解,得到更多产品。
(6)MnSO4是强酸弱碱盐,Mn2+发生水解反应。








