
2021版高考化学一轮复习第四章非金属及其化合物3硫及其重要化合物强化训练2(含解析)新人教版
展开硫及其重要化合物
角度 浓硫酸的性质
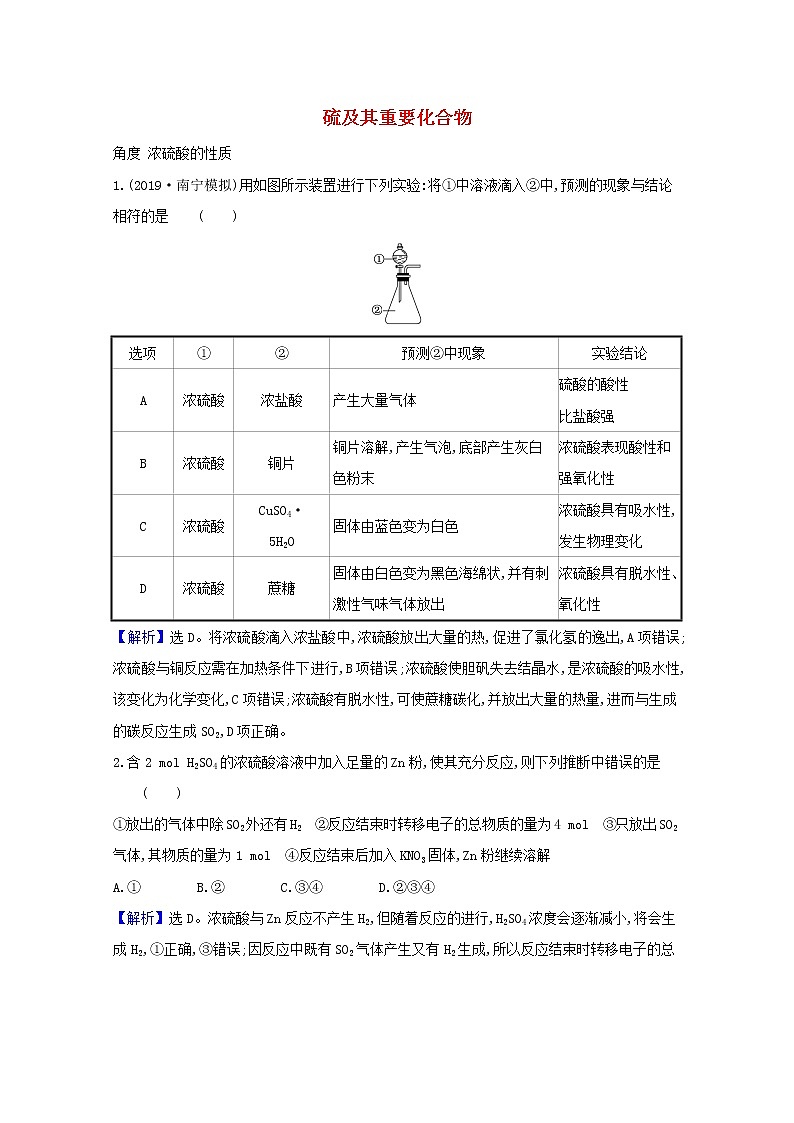
1.(2019·南宁模拟)用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与结论相符的是 ( )
选项 | ① | ② | 预测②中现象 | 实验结论 |
A | 浓硫酸 | 浓盐酸 | 产生大量气体 | 硫酸的酸性 比盐酸强 |
B | 浓硫酸 | 铜片 | 铜片溶解,产生气泡,底部产生灰白色粉末 | 浓硫酸表现酸性和强氧化性 |
C | 浓硫酸 | CuSO4· 5H2O | 固体由蓝色变为白色 | 浓硫酸具有吸水性,发生物理变化 |
D | 浓硫酸 | 蔗糖 | 固体由白色变为黑色海绵状,并有刺激性气味气体放出 | 浓硫酸具有脱水性、氧化性 |
【解析】选D。将浓硫酸滴入浓盐酸中,浓硫酸放出大量的热,促进了氯化氢的逸出,A项错误;浓硫酸与铜反应需在加热条件下进行,B项错误;浓硫酸使胆矾失去结晶水,是浓硫酸的吸水性,该变化为化学变化,C项错误;浓硫酸有脱水性,可使蔗糖碳化,并放出大量的热量,进而与生成的碳反应生成SO2,D项正确。
2.含2 mol H2SO4的浓硫酸溶液中加入足量的Zn粉,使其充分反应,则下列推断中错误的是 ( )
①放出的气体中除SO2外还有H2 ②反应结束时转移电子的总物质的量为4 mol ③只放出SO2气体,其物质的量为1 mol ④反应结束后加入KNO3固体,Zn粉继续溶解
A.① B.② C.③④ D.②③④
【解析】选D。浓硫酸与Zn反应不产生H2,但随着反应的进行,H2SO4浓度会逐渐减小,将会生成H2,①正确,③错误;因反应中既有SO2气体产生又有H2生成,所以反应结束时转移电子的总物质的量在2 mol到4 mol之间,②错误;因Zn粉足量,反应结束后溶液呈中性,此时加入KNO3固体后,N因缺少必要的条件——酸性介质,所以不与Zn反应,④错误。
3.(2019·上海高考)某实验小组同学为了探究铜与浓硫酸的反应,进行了一系列实验。在反应过程中会发生一些副反应,生成不溶于水和酸的CuS、Cu2S。
(1)处于安全和绿色化学考虑,在制取硫酸铜时,可选用下列的物质是______________。
a.Cu b.CuO
c.CuS d.CuSO4·Cu(OH)2·H2O
(2)装置a的作用是________,反应过程中,因为浓硫酸的吸水作用,圆底烧瓶中出现白色固体物质,如何简便检验反应后圆底烧瓶里有Cu2+存在___________
在实际反应中,由于条件控制不好,容易产生CuS和Cu2S固体:2CuSCu2S+S。
(3)已知样品质量为a g,得到Cu2S是b g,则样品中CuS质量分数是________。如果Cu2S高温下转化为Cu,则实验测得的值会________。(填“偏大”“偏小”或“不变”)
(4)根据以上信息,说明铜与浓硫酸反应需要控制哪些条件?
________________________________________________________。
【解析】(1)a.Cu、c.CuS与硫酸反应分别生成污染物二氧化硫、硫化氢,不符合绿色化学理念;而b.CuO、d.CuSO4·Cu(OH)2·H2O与硫酸反应生成硫酸铜和水,符号绿色化学理念;(2)二氧化硫易与氢氧化钠溶液反应,直接吸收会发生倒吸现象,使用装置a可防止倒吸;检验反应后圆底烧瓶里有Cu2+存在的方法:将反应后的溶液沿烧杯壁缓缓倒入水中,若溶液变蓝,则有Cu2+存在。
(3)设样品中CuS质量为m,2CuSCu2S+S Δm(减少)
96×2 32
m (a-b) g
m==6(a-b),
样品中CuS质量分数:=;
如果Cu2S高温下转化为Cu,导致b偏小,则(a-b)的值偏大,实验测得的值会偏大;
(4)根据分析可知,若温度过高、时间过长易发生副反应,则铜与浓硫酸反应温度不宜过高,反应时间不易过长。
答案:(1)bd (2)防倒吸 将反应后的溶液沿烧杯壁缓缓倒入水中,若溶液变蓝,则有Cu2+存在 (3) 偏大 (4)温度不宜过高,时间不易过长
【加固训练】
1.对下列事实的解释正确的是 ( )
A.蘸有浓硫酸和蘸有浓氨水的玻璃棒靠近没有白烟,说明硫酸与氨气不反应
B.医疗上可用硫酸钡作X射线透视肠胃的内服药,是因为硫酸钡不溶于酸
C.向50 mL 18 mol·L-1的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量等于0.45 mol
D.常温下,浓硫酸可以用铝制容器贮存,说明铝与浓硫酸不反应
【解析】选B。氨与挥发性酸反应可形成白烟,硫酸难挥发,A错误;随着反应的进行,硫酸的浓度降低,稀硫酸不能与铜反应,C错误;常温下浓硫酸使铝钝化(化学变化),形成致密的氧化膜阻碍了反应的继续进行,D错误。
2.(2019·宜春模拟)如图是某学校购买的硫酸试剂标签上的部分内容。据此下列说法正确的是 ( )
A.该硫酸的物质的量浓度为1.84 mol·L-1
B.1 mol Zn与足量的该硫酸反应产生2 g H2
C.配制200 mL 4.6 mol·L-1的稀硫酸需取该硫酸50 mL
D.该硫酸与等体积的水混合所得溶液的物质的量浓度等于9.2 mol·L-1
【解析】选C。A.该硫酸溶液的物质的量浓度为 mol·L-1=
18.4 mol·L-1,故A错误;B.锌和浓硫酸反应生成二氧化硫,浓硫酸足量没有氢气生成,故B错误;C.设配制200 mL 4.6 mol·L-1的稀硫酸需取该硫酸的体积为x L,根据溶液稀释前后溶质的物质的量不变,则0.2 L×4.6 mol·L-1=x×18.4 mol·L-1,解得x=0.05 L=50 mL,故C正确;D.浓硫酸和水的密度不同,等体积混合后体积不等于硫酸体积的2倍,混合后物质的量浓度不是9.2 mol·L-1,故D错误。
3.一定量的铜粉与浓硫酸共热产生SO2气体的体积为2.24 L(标准状况下),则下列情况不可能的是 ( )
A.加入Cu的质量为6.4 g
B.加入的浓硫酸中含溶质0.2 mol
C.加入Cu的质量大于6.4 g
D.加入浓硫酸中含溶质多于0.2 mol
【解析】选B。由Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O知,生成2.24 L SO2需要消耗6.4 g Cu、0.2 mol H2SO4,但随反应的进行,浓硫酸会变为稀硫酸,故硫酸的量应大于0.2 mol,D正确,B错误;铜可能恰好反应完全也可能有剩余,A、C正确。








