






化学人教版 (2019)第三章 水溶液中的离子反应与平衡实验活动2 强酸与强域的中和滴定获奖ppt课件
展开1.影响化学反应速率的外界因素有: 、 、 、 、固体反应物的表面积等。 2.其他条件相同,煤粉比煤块燃烧时的反应速率 。 3.HClO经光照时,分解速率会 (填“增大”或“减小”)。 4.在化学反应中,能改变其他物质的 ,而本身的 和 在反应前后都没有变化的物质,叫做催化剂。 5.向H2O2溶液中加入MnO2,会 (填“增大”或“减小”,下同)H2O2的分解速率;降低温度,会 H2O2的分解速率。
一、影响化学反应速率的因素在相同条件下,不同的化学反应会有不同的速率,这表明反应速率首先是由反应物的组成、结构和性质等因素决定的。1.浓度对反应速率的影响当其他条件相同时,增大反应物的浓度,化学反应速率增大;降低反应物浓度,化学反应速率减小。2.温度对反应速率的影响其他条件相同时,升温反应速率 ,降温反应速率 。据测定,许多反应的温度每升高10 ℃,其反应速率增大为原来的 倍,这表明温度对反应速率的影响非常显著。
3.催化剂对反应速率的影响使用催化剂可 化学反应速率(一般情况下是指增大反应速率)。 4.压强对反应速率的影响对于有气体参加的反应,在相同温度下:增大压强(减小容器容积),反应速率 ; 减小压强(增大容器容积),反应速率 。 5.其他因素对反应速率的影响如光辐照、放射线辐照、超声波、电弧、强磁场、高速研磨、 反应物间的接触面积等,均是行之有效的改变化学反应速率的方法。
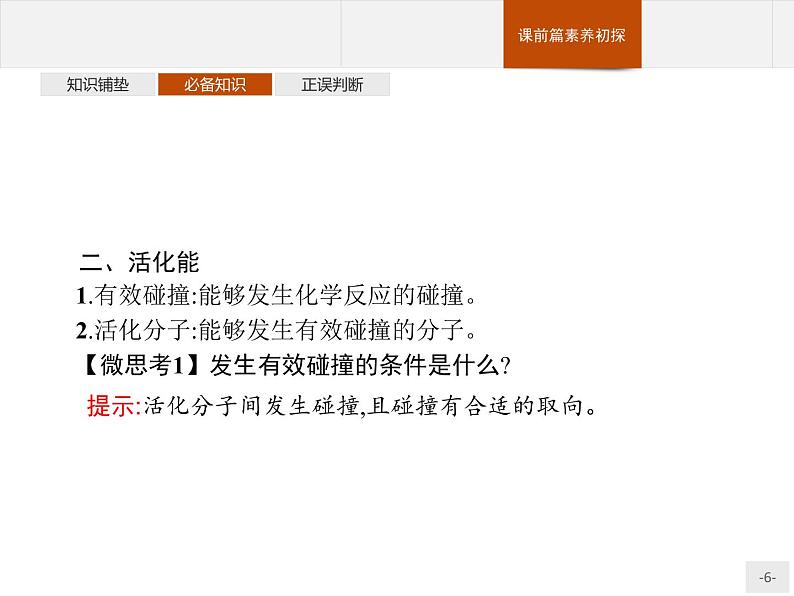
二、活化能1.有效碰撞:能够发生化学反应的碰撞。2.活化分子:能够发生有效碰撞的分子。【微思考1】发生有效碰撞的条件是什么?
提示:活化分子间发生碰撞,且碰撞有合适的取向。
3.活化能:活化分子具有的平均能量与反应物分子具有的平均能量之差。4.指出下图中有关能量E的含义:
E1:反应的 ; E2:活化分子变成生成物分子 的能量; E1-E2: 。
5.外界条件对化学反应速率影响的理论解释:(1)浓度:其他条件不变时,增加反应物浓度→单位体积内 增多→单位时间内 的次数增加→化学反应速率 。反之,减小反应物浓度,化学反应速率 。 (2)压强:对于有气体参加的反应,在相同温度下,增大压强→气体体积减小→ 增大→反应速率 ;反之减小压强,反应速率 。 (3)温度:其他条件相同时,升高温度→反应物分子中活化分子 增大→单位时间内 的次数增加→化学反应速率增大。
(4)催化剂(正):降低反应所需 →单位体积内反应物分子中 增大→ 的次数增加→反应速率增大。 如图所示,使用催化剂使反应速率增大:其中途径Ⅰ表示 。途径Ⅱ表示 。使用了催化剂,反应的活化能 。 图中E1、E2都是该反应的活化能,但E2 E1是因为使用了催化剂与不使用催化剂相比,反应的活化能由 变为 。
【微思考2】既能增大活化分子在反应物分子中的百分数,又能增大活化分子个数的外界条件是什么?
提示:升温、使用催化剂(正)。
(1)锌与硫酸反应时,硫酸的浓度越大,产生H2的速率越大。 ( )(2)增大压强一定能增大化学反应速率。 ( )(3)催化剂能降低反应的活化能,ΔH也会发生变化。 ( )(4)双氧水中加入MnO2,可以使生成O2的速率增大,是因为MnO2的催化作用。 ( )(5)两试管各加入5 mL 0.1 ml·L-1Na2S2O3溶液,同时分别滴入55 mL 0.1 ml·L-1硫酸溶液和盐酸,两支试管同时变浑浊。 ( )(6)FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同。 ( )
答案:(1)× (2)× (3)× (4)√ (5)× (6)×
浓度、压强对化学反应速率的影响问题探究1.对于一个在溶液中进行的反应,改变溶液的用量对化学反应速率有何影响?2.增大反应物浓度对可逆反应的逆反应速率有何影响?
答案:改变溶液的用量时,由于浓度不变,因此对化学反应速率无影响。
答案:增大反应物浓度,正反应速率增大,在改变的瞬间,生成物的浓度可认为不变,逆反应速率不变;但随着反应的进行,反应物的浓度逐渐减小,生成物的浓度逐渐增大,导致正反应速率逐渐减小,逆反应速率逐渐增大,直到两者相等。
3.增大压强(减小容器体积)是否改变了活化分子的百分数?4.怎样理解向反应容器中加入稀有气体对反应速率的影响?5.对于那些反应物和生成物中都有气体参加的可逆反应来说,增大体系的压强(减小体积),正、逆反应速率怎样变化?
答案:增大压强(减小容器体积)时,单位体积内活化分子数增加,单位体积中总的气体分子数也增加,故活化分子百分数不变。
答案:向容器中加入稀有气体,如果保持恒温恒容,尽管容器内总压强增大了,但容器的体积不变,反应物的浓度不变,因此反应速率不变;如果保持恒温恒压,加入稀有气体后,为维持容器内压强不变,容器的体积增大,反应物的浓度减小,因此反应速率减小。
答案:增大体系的压强(减小体积),反应物和生成物的浓度都增大,所以,正反应的速率和逆反应的速率都增大。
深化拓展1.浓度改变对化学反应速率的影响(1)用碰撞理论解释浓度变化对化学反应速率的影响反应物浓度增大→单位体积内分子数增多→单位体积内活化分子数增多→单位时间内有效碰撞次数增多→化学反应速率增大。(2)分析浓度对化学反应速率的影响时需注意的问题①固体或纯液体的浓度视为常数,所以增加其用量时,化学反应速率不变。但增大固体的表面积或将固体溶于一定溶剂中,能增大化学反应速率。②增大反应物浓度,即增大了单位体积内活化分子的数目,但活化分子的百分数没有增大。③增大反应物的浓度,必须是增加实际参加反应的反应物浓度才能增大反应速率。
2.压强影响反应速率的常见情况改变压强,对化学反应速率产生影响的根本原因是压强改变时引起气体反应物浓度改变。所以在讨论压强对反应速率的影响时,应注意压强变化是否引起物质浓度的变化。(1)对于没有气体参与的化学反应,由于改变压强时,反应物浓度变化可以忽略不计,因此对化学反应速率无影响。(2)对于有气体参与的化学反应,有以下几种情况:①恒温时
素能应用典例1 500 mL 1 ml·L-1的稀盐酸与锌反应,下列操作能使产生氢气的速率增大的是( )A.在忽略接触面积变化的情况下,增加锌的质量B.将500 mL 1 ml·L-1的稀盐酸改为1 000 mL 1 ml·L-1的稀盐酸C.用 1 ml·L-1的H2SO4溶液代替1 ml·L-1的稀盐酸D.用浓硫酸代替1 ml·L-1的稀盐酸
答案:C 解析:该反应的实质是2H++Zn=Zn2++H2↑,增大反应物浓度可使反应速率增大,由于纯固体、纯液体的浓度为定值,所以在忽略接触面积变化的情况下,增加锌的质量,不能增大反应速率。而将等浓度的盐酸由500 mL变为1 000 mL,只是改变了溶液的体积,并未改变其浓度,所以反应速率不变。用1 ml·L-1的H2SO4溶液代替1 ml·L-1的稀盐酸,溶液中氢离子浓度增加一倍,所以反应速率增大。浓硫酸与锌反应不产生氢气。
变式训练1对反应A+B AB来说,常温下按以下情况进行反应:①20 mL溶液中含A、B各0.01 ml ②50 mL溶液中含A、B各0.05 ml ③0.1 ml·L-1的A、B溶液各10 mL混合 ④0.5 ml·L-1的A、B溶液各50 mL混合四者反应速率的大小关系是( )A.②>①>④>③B.④>③>②>①C.①>②>④>③D.①>②>③>④
答案:A 解析:反应物的浓度越大,反应速率越大。①A、B的浓度各为0.5 ml·L-1;②A、B的浓度各为1 ml·L-1;③A、B的浓度各为0.05 ml·L-1;④A、B的浓度各为0.25 ml·L-1;所以四者反应速率的大小关系是②>①>④>③。
典例2在一密闭容器中充入2 ml H2和2 ml I2,压强为p,在一定温度下发生H2(g)+I2(g) 2HI(g)的反应:(1)恒容条件下,向其中加入1 ml H2,反应速率 (填“增大”“减小”或“不变”,下同)。 (2)恒容条件下,向其中加入1 ml Ar,反应速率 。 (3)恒压条件下,向其中加入1 ml Ar,反应速率 。
答案:(1)增大 (2)不变 (3)减小解析:(1)恒容条件下,充入H2,增大了反应物浓度,反应速率增大。(2)恒容条件下,充入与反应无关的气体(Ar),没有引起反应物浓度的变化,反应速率不变。(3)恒压条件下,充入与反应无关的气体(Ar),使得容器体积增大,各反应物浓度减小,反应速率减小。
变式训练2其他条件一定,下列条件的改变,一定能增大化学反应速率的是( )A.增大压强 B.增大反应物的浓度C.增大反应物的量D.减小生成物的浓度
答案:B 解析:对于非气体反应体系,增大压强不会改变化学反应速率;对于反应物为固体的化学反应,改变反应物的量一般不会改变化学反应速率;对于可逆反应,减小生成物的浓度会使化学反应速率减小。
温度、催化剂对化学反应速率的影响问题探究1.对一个吸热反应,其他条件不变时,升高温度,它的反应速率也增大吗?2.活化能和反应速率有什么关系?3.催化剂一定都能增大化学反应速率吗?
答案:增大;升高温度,活化分子百分数、单位时间内有效碰撞次数都增加,无论是放热反应还是吸热反应,反应速率都增大。
答案:活化能越小,一般分子成为活化分子越容易,活化分子越多,单位时间内有效碰撞次数越多,则反应速率越大。
答案:不一定。有的反应需要负催化剂,即有的催化剂可减小化学反应速率。
深化拓展1.温度对反应速率的影响(1)规律当其他条件不变时,
(3)注意:所有化学反应的反应速率都与温度有关。
2.催化剂对反应速率的影响(1)影响规律:使用合适的催化剂,可增大化学反应速率。(2)微观解释:
(3)注意事项:①催化剂有正、负之分,正催化剂能增大反应速率,负催化剂能减小反应速率,不特别指明的条件下,均指正催化剂。②催化剂只有在一定温度下,才能最大限度地发挥其催化作用。
素能应用典例3硫代硫酸钠溶液与稀硫酸反应的化学方程式为Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,下列各组实验中最先出现浑浊的是( )
答案:D 解析:当有多个外界条件时,要对比找出其相同条件和不同条件,然后通过比较进行判断。影响化学反应速率的因素很多,本题从浓度和温度两个因素考查,结合选项知混合溶液体积都为20 mL,根据浓度越大、温度越高,反应速率越大,可以推知D选项正确。
变式训练3下列反应中,开始时放出氢气的速率最大的是( )
答案:C解析:C项中锌的表面积大,硫酸的浓度大,温度高,故反应速率最快。
典例4向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按正反应速率由大到小排列顺序正确的是( )甲:500 ℃,10 ml SO2和5 ml O2的反应乙:500 ℃,用V2O5作催化剂,10 ml SO2和5 ml O2的反应丙:450 ℃,8 ml SO2和5 ml O2的反应丁:500 ℃,8 ml SO2和5 ml O2的反应A.甲、乙、丙、丁B.乙、甲、丁、丙C.乙、甲、丙、丁D.丁、丙、乙、甲
答案:B 解析:增大反应物浓度,升高温度,使用催化剂等均可增大反应速率。要比较正反应速率大小,则需要比较温度、是否使用催化剂及氧气和SO2的浓度,所以根据题干数据可判断正反应速率由大到小的顺序是乙、甲、丁、丙。
变式训练4下列关于催化剂的说法,正确的是 ( )A.催化剂能使不发生反应的物质发生反应B.催化剂在化学反应前后化学性质和质量都不变C.催化剂不能改变化学反应速率D.任何化学反应都需要催化剂
答案:B 解析:催化剂能改变化学反应速率的原因是它能改变反应机理,在化学反应过程中,催化剂参与反应,经过一系列变化之后,催化剂又恢复到原来的状态。尽管催化剂能改变化学反应速率,但对于不能发生反应的物质,是不能使其反应的,另外,有些反应是不需要催化剂的。
1.下列说法不正确的是( )A.其他条件不变,缩小气体体积增大压强,单位体积内的分子数增大,活化分子数增多,化学反应速率增大B.其他条件不变,增大体积减小压强,单位体积内的分子数减小,活化分子数减少,化学反应速率减小C.加入反应物,使活化分子百分数增大,化学反应速率增大D.减小反应物的浓度,单位体积内的分子数减少,活化分子数减少,化学反应速率减小
答案:C 解析:增大体积减小压强或减小反应物的浓度,单位体积内的活化分子数减少,化学反应速率减小,故B、D两项正确。其他条件不变,缩小体积增大压强,单位体积内的活化分子数增多,化学反应速率增大,故A项正确。加入反应物,反应物的活化分子百分数不变,C项说法错误。
2.下列判断正确的是( )A.0.1 ml·L-1的盐酸和0.1 ml·L-1的H2SO4溶液分别与0.2 ml·L-1 NaOH溶液反应的速率相同B.0.1 ml·L-1的盐酸和0.1 ml·L-1 的HNO3溶液分别与大小相同的大理石反应的速率相同C.大小、形状相同的镁和铁分别与0.1 ml·L-1 HCl溶液反应的速率相同D.大理石块与大理石粉末分别与0.1 ml·L-1 HCl溶液反应的速率相同
答案:B解析:A中0.1 ml·L-1的盐酸与0.1 ml·L-1的H2SO4溶液中c(H+)是不同的,因而反应速率不同,A项错误;D中大理石粉末与盐酸的接触面积更大,故反应速率更大,D项错误;而同浓度的两种一元强酸溶液与大理石反应时的本质是相同的:CaCO3+2H+=Ca2++CO2↑+H2O,因此在c(H+)相同的情况下,反应速率相同,B项正确;在完全相同的外界条件下,Mg、Fe由于自身金属活动性的不同,与0.1 ml·L-1盐酸反应时,反应速率v(Mg)>v(Fe),C项错误。
3.下列说法中正确的是( )A.增大反应物的物质的量一定能增大化学反应速率B.升高温度使放热反应速率减小,吸热反应速率增大C.使用正催化剂,能增大化学反应速率D.增大压强,肯定会增大化学反应速率
答案:C 解析:增大反应物的物质的量不一定能增大反应物的浓度,故化学反应速率不一定增大;升高温度使分子运动加快,分子获得更高的能量,活化分子百分数增大,单位时间内有效碰撞次数增多,反应速率增大(无论化学反应是吸热反应还是放热反应);对有气体参加的反应,增大压强一定要使反应物的浓度增大,才会增大反应速率,反应物的浓度不变,其反应速率也不会发生变化。
4.下列说法中有明显错误的是( )A.对有气体参加的化学反应,增大压强使体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大B.活化分子之间发生的碰撞不一定为有效碰撞C.升高温度,一般可使活化分子的百分数增大,因而反应速率增大D.加入适宜的催化剂,使分子能量增加从而可使活化分子的百分数大大增加,从而成千上万倍地增大反应速率
答案:D 解析:对有气体参加的化学反应,增大压强使体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大,A项正确;活化分子之间发生的碰撞不一定为有效碰撞,只有能引起化学变化的碰撞才是有效碰撞,B项正确;升高温度,一般可使活化分子的百分数增大,因而反应速率增大,C项正确;加入适宜的催化剂,可降低活化能从而可使活化分子的百分数大大增加,从而成千上万倍地增大反应速率,D项错误。
人教版 (2019)选择性必修1第一节 电离平衡教学演示课件ppt: 这是一份人教版 (2019)选择性必修1第一节 电离平衡教学演示课件ppt,共19页。PPT课件主要包含了①②③,①②③④,解题方法,2aL,6aL等内容,欢迎下载使用。
2021学年第一节 化学反应速率评优课习题课件ppt: 这是一份2021学年第一节 化学反应速率评优课习题课件ppt,文件包含21第2课时影响化学反应速率的因素活化能课件新教材人教版2019高中化学选择性必修一共36张PPTpptx、21第2课时影响化学反应速率的因素活化能课后习题新教材人教版2019高中化学选择性必修一docx等2份课件配套教学资源,其中PPT共36页, 欢迎下载使用。
高中化学人教版 (2019)选择性必修1第一节 化学反应速率教课内容ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第一节 化学反应速率教课内容ppt课件,共60页。PPT课件主要包含了自主预习,有效碰撞,活化分子,核心突破,化学反应速率图像,随堂检测等内容,欢迎下载使用。













