





人教版 (2019)选择性必修1实验活动2 强酸与强域的中和滴定优质课件ppt
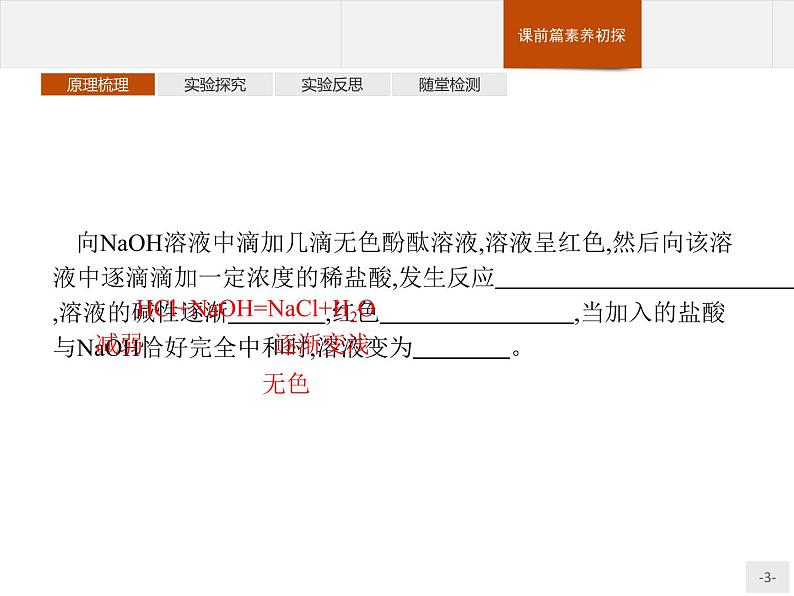
展开向NaOH溶液中滴加几滴无色酚酞溶液,溶液呈红色,然后向该溶液中逐滴滴加一定浓度的稀盐酸,发生反应 ,溶液的碱性逐渐 ,红色 ,当加入的盐酸与NaOH恰好完全中和时,溶液变为 。
HCl+NaOH=NaCl+H2O
一、练习使用滴定管1.【思考与讨论】(1)滴定管的最大刻度与量筒的最大刻度是否都在刻度的上端?(2)酸式滴定管和碱式滴定管最大的不同点在哪里?为什么?(3)滴定管在使用前,首先要进行的操作是什么?
提示:(1)否。滴定管的最大刻度与量筒的最大刻度位置不同,滴定管的最大刻度在刻度的最下端(最大刻度之下还有一段玻璃管没有刻度),而量筒的最大刻度在刻度的最上端。(2)酸式滴定管和碱式滴定管最大的不同点在滴定管的下端,酸式滴定管的下端是玻璃旋塞,而碱式滴定管的下端有一段乳胶管,乳胶管中有一小玻璃球,因碱性溶液会与玻璃旋塞部分反应生成硅酸盐,而酸性溶液会腐蚀乳胶管。(3)滴定管在使用前,首先要检查是否漏水。
2.完成教材第89页【实验步骤】一的实验内容,熟悉酸式滴定管和碱式滴定管的构造及使用基本方法。
二、用已知浓度的强酸滴定未知浓度的强碱1.【思考与讨论】(1)滴定管在使用前要用标准液或待测液润洗,而锥形瓶则不必,为什么?(2)锥形瓶下一般要垫一张白纸,目的是什么?(3)接近滴定终点时,如何滴加标准液?(4)以酚酞作指示剂,判断达到滴定终点时的标准是什么?
提示:(1)滴定管在使用前用蒸馏水洗涤后,若不润洗,则会使所盛溶液浓度减小,引起误差。而锥形瓶不能润洗,否则会使所盛溶液溶质偏多。(2)锥形瓶下垫一张白纸的目的是便于观察溶液颜色的变化。(3)接近滴定终点时,改为滴加半滴标准液。(4)达到滴定终点的标准是:当滴加半滴酸后,溶液的颜色从粉红色刚好变为无色,且半分钟内不变色。
2.完成教材第90页【实验步骤】二的实验内容,掌握用已知浓度的强酸滴定未知浓度的强碱的相关操作。
1.实验注意事项:(1)酸式滴定管不能盛碱性溶液(如NaOH、Na2CO3溶液等);碱式滴定管不能盛酸性和强氧化性溶液(如酸性KMnO4溶液等)。(2)滴定管在使用前要检漏,装液前除用蒸馏水洗净外,还须用待盛的溶液润洗。(3)注意滴定管的刻度、读数与量筒的区别。(4)滴定速率,先快后慢。当接近终点时应一滴一摇动。(5)水平读数,视线与凹液面最低处、刻度在同一水平线上。(6)滴定后应稍等几分钟,使内壁上液体顺壁流下,然后再读数。(7)读数应精确到小数点后两位。如25.00 mL是正确的,而不是25 mL或25.000 mL。
(8)锥形瓶不能用待测液润洗。因润洗后,瓶内壁会附着一定量的待测液。(9)在滴定过程中,锥形瓶中若有水,对实验结果无影响。(10)取待测液的滴定管用蒸馏水洗净后,必须用待测液润洗,否则,装入的溶液会被稀释,影响结果。2.【微思考】(1)中和滴定一般重复2~3次,其目的是什么?(2)锥形瓶装待测液之前是否需要干燥?
提示:减小实验误差。
1.在盐酸滴定NaOH溶液的实验中,用甲基橙作指示剂,滴定到终点时,溶液的颜色变化是( )A.由黄色变为红色B.由黄色变为橙色C.由橙色变为红色D.由红色变为橙色
解析:甲基橙在NaOH溶液中显黄色,滴定到终点时,溶液由黄色变为橙色。
2.下列有关叙述正确的是( )A.下端连有乳胶管的滴定管为酸式滴定管B.滴定管的最大刻度与量筒的最大刻度位置相同C.滴定前应排除滴定管尖嘴部分的气泡D.滴定过程中两眼应注意滴定管内液面的变化
解析:A选项中所指滴定管是碱式滴定管;B选项中滴定管最大刻度在下,量筒最大刻度在上;D选项,滴定过程中两眼应观察锥形瓶内溶液颜色的变化。
3.如图是室温下盐酸与氢氧化钠溶液的滴定曲线a和b,试认真分析后填空:
(1)曲线a是用 溶液滴定 溶液; (2)P点的坐标为 ;盐酸的物质的量浓度为 ml·L-1。
答案:(1)NaOH HCl (2)(15,7) 0.1解析:一定要理解图中具体坐标点的意义。a曲线pH随滴定的进行而增大,则说明其为碱溶液滴定酸溶液的过程,且V=0时pH=1,说明该盐酸的浓度为0.1 ml·L-1,同理b曲线是酸溶液滴定碱溶液的过程,且该氢氧化钠溶液的浓度也为0.1 ml·L-1。
4.某学生用0.150 0 ml·L-1NaOH溶液测定某未知浓度的盐酸,其操作可分解为如下几步:A.用蒸馏水洗净滴定管B.用待测定的溶液润洗酸式滴定管C.用酸式滴定管取稀盐酸25.00 mL,注入锥形瓶中,加入酚酞D.另取锥形瓶,再重复操作2~3次E.检查滴定管是否漏水F.取碱式滴定管用标准NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3 cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
完成以下填空:(1)滴定时正确操作的顺序是(用序号字母填写): → →F→ → → →D (2)操作F中应该选择图中滴定管 (填标号)。
(3)滴定时边滴边摇动锥形瓶,眼睛应注意观察 。达到滴定终点时,溶液颜色的变化是 。
(4)滴定结果如表所示:
计算该盐酸的物质的量浓度为 (精确至0.000 1)。 (5)下列操作会导致测定结果偏高的是 。 A.碱式滴定管在装液前未用标准NaOH溶液润洗B.滴定过程中,锥形瓶摇动得太剧烈,锥形瓶内有液滴溅出C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡D.达到滴定终点时,仰视读数
答案:(1) E A B C G (2)乙(3)锥形瓶内溶液颜色的变化 由无色变为浅红色,且半分钟内不褪色 (4)0.120 0 ml·L-1 (5)AD
解析:(1)中和滴定按照检漏、洗涤、润洗、装液、取待测液并加指示剂、滴定等顺序操作。(2)根据题意,操作F中应该选择碱式滴定管,碱式滴定管为乙。(3)滴定时,边滴边摇动锥形瓶,眼睛应注意观察锥形瓶内溶液颜色的变化,达到滴定终点时,锥形瓶内溶液由无色变为浅红色,且半分钟内不褪色。(4)根据
人教版 (2019)选择性必修1实验活动2 强酸与强域的中和滴定教学演示课件ppt: 这是一份人教版 (2019)选择性必修1实验活动2 强酸与强域的中和滴定教学演示课件ppt,共29页。PPT课件主要包含了玻璃活塞,氧化性,是否漏水,~3mL,红色刚好变为无色,半分钟内,数据记录等内容,欢迎下载使用。
人教版 (2019)选择性必修1实验活动2 强酸与强域的中和滴定评课课件ppt: 这是一份人教版 (2019)选择性必修1实验活动2 强酸与强域的中和滴定评课课件ppt,共27页。
高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡实验活动2 强酸与强域的中和滴定课前预习课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡实验活动2 强酸与强域的中和滴定课前预习课件ppt,文件包含第三章水溶液中的离子反应与平衡_实验活动2强酸与强碱的中和滴定-课件ppt、第三章水溶液中的离子反应与平衡_实验活动2强酸与强碱的中和滴定-教案docx等2份课件配套教学资源,其中PPT共39页, 欢迎下载使用。













