






高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡实验活动3 盐类水解的应用优质课ppt课件
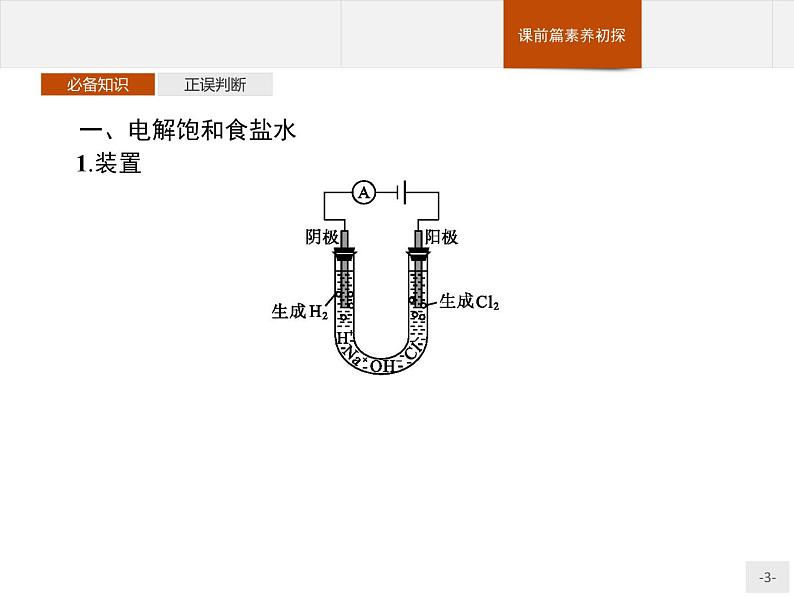
展开一、电解饱和食盐水1.装置
2.原理(1)电极反应:阳极:发生氧化反应,电极反应式为 。 阴极:发生还原反应,电极反应式为 。 (2)总反应式:化学方程式: 。 离子方程式: 。 【微思考1】能否说电解饱和食盐水(惰性电极)时阴极产物只有氢气?
2Cl--2e-==Cl2↑
2H2O+2e-==H2↑+2OH-
答案:不能,阴极产物是氢气和氢氧化钠。
二、电镀1.定义电镀是一种利用 原理在某些金属表面镀上一薄层其他 或 的加工工艺。 2.电镀原理(1)实例(往铁件上镀铜):①阴极材料: ,电极反应式: ; ②阳极材料: ,电极反应式: ; ③电解质溶液: 溶液。 (2)电镀的目的主要是增强金属的 能力,增加表面硬度和美观。
Cu2++2e-==Cu
Cu-2e-==Cu2+
CuSO4(合理即可)
三、电解精炼铜1.粗铜中往往含有铁、锌、银、金等多种杂质,常用电解的方法进行精炼。其电解池的构成是用 作阳极,用 作阴极,用 作电解质溶液。
3.电解精炼铜的原理是粗铜中的铜以及比铜 的金属Zn、Fe等失去电子,产生的阳离子进入溶液中,不比铜活泼的金属 等以金属单质的形式沉积在电解槽的底部,形成 ,溶液中Cu2+在纯铜上析出。 【微思考2】电镀铜和电解精炼铜时所用的电解质溶液中都含有Cu2+,通电一段时间后,电解质溶液中的c(Cu2+)分别如何变化?
答案:电镀铜时,c(Cu2+)基本不变;而电解精炼铜时,c(Cu2+)会减小。
四、电冶金1.金属冶炼的本质 使矿石中的金属离子 变成金属单质的过
2.电冶金电解是最强有力的氧化还原手段,适用于制取一些 单质,如冶炼钠、钙、镁、铝等活泼金属。 3.电解熔融的氯化钠阳极反应: ; 阴极反应: ; 总反应: 。
2Na++2e-==2Na
(1)电解熔融的氧化铝制取金属铝,用铁作阳极。 ( )(2)电解法精炼粗铜,用纯铜作阴极。 ( )(3)电解饱和食盐水制烧碱,用涂镍碳钢网作阴极。 ( )(4)在镀件上电镀锌,用锌作阳极。 ( )(5)从粗铜精炼所得阳极泥中可回收Ag、Au、Fe等金属。 ( )(6)铁器上镀铜所用电解质溶液为FeSO4溶液。 ( )
答案:(1)× (2)√ (3)√ (4)√ (5)× (6)×
电解原理的应用问题探究1.怎样判断一个装置是原电池还是电解池?2.粗铜中含有少量Fe、Zn、Au、Ag等杂质,通过粗铜精炼是怎样除去这些杂质的呢?
答案:有外加电源的一定为电解池,无外加电源的一般为原电池;多池组合时,一般含活泼金属的为原电池,其余都是原电池连接着的电解池。
答案:粗铜精炼是将粗铜作阳极,粗铜中的Cu、Fe、Zn等失去电子生成Cu2+、Fe2+、Zn2+进入溶液中,因Fe2+、Zn2+的氧化性弱于Cu2+不能在阴极析出,留在溶液中;Au、Ag等不如Cu活泼的金属,不能在阳极失去电子,从而以固体的形式沉到电解槽底部,形成阳极泥。
深化拓展电镀与电解精炼的比较
素能应用典例1以KCl和ZnCl2的混合溶液为电镀液在铁制品上镀锌,下列说法正确的是( )A.未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程B.因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系C.电镀时保持电流恒定,升高温度不改变电解反应速率D.工业上电解饱和食盐水制取Na和Cl2
答案:C 解析:未通电前题述装置不能构成原电池,A项错误;锌的析出量与通过的电量成正比,B项错误;电镀时电解反应速率只与电流大小有关,与温度无关,C项正确;工业上通过电解熔融NaCl制取Na和Cl2,D项错误。
电镀时,镀层金属离子浓度远高于其他阳离子浓度,因此一定是电镀液中的镀层金属离子得到电子变为金属单质在阴极析出,而不是其他阳离子。例如在铁片上镀锌时,阴极反应式为Zn2++2e-=Zn,而不是2H++2e-=H2↑。
变式训练1以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是( )A.溶液中Cu2+浓度保持不变B.粗铜接电源正极,发生还原反应C.溶液中Cu2+向阳极移动D.利用阳极泥可回收Ag、Pt、Au等金属
答案:D 解析:电解精炼时粗铜做阳极,发生氧化反应,精铜做阴极,发生还原反应。电解时,溶液中的阳离子向阴极移动,Cu2+在阴极上得电子。粗铜中的不活泼金属不能失电子,以阳极泥的形式沉积在阳极附近。
电解的有关计算问题探究将两个分别装有Na2SO4、CuCl2溶液的电解池串联在一起,均用惰性电极进行电解,电解一段时间后,试分析电极产物H2、O2、Cl2、Cu之间物质的量的关系。
答案:根据得失电子守恒及元素的化合价变化可得出电极产物物质的量的关系式:2H2~O2~2Cl2~2Cu~4e-,即H2、O2、Cl2、Cu的物质的量之比为2∶1∶2∶2。
深化拓展电化学的有关计算(1)计算的原则:①阳极还原剂失去的电子数=阴极氧化剂得到的电子数。②串联电路中通过各电极的电子总数相等。③电源输出的电子总数和电解池中转移的电子总数相等。(2)计算的方法:
(3)注意几个等量关系式:①当电流通过多个串联的电解池时,它们皆处于同一闭合电路中,所以同一时间内通过的电子的物质的量相等。②常见电化学计算的对应关系:
如电解过程中析出气体时,在同温、同压下析出各气体物质的量之比为n(H2)∶n(Cl2)∶n(O2)=1∶1∶0.5。总之,电解混合溶液时要注意电解的阶段性以及电极反应式和总反应式,知道电解产物与转移电子的物质的量之间的关系式是电化学计算的主要依据。
素能应用典例2如图所示,若电解5 min时,测得铜电极的质量增加2.16 g。
试回答:(1)电源中X极是 (填“正”或“负”)极。 (2)通电5 min时,B中共收集到224 mL(标准状况下)气体,溶液体积为200 mL(电解前后溶液的体积变化忽略不计),则通电前c(CuSO4)= 。 (3)若A中KCl溶液的体积也是200 mL,电解后溶液中仍有Cl-,则电解后溶液的pH为 。(KW=1.0×10-14)
答案:(1)负 (2)0. 025 ml·L-1 (3)13
解析:(1)铜极增重,说明银在铜极上析出,则铜极为阴极,X为负极。(2)C中铜极增重2.16 g,即析出0.02 ml Ag,线路中通过0.02 ml电子。由4e-~O2,可知B中产生的O2只有0. 005 ml,即112 mL。但B中共收集到224 mL气体,说明还有112 mL气体是H2,即Cu2+全部在阴极放电后,H+接着放电产生了112 mL H2,则通过0.01 ml电子时,Cu2+已完全被还原。由2e-~Cu,可知n(Cu2+)=0.005 ml,则
解答与电解有关的计算题的基本步骤(1)正确书写电极反应式(要特别注意阳极材料)。(2)当溶液中有多种离子共存时,先要根据离子放电顺序确定离子放电的先后。(3)根据得失电子守恒进行相关计算。
变式训练2有一电解装置如图所示。图中B装置中盛有1 L 2 ml·L-1 Na2SO4溶液,A装置中盛有1 L 2 ml·L-1 AgNO3溶液。通电后,湿润的淀粉KI试纸的C端变蓝色,电解一段时间后,试完成下列问题。
(1)A中发生反应的化学方程式为 。 (2)在B中观察到的现象是 。 (3)室温下,从电解开始到时间为t时,A、B装置中共收集到气体0.168 L(标准状况下),若电解过程中无其他副反应发生,且溶液体积变化忽略不计,则在t时,A中溶液的pH为 。
答案:(1)4AgNO3+2H2O 4Ag+O2↑+4HNO3 (2)石墨电极表面有气泡产生,铜电极周围溶液变成蓝色,一段时间后U形管下部有蓝色沉淀产生 (3)2
1.欲在金属表面镀银,应把镀件挂在电镀池的阴极。下列各组中,选用的阳极金属和电镀液均正确的是( )A.Ag和AgCl溶液B.Ag和AgNO3溶液C.Fe和AgNO3溶液D.Pt和Ag2SO4溶液
2.关于电解NaCl水溶液,下列叙述正确的是( )A.电解时在阳极得到氯气,在阴极得到金属钠B.若在阳极附近的溶液中滴入淀粉KI溶液, 溶液呈现蓝色C.若在阴极附近的溶液中滴入酚酞溶液, 溶液呈现无色D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈现中性
解析:电解NaCl溶液,阴极生成H2和NaOH,阳极生成Cl2。
3.(双选)下列关于铜电极的叙述中,正确的是( )A.铜锌原电池中铜是正极B.用电解法精炼粗铜时粗铜作阴极C.在镀件上电镀铜时金属铜作阳极D.电解稀硫酸制H2、O2时铜作阳极
答案:AC 解析:铜锌原电池中,铜不如锌活泼,铜应为正极,A项正确;电解池的阳极发生失去电子的氧化反应,阴极发生得到电子的还原反应,所以精炼粗铜时,粗铜应作为阳极,镀铜时铜也应作为阳极以提供Cu2+,B项错误,C项正确;而电解稀硫酸时,如把铜作为阳极,铜会首先放电,阳极就不能产生氧气,D项错误。
4.利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述正确的是( )A.电解时以精铜作阳极B.电解时阴极发生氧化反应C.粗铜连接电源负极,其电极反应是Cu-2e-=Cu2+D.电解后,电解槽底部会形成含少量Ag、Pt等金属的阳极泥
答案:D 解析:电解时粗铜作阳极,与电源正极相连,失电子发生氧化反应;精铜作阴极,与电源负极相连,得电子发生还原反应,A、B、C错误。因为在金属活动性顺序中,Ag、Pt排在Cu的后面,所以电解时,Ag、Pt不会失电子,D正确。
5.下图为相互串联的甲、乙两个电解池,甲池利用电解原理在铁上镀银,试回答:
(1)A是 、 (填电极材料和电极名称),电极反应式是 ;B是 、 (填电极材料和电极名称),电极反应式是 ,应选用的电解质溶液是 。
(2)乙池中若滴入少量酚酞溶液,开始电解一段时间,铁极附近呈 色;C极附近呈 色。 (3)若甲池阴极增重43.2 g,则乙池中阳极上放出的气体在标准状况下的体积是 mL。 若电解后乙池中剩余溶液仍为400 mL,则所得NaOH溶液的物质的量浓度为 。
高中人教版 (2019)第二节 电解池示范课课件ppt: 这是一份高中人教版 (2019)第二节 电解池示范课课件ppt,共20页。PPT课件主要包含了总反应,阳极室,阴极室,阳离子交换膜,精制饱和NaCl溶液,电解饱和食盐水,学习任务一氯碱工业,铜不断溶解,铁上附上一层铜,思考与讨论等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修1第二单元 化学能与电能的转化示范课课件ppt: 这是一份高中化学苏教版 (2019)选择性必修1第二单元 化学能与电能的转化示范课课件ppt,共18页。PPT课件主要包含了巩固旧知,氯碱工业,阳离子交换膜电解槽,学以致用,硫酸铜浓度不变,3电镀池结构,①阴极-待镀金属,②阳极-镀层金属,4电镀的特点,铜的电解精炼等内容,欢迎下载使用。
人教版 (2019)选择性必修1第二节 电解池获奖习题课件ppt: 这是一份人教版 (2019)选择性必修1第二节 电解池获奖习题课件ppt,文件包含42第2课时电解原理的应用课件新教材人教版2019高中化学选择性必修一共32张PPTpptx、42第2课时电解原理的应用课后习题新教材人教版2019高中化学选择性必修一docx等2份课件配套教学资源,其中PPT共32页, 欢迎下载使用。













