





高中化学人教版 (2019)必修 第一册第二节 离子反应精品课件ppt
展开1.教材结合生活常识(给电器设备通电时,湿手操作容易发生触电事故)创设情境,以真实、有意义的问题来激发学生的学习兴趣,引发学生思考。然后以实验1-2为基础介绍电解质和电离的概念。需要说明的是,实验1-2的设计目的有3个∶①认识物质的导电性,②引人电解质的概念,③为学习电离的概念提供实验证据。2.教材基于实验证据提出问题∶为什么NaCl、KNO3,等电解质,在干燥时不导电,而溶于水或熔化后却能导电呢?随后,教材结合构成NaCI固体的粒子、NaCI固体在水中溶解和形成水合离子的过程,以及NaCl固体受热熔化时粒子运动的变化等,从微观角度对上述问题作出解释。为了帮助学生深入理解,教材辅以相应的微观过程示意图(图1-10、图1-11、图1-12)。在此基础上,介绍电离的概念和电离方程式,并结合电离方程式,引导学生从电离的角度认识酸、碱的本质。
通过实验、假设、推理等过程,以探究的方式建构电离模型,并以此认识电解质;能用电离方程式表示某些酸、碱、盐的电离过程。
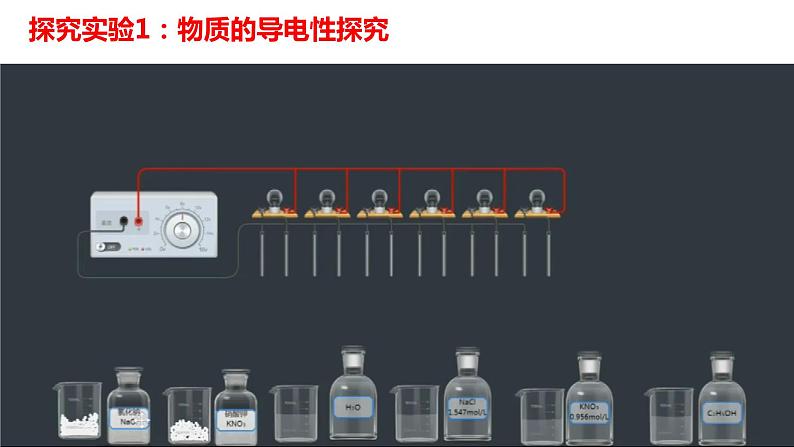
探究实验1:物质的导电性探究
装氯化钠、硝酸钾固体、水、乙醇溶液的灯泡不亮;装氯化钠溶液、硝酸钾溶液的灯泡变亮
硝酸钾固体、氯化钠固体、蒸馏水、乙醇溶液均不导电;氯化钠溶液、硝酸钾溶液能导电
注意:严格的说蒸馏水也能导电,但是其导电能力很微弱,用上述的实验装置无法测出。(蒸馏水几乎不导电)
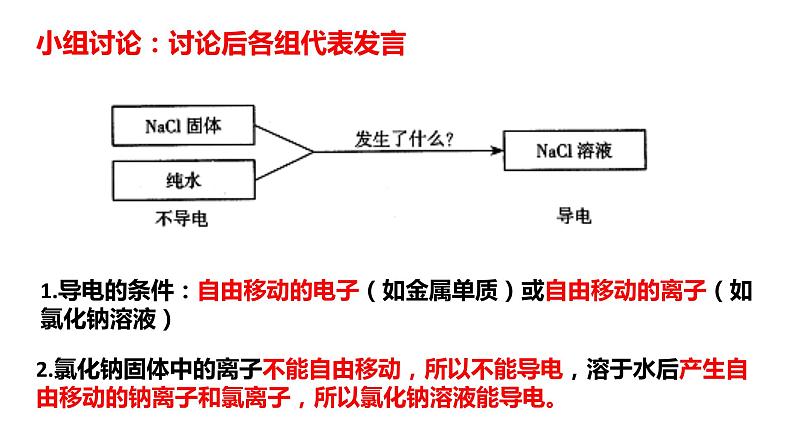
小组讨论:讨论后各组代表发言
1.导电的条件:自由移动的电子(如金属单质)或自由移动的离子(如氯化钠溶液)
2.氯化钠固体中的离子不能自由移动,所以不能导电,溶于水后产生自由移动的钠离子和氯离子,所以氯化钠溶液能导电。
实验结论:熔融硝酸钾是导电的
探究实验2:熔融硝酸钾导电性实验
小组讨论:产生自由移动离子的条件
硝酸钾固体:由离子组成,但是离子不能自由移动(不导电)
硝酸钾溶液:在水分子的作用下硝酸根和钾离子能自由移动(导电)
熔融硝酸钾:熔融状态下硝酸根和钾离子能自由移动(导电)
乙醇溶液:乙醇在水分子的作用下不能产生自由离子(不导电)
硫酸溶液:硫酸分子在水分子的作用下产生自由离子(导电)
液态硫酸:液态的硫酸分子不能产生自由离子(不导电)
溶于水和熔融状态下都不导电的化合物
在水溶液里或熔融状态下能导电的化合物
酸、碱、盐、水、活泼金属、氧化物
非金属氧化物、大多数的有机物
知识拓展:电解质导电的条件
结论:由离子组成的电解质溶于水或者在熔融状态下都能导电(如氯化钠等);由分子组成的电解质只有在水溶液中才能导电(如硫酸等)
练习1、下列物质中:①氢氧化钠固体,②铜,③氢氧化钠溶液,④稀硫酸,⑤熔融的碳酸钾,⑥硫酸钡,⑦蔗糖溶液,⑧二氧化碳,⑨氯化氢气体,⑩乙醇。属于电解质的是 。属于非电解质的是 。能导电的是 。
练习2、下列说法中,正确的是( )A.液态HCl、固态NaCl均不导电,所以HCl、NaCl均不是电解质B.NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质C.蔗糖、酒精在水溶液里或熔融状态时均不导电,所以它们是非电解质D.铜、石墨均导电,所以它们是电解质
进行电解质判断时应该注意什么呢?
注意:(1)电解质首先必须是化合物,单质和混合物既不是电解质也不是非电解质;(2)一个化合物不是电解质就一定是非电解质;(3)某些非电解质溶于水时与水反应生成电解质从而使溶液导电,但是该化合物依然是非电解质(例如:CO2)
电解质导电的条件其实就是电解质发生电离的条件
氯化钠固体离子不能移动
如果离子能移动,氯化钠就不会是固体状态了
电解质在溶于水或受热熔化时,形成自由移动的离子的过程。
水分子与氯化钠固体作用
氯化钠固体溶解并形成水合离子
电解质溶于水时,受到水分子的作用,解离为可以移动的水合离子
由离子组成的电解质熔融时,克服离子间的束缚力,解离为可以移动的离子
如:NaCl = Na+ + Cl-
为了简便起见,一般仍然用离子符号表示水合离子。
注意:1、在水中电离一般不写条件,若在熔融状态必须注明。2、拆分要准确(原子团不可拆分)。3、原子个数守恒,电荷守恒。
【练一练】请学生们按照上面的例子,尝试书写以下物质的电离方程式,并将结果进行交流讨论。 KNO3 HNO3 BaCl2 HCl NaOH H2SO4
KNO3 = K+ + NO3- HNO3 = H+ + NO3 - BaCl2 = Ba2+ + 2Cl- HCl = H+ + Cl- NaOH = Na+ + OH- H2SO4 = 2H+ + SO42-
书写时应该注意什么呢?
HNO3 = H+ + NO3- HCl = H+ + Cl- H2SO4 = 2H+ + SO42-
酸:电离时生成的阳离子全部是氢离子的化合物。
练习:已知HClO4是一种酸,则其溶于水完全电离生成的离子是 和 。
【练一练】书写以下物质的电离方程式,并根据其分类,总结碱和盐的本质。 NaOH KOH Ba(OH)2 Ca(OH)2 (NH4)2SO4 Ba(NO3)2 Na2CO3 Al2(SO4)3
NaOH = Na+ + OH- (NH4)2SO4 = 2NH4+ + SO42- KOH = K+ + OH- Ba(NO3)2 = Ba2+ + 2NO3- Ba(OH)2 = Ba2+ + 2OH- Na2CO3 = 2Na+ + CO32- Ca(OH)2 = Ca2+ + 2OH- Al2(SO4)3 = 2Al3+ + 3SO42-
碱:电离时生成的阴离子全部是氢氧根离子的化合物。盐:电离时生成金属阳离子(或者铵根离子)和酸根的化合物。
知识拓展:特殊电离方程式书写
1.分别写出NaHSO4在水溶中和熔融状态下的电离方程式
2.写出NaHCO3和NaHSO4在水溶中的电离方程式
水溶液中:NaHSO4 = Na++H++SO42-
熔融状态:NaHSO4 (熔融) = Na++HSO4-
NaHCO3 = Na++HCO3-
NaHSO4 = Na++H++SO42-
人教版 (2019)必修 第一册第一章 物质及其变化第一节 物质的分类及转化教学ppt课件: 这是一份人教版 (2019)必修 第一册第一章 物质及其变化第一节 物质的分类及转化教学ppt课件,共30页。PPT课件主要包含了学习目标,金属导电是因为等内容,欢迎下载使用。
人教版 (2019)必修 第一册第二节 离子反应备课ppt课件: 这是一份人教版 (2019)必修 第一册第二节 离子反应备课ppt课件,文件包含121电解质的电离分层作业解析版-上好课2022-2023学年高一化学同步备课系列人教版2019必修第一册docx、121电解质的电离分层作业原卷版-上好课2022-2023学年高一化学同步备课系列人教版2019必修第一册docx、121电解质的电离课件高一化学同步备课系列人教版2019必修第一册pptx等3份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
化学必修 第一册第二节 离子反应课文配套课件ppt: 这是一份化学必修 第一册第二节 离子反应课文配套课件ppt,共21页。PPT课件主要包含了电解质和非电解质,归纳总结,电离方程式书写,练习+合作交流,从电离角度理解酸碱盐,酸的电离,碱的电离,盐的电离等内容,欢迎下载使用。













