




高中人教版 (2019)第三节 氧化还原反应优秀课件ppt
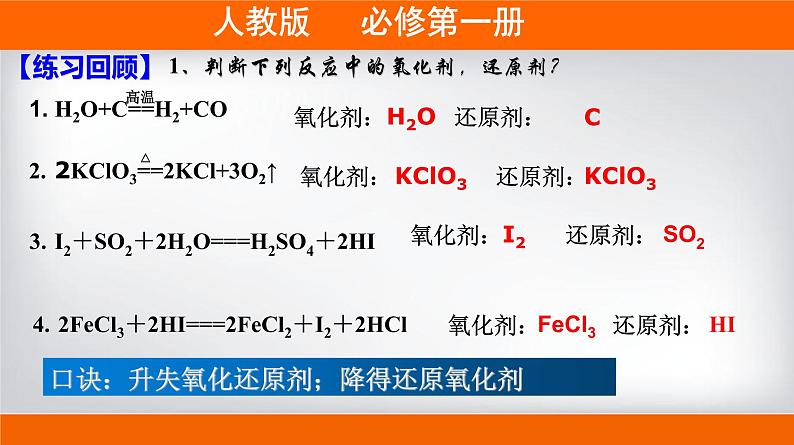
展开4. 2FeCl3+2HI===2FeCl2+I2+2HCl
1. H2O+C==H2+CO
2. 2KClO3==2KCl+3O2↑
3. I2+SO2+2H2O===H2SO4+2HI
1、判断下列反应中的氧化剂,还原剂?
口诀:升失氧化还原剂;降得还原氧化剂
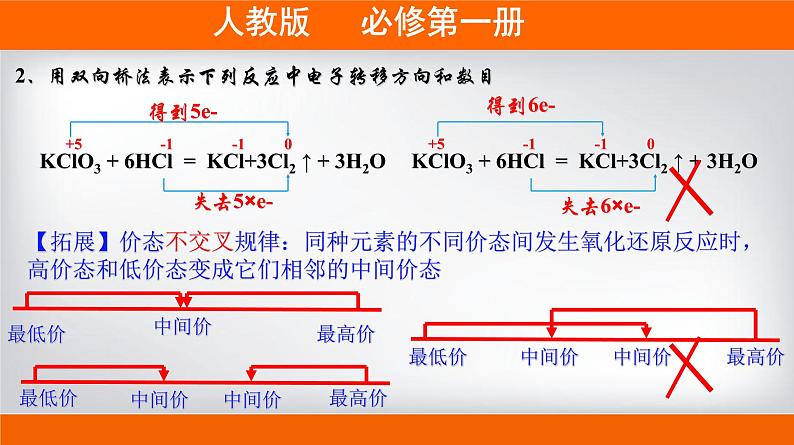
2、用双向桥法表示下列反应中电子转移方向和数目
KClO3 + 6HCl = KCl+3Cl2 ↑ + 3H2O
+5 -1 -1 0
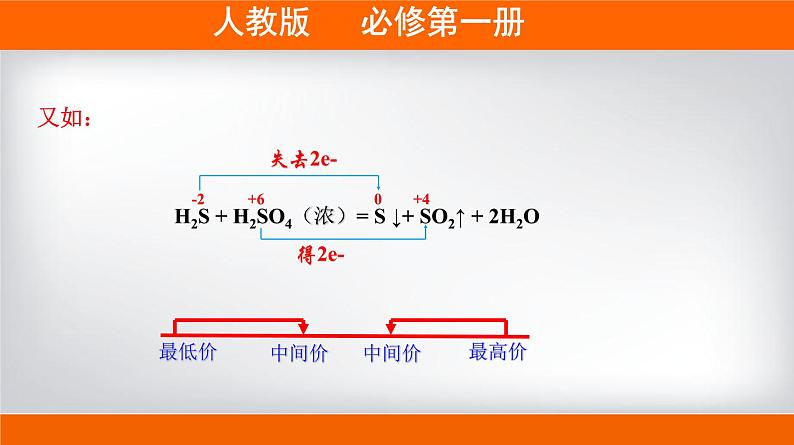
【拓展】价态不交叉规律:同种元素的不同价态间发生氧化还原反应时,高价态和低价态变成它们相邻的中间价态
H2S + H2SO4(浓)= S ↓+ SO2↑ + 2H2O
-2 +6 0 +4
生活中常用ClO2、KMnO4、O3、H2O2物质能杀菌消毒,利用它们的什么性质?
氧化性:物质得电子性质,氧化剂具有氧化性。
还原性:物质失电子性质,还原剂具有还原性。
【学习任务一】物质的氧化性和还原性
【概念辨析】物质得失电子数目越多,物质的氧化性、还原性就越强
物质氧化性或还原性的强弱取决于其得失电子的难易程度,与得失电子的多少无关。
物质得电子越容易氧化性越强;失电子越容易还原性越强
3.元素处于中间价态,则既有氧化性又有还原性
2.元素处于低价态具有还原性,最低价态,则只具有还原性
元素处于高价态具有氧化性,最高价态,则只具有氧化性
宏观辨识——根据元素的化合价进行判断
下列物质只具有氧化性的是( );只具有还原性的是( );即具有氧化性又具有还原性的是( )。
A. HCl B. Cu2+ C. Cl2 D. I- E. F2
2、物质氧化性、还原性判断
【实验探究1】生活中常用到双氧水(H2O2溶液)杀菌消毒,是利用了过氧化氢的强氧化性,请你设计实验方案证明过氧化氢具有氧化性吗?
(可选择的实验试剂:H2O2溶液、酸性KMnO4溶液,稀硫酸,NaOH溶液,淀粉KI溶液。)
分析:KMnO4是常见的氧化剂,KI中碘元素处于最低价,具有比较强的还原性
氧化剂 + 还原剂 = 还原产物 + 氧化产物
实验方案:向试管中加入2mL淀粉KI溶液,再滴加5滴H2O2溶液,观察实验现象。
实验中H2O2体现氧化性,把KI氧化,产生I2,遇淀粉显蓝色
(可选择的实验试剂:H2O2溶液、酸性KMnO4溶液,稀硫酸,NaOH溶液,淀粉KI溶液)
【实验探究2】从价态上分析,过氧化氢中氧元素处于中间价态,除了体现出氧化性,还能体现出一定的还原性,请你设计实验方案证明过氧化氢具有还原性?
(可选择的实验试剂:H2O2溶液、酸性KMnO4溶液,氢硫酸(H2S溶液),盐酸,氢氧化钠溶液,淀粉KI溶液)
实验方案:向试管中加入2mL酸性高锰酸钾溶液,再滴加5滴H2O2溶液,观察实验现象。
试管中有气泡产生,溶液紫红色褪去
实验中H2O2体现还原性,被酸性KMnO4溶液氧化,产生O2,KMnO4被还原,紫红色褪去。
1、人体正常的血红蛋白中应含有Fe2+。若误食亚硝酸钠,则导致血红蛋白中Fe2+转化为高铁血红蛋白而中毒。服用维生素C可解除亚硝酸钠中毒。下列叙述中正确的是( )A、亚硝酸钠表现还原性B、维生素C表现了还原性C、亚硝酸钠被氧化D、维生素C作为氧化剂
2.关于物质氧化性及还原性的强弱,下列说法中正确的是( )A.物质越易失电子,还原性越强B.原子失电子越多,还原性越强C.元素化合价降低越多,氧化性越强D.物质越易被氧化,氧化性越强
3、物质氧化性与还原性的强弱比较
(1) 根据反应方程式来比较:
在氧化还原反应中:氧化剂具有较强的氧化性,还原剂具有较强的还原性;氧化产物具有较弱的氧化性,还原产物具有较弱的还原性。
【实验探究3】已知Cu2+、Fe2+具有一定的氧化性,你能设计实验方案并进行相关实验比较两者的氧化性强弱吗?
氧化剂 +还原剂 = 还原产物+氧化产物
实验方案:向硫酸铜溶液中加入铁屑。
Cu2+ + Fe = Cu + Fe2+
根据氧化还原方程式判断
氧化性:Cu2+>Fe2+
实验现象:有红色固体产生
(可选择的实验试剂:Cu片,铁屑,CuSO4溶液、FeSO4溶液,FeCl3溶液)
(2) 根据金属活动顺序:
3、根据下列反应判断H2SO3 、 I- 、 Fe2+ 、 NO的还原性由强到弱的顺序是 。 H2SO3 + I2 + H2O = 2HI + H2SO4 2FeCl3 + 2HI = 2FeCl2 + 2HCl + I2 3FeCl2 + 4HNO3 = 2FeCl3 + NO↑ + 2H2O + Fe(NO3)3
H2SO3 > I- > Fe2+ > NO
(H2SO3 > I-)
( I- > Fe2+ )
(Fe2+ > NO)
点拨:标化合价,明确变价元素,找出还原剂和还原产物,比较还原性
4、已知三个氧化还原反应:①2FeCl3+2KI=2FeCl2+2KCl+I2,②2FeCl2+Cl2=2FeCl3,③2KMnO4+16HCl(浓)= 2KCl+2MnCl2+8H2O+5Cl2↑。若某溶液中有Fe2+、I-、Cl-共存,要将I-氧化除去而不氧化Fe2+和Cl-,则可加入的试剂是( )A.Cl2B.KMnO4 C.FeCl3 D.HCl
+2 +2 +4 0
【学习任务二】氧化还原反应方程式配平
NO + NH3 —— N2 + H2O
各物质系数×2化为整数
化学方程式的系数应为整数
+4 -1 +2 -1 0
注意有一部分氯元素价态不变
该反应中,HCl前面系数应为:变价的氯原子数+没有变价的氯原子数
Cl2 + KOH —— KClO3 + KCl + H2O
0 +5 -1
拓展运用:被氧化的氯原子数和被还原的氯原子数之比为_________。
练习:根据化合价升降数目相等配平下列方程式(1)Fe2(SO4)3+ H2O+ SO2——FeSO4+H2SO4(2)KMnO4+HCl(浓)——KCl+MnCl2+Cl2↑+H2O
人教版 (2019)必修 第一册第三节 氧化还原反应课前预习ppt课件: 这是一份人教版 (2019)必修 第一册第三节 氧化还原反应课前预习ppt课件,共15页。PPT课件主要包含了学习目标,氧化剂,还原剂,还原产物,氧化产物,价态规律,既有氧化性也有还原,补充说明,1高低规律,2归中律等内容,欢迎下载使用。
人教版 (2019)必修 第一册第三节 氧化还原反应备课ppt课件: 这是一份人教版 (2019)必修 第一册第三节 氧化还原反应备课ppt课件,共1页。
高中化学人教版 (2019)必修 第一册第三节 氧化还原反应备课课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第三节 氧化还原反应备课课件ppt,文件包含133氧化还原反应的应用课件高一化学同步备课系列人教版2019必修第一册pptx、133氧化还原反应的应用分层作业解析版-上好课2022-2023学年高一化学同步备课系列人教版2019必修第一册docx、133氧化还原反应的应用分层作业原卷版-上好课2022-2023学年高一化学同步备课系列人教版2019必修第一册docx等3份课件配套教学资源,其中PPT共30页, 欢迎下载使用。













