






高中化学人教版 (2019)选择性必修1第一节 反应热优质课件ppt
展开化学反应的过程,既是物质的转化过程,也是化学能与热、电等其他形式能量的转化过程。
化学反应既遵守质量守恒定律,也遵守能量守恒定律。
化学反应中的能量变化是以物质变化为基础的,能量变化的多少与参加反应的物质种类和多少密切相关。
问题一:以上反应中伴随着怎样的能量变化?问题二:如何实现石灰石的分解?能量如何变化?
热量的释放或吸收是化学反应中能量变化的常见形式。
在实际应用中,人们如何定量地描述化学反应过程中释放或吸收的热量呢?
一、反应热 焓变
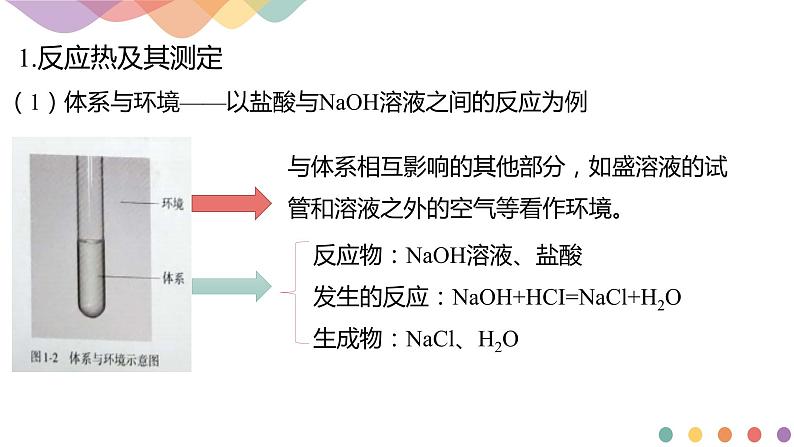
(1)体系与环境——以盐酸与NaOH溶液之间的反应为例
与体系相互影响的其他部分,如盛溶液的试管和溶液之外的空气等看作环境。
反应物:NaOH溶液、盐酸发生的反应:NaOH+HCI=NaCl+H2O生成物:NaCl、H2O
某试管中盛有Al粉和稀盐酸,下列有关说法不正确的是 ( )A.试管、Al粉、稀盐酸及发生的反应可看作一个体系B.除反应物、生成物及相关反应外,其他均看作环境C.Al与稀盐酸反应导致体系温度升高,且向环境中释放热量D.Al与稀盐酸反应的反应热可以通过量热计测量
①热量:因温度不同而在体系与环境之间交换或传递的能量。
(2)体系与环境的热量交换——反应热
②反应热:在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热。
指化学反应发生后,使反应后体系的温度恢复到反应前体系的温度,即反应前后体系的温度相同。
③直接测定反应热的方法
用温度计测量反应前后体系的温度变化,根据有关物质的比热容等来计算反应热
【实验目的】用简易量热计测量盐酸与NaOH溶液反应前后的温度。
使反应物迅速混合,使反应充分进行,保持体系的温度均匀。
测量反应前后体系的温度
【实验测量】(1)反应物温度的测量①用量筒量取50mL0.50ml/L盐酸,打开杯盖,倒入量热计的内筒中,盖上杯盖,插入温度计,测量并记录盐酸的温度(数据填入下表)。用水把温度计上的酸冲洗干净,擦干备用。②用另一个量简量取50mL0.55ml/L.NaOH溶液,用温度计测量并记录NaOH溶液的温度(数据填入下表)。
(2)反应后体系温度的测量打开杯盖,将量筒中的NaOH溶液迅速倒入量热计的内简中,立即盖上杯盖,插入温度计,用搅拌器匀速搅拌。密切关注温度变化,将最高温度记为反应后体系的温度(t2)。(3)重复上述步骤(l)至步骤(2)两次。
思考问题一:能否更换温度计?
思考问题二:能否测完酸后直接测量碱的温度?
不能,残留的酸与碱反应,造成酸碱消耗,热量损失
思考问题三:为什么碱的浓度稍大于酸?
为了保证盐酸完全被中和
【数据处理(1)取盐酸温度和NaOH溶液温度的平均值记为反应前体系的温度(t1),计算温度差(t2-t1),将数据填入下表。(2)取三次测量所得温度差的平均值作为计算依据。(3)根据温度差和比热容等计算反应热。为了计算简便,可以近似地认为实验所用酸、碱稀溶液的密度、比热容与水的相同,并忽略量热计的比热容,则:①50mL0.50ml/L盐酸的质量m1=50g,50mL0.55ml/LNaOH溶液的质量m2=50g。②反应后生成的溶液的比热容c=4.18J/(g·℃),50mL0.50ml/L盐酸与50ml0.55ml/LNaOH溶液发生中和反应时放出的热量为(m1+m2)·c·(t2-t1)。③生成lmlH2O(l)时放出的热量为
【问题和讨论】(l)导致中和反应反应热测定存在误差的原因①量取溶液的体积不准确。②温度计读数有误(如未读取到混合溶液的最高温度,就记为终止温度)。③实验过程中有液体溅出。④混合酸、碱溶液时,动作缓慢。⑤隔热层隔热效果不好,实验过程中有热量损失。⑥测过酸溶液的温度计未用水清洗便立即去测碱溶液的温度。⑦溶液浓度不准确。⑧没有进行重复实验。
(2)提高测定反应热准确度的措施①实验中用温度计先后测量酸溶液、碱溶液及混合溶液的温度时,使用同一支温度计可减小实验误差,且测量完一种溶液后,温度计必须用水冲洗干净并用滤纸擦干。温度计的水银球要完全浸入溶液中,且要稳定一段时间后再记下读数。②反应物应一次性迅速加入,且避免有液体溅出。③实验操作时动作要快,尽量减少热量的损失。④重复实验3次,取3次实验数据的平均值。
下列有关中和反应反应热测定实验的说法正确的是( )A.温度计能代替玻璃搅拌器,用于搅拌反应物B.强酸与强碱反应生成1mlH2O(l)释放的热量都约为57.3kJ C.测定中和反应反应热实验中,读取混合溶液不再变化的温度为终止温度D.某同学通过实验测得盐酸和NaOH溶液反应生成lmlH2O(1)放出的热量为52.3kJ,造成这一结果的原因不可能是所用酸、碱溶液浓度过大
2、反应热与焓变(1)内能:内能是体系内物质的各种能量的总和,受温度、压强和物质的聚集状态等影响。化学反应之所以会产生反应热是因为化学反应前后体系的内能(符号为U)发生了变化。(2)焓:焓是物质所具有的能量,是与内能有关的物理量,符号是H。(3)焓变:在等压条件下进行的化学反应,其反应热等于反应的焓变。对于一个化学反应,生成物的总焓与反应物的总焓之差称为焓变,符号是AH。①数学表达式:△H=H(生成物)-H(反应物)。②常用单位:kJ/ml(或kJ·ml-1)。
(4)焓、焓变与放热反应、吸热反应的关系
反应体系对环境放热,其焓减小
△H为“-”,即△H<0,
反应体系从环境吸热,其焓增加
△H为“+”,即△H>0,
下列说法正确的是( )A.反应热是1ml物质参加反应时的能量变化B.当反应放热时△H>0,反应吸热时△H<0C.任何条件下,化学反应的焓变都等于化学反应的反应热D.在一定条件下,某一化学反应是吸热反应还是放热反应,由生成物与反应物的焓值差决定
(5)化学反应过程中能量变化的原因①微观角度a.化学反应的本质及特点
b.举例[以1mlH2(g)和1ml Cl2(g)在一定条件下反应生成2mlHCI(g)的能量转化为例]
1mlH2与1mlCl2反应生成2mlHCl时的反应热,应等于生成物分子的化学键形成时所释放的总能量(862kJ)与反应物分子的化学键断裂时所吸收的总能量(436kJ+243kJ=679kJ)的差,即放出183kJ的能量。
上述分析表明,化学键断裂和形成时的能量变化是化学反应中能量变化的主要原因。
②宏观角度从物质内能角度分析,若化学反应中反应物的总能量大于生成物的总能量,反应物转化为生成物时放出热量,则为放热反应。
(6) △H的计算方法①△H=生成物的总能量-反应物的总能量。②△H=反应物分子的化学键断裂时吸收的总能量-生成物分子的化学键形成时释放的总能量。
已知断裂1mlN=N键所吸收的能量为946kJ,形成1ml N-H键所放出的能量为391kJ,若1ml N2(g)和3mlH2(g)完全反应生成2ml NH3(g)时放出的能量为92.2kJ,则断裂1ml H-H键所吸收的能量是( )A.436kJ C.463kJ D.869kJ
已知:H2(g)+F₂(g)=2HF(g) △H=-270kJ·ml-1,下列说法正确的是( )A.在相同条件下,1mlH2(g)与1mlF2(g)的能量总和大于2ml HF(g)的能量B.1ml H2(g)与1mlF2(g)反应生成2ml液态HF放出的热量小于270kJC.该反应的逆反应是放热反应D.该反应过程的能量变化可用右图表示
高中化学人教版 (2019)选择性必修1第一节 反应热课前预习课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第一节 反应热课前预习课件ppt,共35页。PPT课件主要包含了学习目标,课前导入,知识点一,反应热及其测定,体系与环境之间,1定义,2分类,敞开体系系统,封闭体系系统,孤立体系系统等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第一章 化学反应的热效应第一节 反应热多媒体教学ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第一章 化学反应的热效应第一节 反应热多媒体教学ppt课件,共32页。PPT课件主要包含了放热反应,吸热反应,反应热,中和热的定义,012kJ,3kJ,为什么误差这么大,反应热与焓变,反应热的实质等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第一节 反应热完美版ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第一节 反应热完美版ppt课件,文件包含新人教版化学选择性必修一111反应热焓变课件pptx、新人教版化学选择性必修一111反应热焓变针对练习含解析docx、新人教版化学选择性必修一111反应热焓变教案doc等3份课件配套教学资源,其中PPT共36页, 欢迎下载使用。













