





人教版 (2019)必修 第一册第一节 钠及其化合物公开课课件ppt
展开比如说,Na、Na2O2
有一些火灾现场不能用水灭火,为什么?
向 包有少量淡黄色粉末( Na2O2 )的脱脂棉 上滴几滴水,观察实验现象。实验现象:脱脂棉着火思考:为什么会出现这种现象?
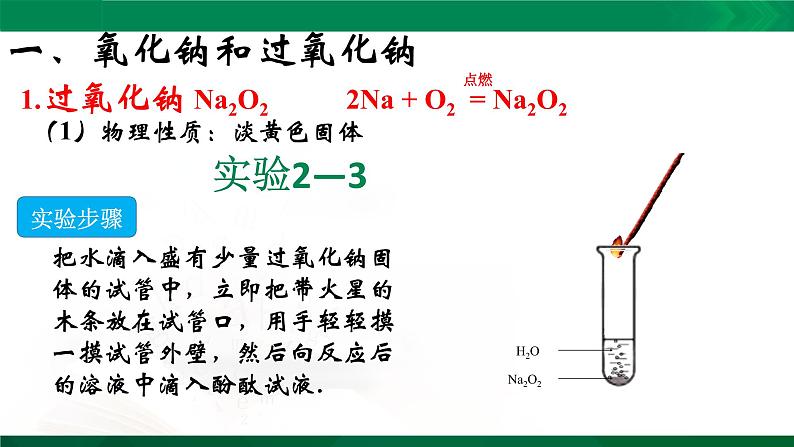
1.过氧化钠 Na2O2 2Na + O2 = Na2O2
(1)物理性质:淡黄色固体
把水滴入盛有少量过氧化钠固体的试管中,立即把带火星的木条放在试管口,用手轻轻摸一摸试管外壁,然后向反应后的溶液中滴入酚酞试液.
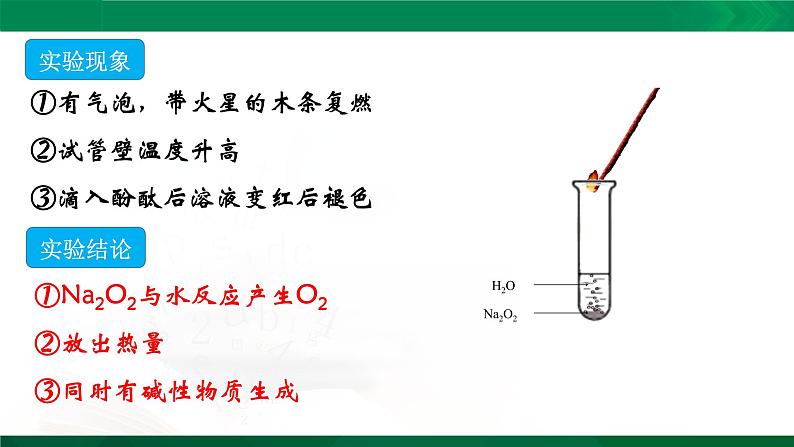
①有气泡,带火星的木条复燃②试管壁温度升高③滴入酚酞后溶液变红后褪色
①Na2O2与水反应产生O2②放出热量③同时有碱性物质生成
(2)化学性质: ①与水反应: 2Na2O2+2H2O=4NaOH+O2↑ Na2O2既是氧化剂又是还原剂离子方程式:2Na2O2+2H2O=4Na+ + 4OH- +O2↑ ② 与CO2的反应: 2Na2O2+2CO2=Na2CO3+O2 ③与酸反应: 2Na2O2+4HCl=4NaCl+O2↑+ 2H2O 实质:先和水反应,NaOH再和酸反应 Na2O2不是碱性氧化物
(3)应用:供氧剂、漂白剂
2、氧化钠 Na2O(1)物理性质:白色固体(2)化学性质:
4Na + O2 = 2 Na2O
①与水反应:Na2O + H2O = 2 NaOH
③与酸反应: Na2O + 2HCl = 2 NaCl + H2O
②与CO2反应:Na2O + CO2 = Na2CO3
Na2O+H2O=2NaOH
2Na2O2 + 2CO2 = 2Na2CO3 + O2
Na 2O+CO 2=Na 2CO 3
Na2O+2HCl=2NaCl+H2O
Na2O < Na2O2
碳酸钠和碳酸氢钠的性质
加水部分溶解;感受不到热量变化
Na2CO3比NaHCO3易溶于水, 溶液碱性Na2CO3比NaHCO3溶液强。
Na2CO3和NaHCO3的热稳定性
烧杯A无变化,烧杯B中溶液变浑浊
Na2CO3和NaHCO3与稀盐酸的反应
NaHCO3反应更剧烈,产生的气体多。
Na2CO3+2HCl =2NaCl+H2O CO2↑
HCO3- + H+ = H2O + CO2 ↑
CO32- + 2H+ = H2O + CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑
碳酸钠和碳酸氢钠都易与酸反应,碳酸氢钠与酸反应比碳酸钠更剧烈。
思考:怎样鉴别碳酸钠和碳酸氢钠?
⑴ 加热固体。产生能使石灰水变浑浊的无色气体的是NaHCO3 。
(2) 在固体中加入相同浓度的盐酸,反应剧烈的是NaHCO3 。
4.与碱Ca(OH)2反应
a.Na2CO3和Ca(OH)2反应:
b.NaHCO3和Ca(OH)2反应:
练习: 写出碳酸氢钠溶液与氢氧化钙溶液反应的化学方程式。
2NaHCO3 + Ca(OH)2 = CaCO3 +Na2CO3 + 2H2O
若Ca(OH)2过量,则过量的Ca(OH)2 会与生成物Na2CO3反应
NaHCO3 + Ca(OH)2 = CaCO3 + NaOH + H2O
2、 Ca(OH)2足量
思考:碳酸钠和碳酸氢钠的相互转变
1、2NaHCO3 = Na2CO3 + H2O + CO2
3、Na2CO3 + CO2 + H2O = 2NaHCO3
2、NaHCO3 + NaOH = Na2CO3 + H2O
思考:往饱和的碳酸钠溶液中通入过量的二氧化碳,有何现象?为什么?
Na2CO3 + H2O + CO2 = 2NaHCO3
反应后,溶质质量增大,
碳酸氢钠从饱和溶液中结晶析出
Na2CO3>NaHCO3
CO32-+2H+=H2O+CO2↑
HCO3-+H+=H2O+CO2↑
碳酸钠与碳酸氢钠的比较
思考: Na2CO3和NaHCO3混合物如何杂?
(2)Na2CO3溶液中混有NaHCO3,
NaHCO3 + NaOH = Na2CO3 + H2O
(3)NaHCO3溶液中混有Na2CO3,
Na2CO3 + CO2 + H2O = 2NaHCO3
(l)Na2CO3固体粉末中混有NaHCO3,
碳酸钠和碳酸氢钠的用途
某些金属或它们的化合物在灼烧时都会使火焰呈现出特殊的颜色这在化学上叫做焰色反应
焰色反应是金属元素(可以是金属原子也可以是金属离子)自身具有的性质,是物理变化。
一些金属及化合物的焰色反应
实验步骤:①将焊在玻璃棒上的铂丝(或光洁无锈的铁丝)放在火焰上灼烧,直到与原来火焰颜色相同时为止。②用铂丝蘸取Na2CO3溶液,在火焰上灼烧,观察火焰颜色③用盐酸洗净铂丝(或铁丝),在火焰上灼烧到无色时,再蘸取K2CO3溶液,放到火焰上灼烧,通过蓝色钴玻璃观察火焰颜色。
钠元素的焰色反应呈黄色,钾元素的焰色反应为紫色(透过蓝色钴玻璃观察)。
洗 烧 蘸 烧 看 洗
注意: ①做焰色反应前,要先将金属丝用盐酸洗净,而不能用硫酸.
②在观察钾的焰色反应时,必须透过蓝色钴玻璃观察,否则观察到黄色火焰。
③焰色反应用来鉴别物质,这种鉴别方法属于物理变化,不属于化学变化
人教版 (2019)第一节 钠及其化合物课文ppt课件: 这是一份人教版 (2019)第一节 钠及其化合物课文ppt课件,共1页。
人教版 (2019)必修 第一册第一节 钠及其化合物教课内容课件ppt: 这是一份人教版 (2019)必修 第一册第一节 钠及其化合物教课内容课件ppt,共22页。PPT课件主要包含了带火星的木条,用pH试纸检验,触摸外壁,振荡后褪色,显碱性,Na2O,Na2O2,白色固体,淡黄色固体,不褪色等内容,欢迎下载使用。
人教版 (2019)必修 第一册第一节 钠及其化合物背景图免费课件ppt: 这是一份人教版 (2019)必修 第一册第一节 钠及其化合物背景图免费课件ppt,共60页。PPT课件主要包含了结块变成晶体,NaCl,蓝色钴玻璃,Na2O2,Na2CO3,NaHCO3等内容,欢迎下载使用。













