






人教版 (2019)必修 第一册第三节 氧化还原反应优秀课件ppt
展开【考纲要求】1.了解氧化性、还原性强弱的比较; 2.了解常见的氧化还原反应; 3.了解氧化还原反应的规律并能利用其 解决问题。
一.对氧化性、还原性强弱的认识
1.氧化性指物质 的性质(或能力); 还原性指物质 的性质(或能力)。
2.Na-e-===Na+,Al-3e-===Al3+, 根据金属活动性顺序,Na比Al活泼,因为Na更易失去电子,所以Na比Al的还原性强。 还原性:Na > Al氧化性、还原性的强弱取决于: 物质得、失电子的难易程度, 与得、失电子数目的多少无关。
(1)最高价态——只有氧化性 如H2SO4中的S、KMnO4中的Mn等;(2)最低价态——只有还原性 如金属单质、Cl-、S2-等;(3)中间价态——既有氧化性,又有还原性 如Fe2+、S、Cl2等。
二.氧化性、还原性强弱的比较方法
1.依据氧化还原反应原理判断
(1)氧化性强弱: 。 (2)还原性强弱: 。
【例题1】 反应① H2SO3+I2+H2O===2HI+H2SO4反应② 2FeCl3+2HI===2FeCl2+I2+2HCl请判断:H2SO3、I-、Fe2+三者还原性的强弱; Fe3+、I2、H2SO4三者氧化性的强弱。【答案】还原性:H2SO3>I->Fe2+; 氧化性:Fe3+>I2>H2SO4。
2.依据元素活动性顺序判断
(1)金属越活泼,其单质的还原性越强, 对应阳离子的氧化性逐渐减弱。
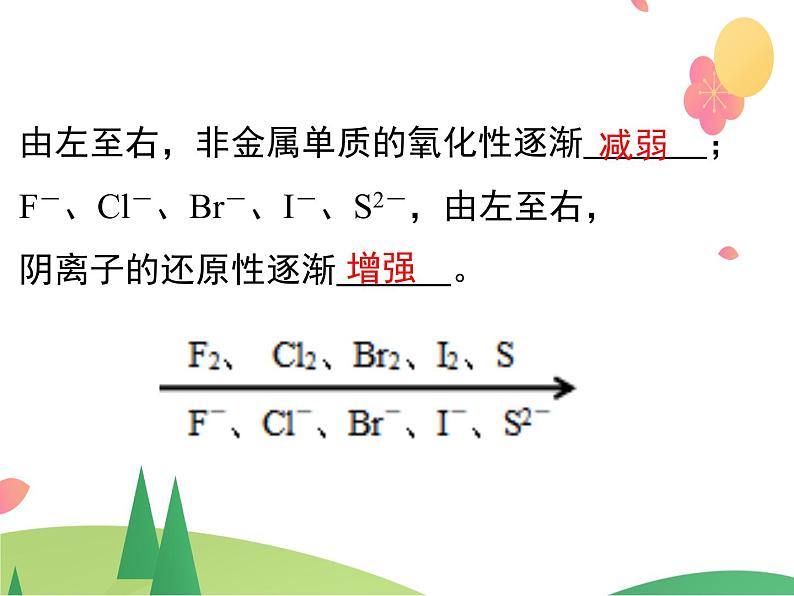
(2)非金属越活泼,其单质氧化性越强, 对应阴离子的还原性越弱。
由左至右,非金属单质的氧化性逐渐 ;F-、Cl-、Br-、I-、S2-,由左至右,阴离子的还原性逐渐 。
3.依据产物中元素价态的高低判断(1)相同条件下,不同氧化剂作用于同一种还原剂,氧化产物价态高的其氧化性强。(2)相同条件下,不同还原剂作用于同一种氧化剂,还原产物价态低的其还原性强。
4.依据影响因素判断(1)浓度:同一种物质,浓度越大,氧化性(或还原性)越强。如氧化性:浓H2SO4>稀H2SO4,浓HNO3>稀HNO3; 还原性:浓HCl>稀HCl。(2)温度:同一种物质,温度越高其氧化性越强。如热的浓硫酸的氧化性比冷的浓硫酸的氧化性强。(3)酸碱性:同一种物质,所处环境酸(碱)性越强其氧化(还原)性越强。氧化性:KMnO4(酸性)>KMnO4(中性)>KMnO4(碱性)。
三.氧化还原反应的规律
1.价态规律(1)价态归中规律含同种元素但价态不同的物质间发生氧化还原反应,“两相靠,不相交”。称为价态归中反应。例如:不同价态硫之间可以发生的氧化还原反应是下图中的①②③④。
不会出现⑤中H2S转化为SO2,而H2SO4转化为S的情况,出现了交叉。
【例题2】 请标注出下列反应中元素的化合价,用双线桥分析氧化还原反应。 H2S + H2SO4(浓) = S↓ + SO2↑+ 2H2O
(2)歧化反应规律物质所含元素能生成多种价态的产物时,发生的氧化还原反应称为歧化反应。 “中间价 高价+低价”。具有多种价态的元素(如氯、硫、氮和磷元素等)均可发生歧化反应。
【例题3】请标注出下列反应中元素的化合价,用双线桥分析氧化还原反应。 Cl2+2NaOH===NaCl+NaClO+H2O
2.强弱规律根据氧化还原反应反应原理:(1)氧化性强弱:氧化剂>氧化产物 (2)还原性强弱:还原剂>还原产物 依据物质氧化性或还原性的强弱,也能判断一个氧化还原反应是否符合反应原理,能否自发进行。
【例题4】已知I-、Fe2+、SO2和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为:Fe2+<H2O2<I-<SO2,则下列反应不能发生的是A.2Fe3++SO2+2H2O===2Fe2++SO42-+4H+B.I2+SO2+2H2O===H2SO4+2HIC.H2O2+H2SO4===SO2↑+O2↑+2H2OD.2Fe3++H2O2===2Fe2++O2↑+2H+ 【答案】C
3.先后规律同一体系中,当有多个氧化还原反应发生时,强者优先,总是氧化性强(还原性强)的物质优先反应。例如:(1)向含相同物质的量浓度的S2-、I-、Br-溶液中,缓慢通入氯气,还原性强的离子优先反应,先后顺序: ;(2)向含等物质的量浓度的Fe3+、Cu2+、H+、Ag+溶液中,缓慢加入足量的铁粉,氧化性强的离子优先发生反应,先后顺序为 。
Ag+、Fe3+、Cu2+、H+
4.守恒规律特征:氧化还原反应中, 化合价有升必有降,升降总值相等。本质:氧化还原反应中, 氧化剂得电子总数,等于还原剂失电子总数。应用: 氧化还原反应方程式的配平; 有关得失电子数目的计算。
【例题5】Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO 被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1∶16,则x的值( )A.2 B.5C.4 D.3【答案】B
1.科学的假设与猜想是科学探究的先导和价值所在。在下列假设或猜想引导下的探究肯定没有意义的是( )A.探究SO2和Na2O2反应可能有生成Na2SO4B.探究NO和N2O可能化合生成NO2C.探究NO2可能被NaOH溶液完全吸收生成 NaNO2和NaNO3D.探究新型催化剂实现汽车尾气中NO与CO 反应转化为N2和CO2
2.铝粉在碱性条件下可将溶液中的NO3-还原为N2,其化学方程式为:10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。下列说法不正确的是( )A.反应中NaNO3得电子B.氧化性:NaNO3>NaAlO2C.还原产物是N2D.转移1ml电子时产生标况下的N26.72L【答案】D
3.已知反应:①Cl2+2KBr=2KCl+Br2,②KClO3+6HCl=3Cl2+KCl+3H2O,③2KBrO3+Cl2=Br2+2KClO3,下列说法正确的是A.上述三个反应都有单质生成,都是置换反应B.氧化性由强到弱顺序 KBrO3>KClO3>Cl2>Br2C.反应②中还原剂与氧化剂的物质的量之比 为6∶1D.③中lml还原剂反应则氧化剂得到电子的 物质的量为2 ml 【答案】B
4.在一定条件下,PbO2 与Cr3+反应,产物是Cr2O72-和Pb2+,若生成3ml Cr2O72-则反应所需PbO2的物质的量为( )A.7.5ml B.3ml C.9ml D.6ml【答案】C
5.对反应3NO2+H2O= 2HNO3+NO的下列说法正确的是( )A.还原剂与氧化剂物质的量之比为2∶1B.氧化产物与还原产物的物质的量之比为1∶2C.NO2是氧化剂,H2O是还原剂D.反应中若有6 ml NO2参与反应,则有 3 ml电子发生转移 【答案】A
人教版 (2019)必修 第一册第一章 物质及其变化第三节 氧化还原反应优秀课件ppt: 这是一份人教版 (2019)必修 第一册<a href="/hx/tb_c161975_t3/?tag_id=26" target="_blank">第一章 物质及其变化第三节 氧化还原反应优秀课件ppt</a>,共34页。PPT课件主要包含了考纲要求,得电子,失电子,从元素的价态考虑,氧化剂氧化产物,还原剂还原产物,浓硫酸不能干燥H2S,I-Br-等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第三节 氧化还原反应教学课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第三节 氧化还原反应教学课件ppt,共26页。PPT课件主要包含了学习目标等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第三节 氧化还原反应备课课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第三节 氧化还原反应备课课件ppt,文件包含133氧化还原反应的应用课件高一化学同步备课系列人教版2019必修第一册pptx、133氧化还原反应的应用分层作业解析版-上好课2022-2023学年高一化学同步备课系列人教版2019必修第一册docx、133氧化还原反应的应用分层作业原卷版-上好课2022-2023学年高一化学同步备课系列人教版2019必修第一册docx等3份课件配套教学资源,其中PPT共30页, 欢迎下载使用。













