




高中化学人教版 (2019)必修 第一册第一章 物质及其变化第二节 离子反应精品ppt课件
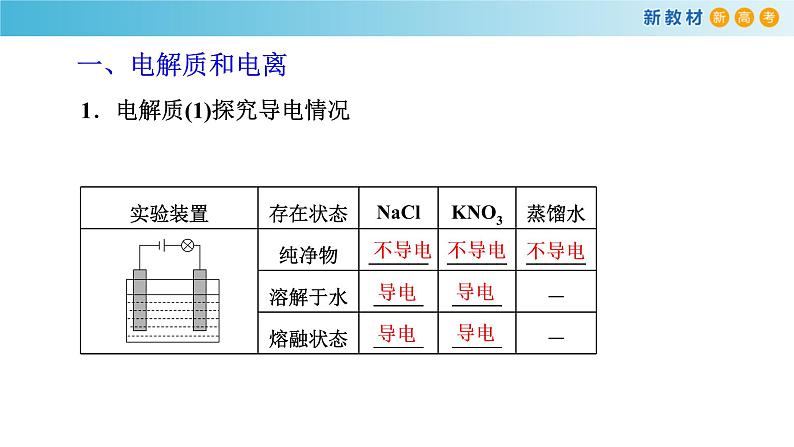
展开【实验1-2】在三个烧杯中分别加入干燥的NaCl固体、KNO3固体和蒸馏水,如图1-9所示连接装置,将石墨电极依次放入三个烧杯中,分别接通电源,观察并记录现象。 取上述烧杯中的NaCl固体、KNO3,固体各少许,分别加入另外两个盛有蒸馏水的烧杯中,用玻璃棒搅拌,使固体完全溶解形成溶液。如图1-9所示,将石墨电极依次放入NaC1溶液、KNO3溶液中,分别接通电源,观察并记录现象。
1.电解质(1)探究导电情况
(2)电解质概念在 状态下 的化合物,如酸、碱、盐等。
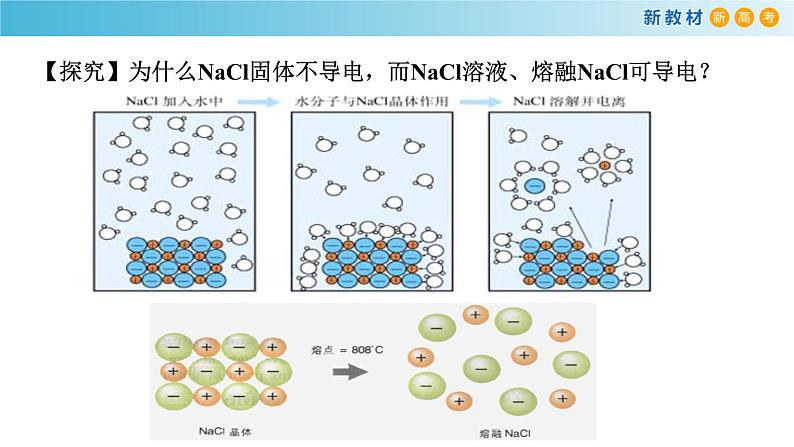
【探究】为什么NaCl固体不导电,而NaCl溶液、熔融NaCl可导电?
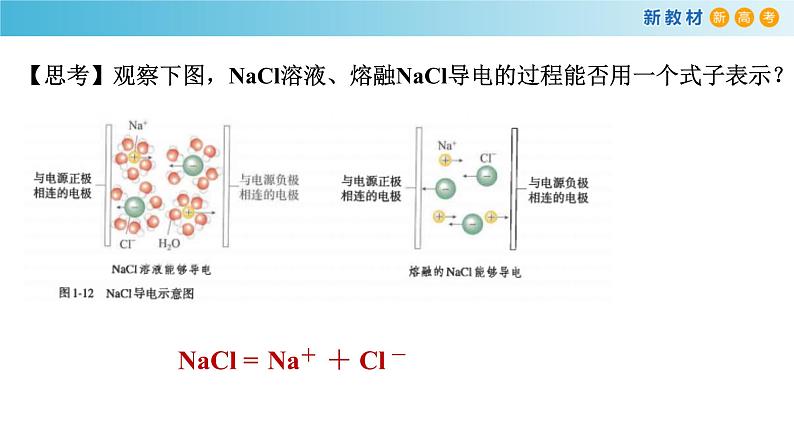
【思考】观察下图,NaCl溶液、熔融NaCl导电的过程能否用一个式子表示?
2.电离(1)电解质能够导电的原因电解质的 (或 )中存在着能自由移动的、带 的粒子。以NaCl为例:①NaCl水溶液:在水分子的作用下,Na+和Cl-脱离NaCl固体的表面,形成能够自由移动的 和 。为方便起见,仍用离子符号表示水合离子,则NaCl水溶液中存在能够自由移动的粒子为 。②NaCl固体受热熔化:离子的运动随温度升高而加快,克服离子间的相互作用,产生了能够自由移动的粒子 。
3.常见的电解质和非电解质(1)常见的电解质
①酸:HCl、H2SO4、HNO3、H2CO3等。
②碱:KOH、NaOH、NH3·H2O、Mg(OH)2、Al(OH)3等。
③盐:KCl、Na2SO4、Mg(NO3)2等。
④活泼金属氧化物:Na2O、CaO等。
(2)常见的非电解质①部分_______________:CO2、SO2、SO3、P2O5等。②非酸性气态氢化物:NH3。③大部分________:蔗糖、酒精、CH4等。
一、电解质的判断1.从物质分类角度:电解质与非电解质都属于化合物。单质、混合物既不是电解质,也不是非电解质。2.从物质性质角度:电解质导电的条件是电解质溶于水或熔融状态下,二者具备其一即可。(1)有些电解质溶于水导电,但熔融状态下不导电,如酸。(2)有些电解质只在熔融状态下才能导电,如金属氧化物或难溶于水的盐。
3.从导电本质角度:电解质导电的本质是化合物自身发生电离,若是化合物溶于水时与水发生反应所得产物电离导致溶液导电,则该化合物不是电解质,如CO2溶于水可以导电,是因为二氧化碳与水反应生成的碳酸电离出自由移动的离子,实际上二氧化碳属于非电解质。
(1)溶于水能导电的化合物不一定是电解质。例如:CO2、SO2、SO3、NH3的水溶液均能导电,但CO2、SO2、SO3、NH3本身不能直接电离产生离子,而是它们与H2O反应生成的H2CO3、H2SO3、H2SO4、NH3·H2O电离出自由移动的离子,所以H2CO3、H2SO3、H2SO4、NH3·H2O是电解质,CO2、SO2、SO3、NH3是非电解质。
【特别提醒】理解电解质和非电解质的四个“不一定”
(2)能导电的物质不一定是电解质。举例如下:①Fe、Cu等金属能导电,但它们是单质,既不是电解质也不是非电解质。②稀盐酸能导电,但不是电解质,因为稀盐酸为混合物。(3)电解质不一定易溶于水,易溶于水的化合物不一定是电解质。例如:BaSO4等难溶于水的盐,其水溶液的导电能力很弱,但其溶于水的部分完全电离,因而属于电解质。蔗糖易溶于水,但它是非电解质。(4)不是电解质的物质不一定就是非电解质。单质和混合物既不是电解质也不是非电解质。
电解质导电的条件:在水溶液里或熔融状态下。1.强碱和盐等化合物在固态时虽然存在阴、阳离子,但是不能自由移动,所以不能导电;它们在水溶液里或熔融状态下能电离出自由移动的离子,故能导电。2.酸在固态或液态(熔融状态)时只有分子,没有自由移动的离子,因而不能导电,如液态HCl、H2SO4等不能导电;在水溶液里受水分子的作用,电离产生自由移动的离子,因而能够导电。因此,电离是导电的前提。
例1.下列说法正确的是( )A.蔗糖、硫酸钡均属于电解质B.NH4Cl是电解质,所以NH4Cl溶液是电解质C.电解质未必能导电,能导电的未必是电解质D.Cl2的水溶液能导电,所以Cl2是电解质
【答案】C【解析】蔗糖溶于水和熔融状态下均不导电,为非电解质,A错误;电解质是针对纯净的化合物而言的,NH4Cl溶液为混合物,既不是电解质也不是非电解质,B错误;电解质未必能导电,如固体氯化钠,能导电的也未必是电解质,如金属单质,C正确;Cl2为单质,不是化合物,电解质是针对化合物而言的,所以Cl2既不是电解质也不是非电解质,D错误。
1.电离方程式是用____________________表示电解质电离过程的式子。2.写出下列酸、碱、盐的电离方程式。①硫酸(H2SO4):____________________。②氢氧化钠(NaOH):____________________。③硫酸钠(Na2SO4):_________________________。
3.从电离角度认识酸、碱、盐的本质(1)酸:电离时生成的阳离子全部是_____的化合物,如H2SO4、HNO3等。(2)碱:电离时生成的阴离子全部是_____的化合物,如NaOH、Ba(OH)2等。(3)盐:电离时生成的阴离子是__________、阳离子是____________________的化合物,如Na2SO4、NH4NO3等。
(1)强酸、强碱和大部分盐书写时用“===”连接,如H2SO4===2H++SO42-、NaOH===Na++OH-、NaCl===Na++Cl-。(2)酸式盐的电离方程式①强酸的酸式盐在水溶液中完全电离,如NaHSO4===Na++H++SO42-。②弱酸的酸式盐在水溶液中生成酸式酸根离子和阳离子,如NaHCO3===Na++HCO3-。
(1)左侧写化学式,右侧写离子符号。离子符号不能主观臆造,要遵循元素化合价关系。(2)遵循质量守恒和电荷守恒。
二、书写电离方程式时的注意事项
(1)强电解质:____________________________________。
(2)弱电解质:____________________________________。
在水溶液中能完全电离的电解质。
在水溶液中只能部分电离的电解质。
三、强电解质和弱电解质
【实验探究】为了测定不同电解质的水溶液的导电能力是否相同,设计如图所示的实验。
请回答下列问题:(1)本实验取了盐酸、CH3COOH溶液、NaOH溶液、NaCl溶液和氨水五种溶液,若要再增加一种溶液,你认为选取下列哪种溶液最为合适?________(填标号)。A.硫酸钠溶液 B.氯化钙溶液C.氢氧化钡溶液 D.硝酸钾溶液
(2)为了排除无关因素的干扰,本实验应控制多种实验条件,如烧杯的规格相同、烧杯内溶液的体积相等、相同的电极材料、各电极间的距离相等、溶液的温度相同等,除此外,你认为还应控制的最关键的条件(或因素)是___________________________________。(3)本实验通过观察到_________________________现象,间接说明不同电解质溶液导电能力是不同的。(4)通过本实验,证实了不同的电解质溶液导电能力是不同的,从而可直接推出的结论是__________________________________________。
五种溶液的物质的量浓度相同
不同电解质在水中的电离程度是不同的
【解析】(1)从题目所给的物质来看,已经给了两种酸、两种碱、一种盐,所以再增加一种盐即可。题给五种溶液中电解质电离出的离子都带一个单位的电荷,为控制单一变量,选取硝酸钾溶液。(2)为控制单一变量,需保证所测定溶液的浓度均相同。(3)电解质的强弱导致同等浓度的溶液所电离出离子浓度不同,因此会影响导电能力。(4)强弱电解质在水中的电离程度是不同的。
2.强弱电解质与物质类别的关系
例3.分别向下列各溶液中加入少量NaOH固体,溶液的导电能力变化最小的( )A.水 B.盐酸C.醋酸溶液 D.NaCl溶液
【答案】B【解析】A为弱电解质,加入后增强导电性;C为弱电解质,反应后生成的醋酸钠为强电解质;D项相当于又增加了新的电解质,故导电性增强;B项反应前后均为强电解质,故导电能力变化最小。
必修 第一册第二节 离子反应课前预习课件ppt: 这是一份必修 第一册<a href="/hx/tb_c161973_t3/?tag_id=26" target="_blank">第二节 离子反应课前预习课件ppt</a>,共32页。PPT课件主要包含了考纲要求,电解质,电解质和非电解质,不一定,水溶液,熔融状态,电解质的电离等内容,欢迎下载使用。
人教版 (2019)必修 第一册第二节 离子反应备课ppt课件: 这是一份人教版 (2019)必修 第一册第二节 离子反应备课ppt课件,文件包含121电解质的电离分层作业解析版-上好课2022-2023学年高一化学同步备课系列人教版2019必修第一册docx、121电解质的电离分层作业原卷版-上好课2022-2023学年高一化学同步备课系列人教版2019必修第一册docx、121电解质的电离课件高一化学同步备课系列人教版2019必修第一册pptx等3份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
人教版 (2019)必修 第一册第二节 离子反应课堂教学ppt课件: 这是一份人教版 (2019)必修 第一册第二节 离子反应课堂教学ppt课件,共35页。PPT课件主要包含了②④⑧⑩,①⑤⑦⑧,氯化钠溶解,为什么湿手更易触电,化学课堂欢迎你,物质的导电性实验探究等内容,欢迎下载使用。













