高中化学第二节 离子反应教学设计
展开
这是一份高中化学第二节 离子反应教学设计,共2页。
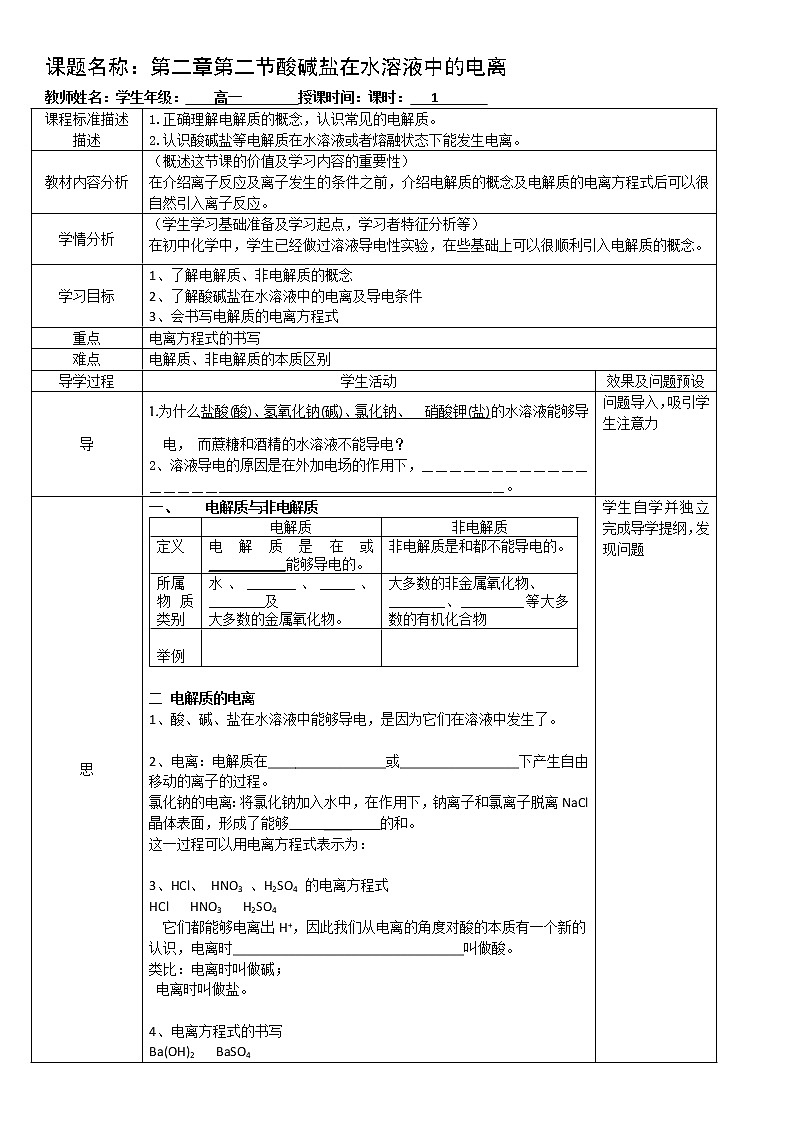
课题名称:第二章第二节酸碱盐在水溶液中的电离教师姓名:学生年级: 高一 授课时间:课时: 1 课程标准描述描述1.正确理解电解质的概念,认识常见的电解质。2.认识酸碱盐等电解质在水溶液或者熔融状态下能发生电离。 教材内容分析(概述这节课的价值及学习内容的重要性)在介绍离子反应及离子发生的条件之前,介绍电解质的概念及电解质的电离方程式后可以很自然引入离子反应。学情分析(学生学习基础准备及学习起点,学习者特征分析等)在初中化学中,学生已经做过溶液导电性实验,在些基础上可以很顺利引入电解质的概念。学习目标1、了解电解质、非电解质的概念2、了解酸碱盐在水溶液中的电离及导电条件3、会书写电解质的电离方程式重点电离方程式的书写难点电解质、非电解质的本质区别导学过程学生活动效果及问题预设导1.为什么盐酸(酸)、氢氧化钠(碱)、氯化钠、 硝酸钾(盐)的水溶液能够导电, 而蔗糖和酒精的水溶液不能导电?2、溶液导电的原因是在外加电场的作用下,_________________________________________________________。问题导入,吸引学生注意力思 一、 电解质与非电解质 电解质非电解质定义电解质是在或 ___________能够导电的。非电解质是和都不能导电的。所属物质类别水、_______、_____、________及大多数的金属氧化物。大多数的非金属氧化物、________、_________等大多数的有机化合物 举例 二 电解质的电离1、酸、碱、盐在水溶液中能够导电,是因为它们在溶液中发生了。 2、电离:电解质在_________________或_________________下产生自由移动的离子的过程。氯化钠的电离:将氯化钠加入水中,在作用下,钠离子和氯离子脱离NaCl晶体表面,形成了能够 ____ 的和。这一过程可以用电离方程式表示为: 3、HCl、 HNO3 、H2SO4 的电离方程式HCl HNO3 H2SO4它们都能够电离出H+,因此我们从电离的角度对酸的本质有一个新的认识,电离时_________________________________叫做酸。类比:电离时叫做碱; 电离时叫做盐。 4、电离方程式的书写Ba(OH)2 BaSO4Na2CO3 NaHCO3NaHSO4(水溶液中)学生自学并独立完成导学提纲,发现问题议导学提纲中的问题及练习 酸碱盐的本质通过议的环节,小组成员互帮互学,相互促进。展培养学生勇于表达的力和习惯,并学会质疑。评归纳总结,学会记录重难点知识。检见导学提纲 堂测设计 板书设计第二章第二节酸碱盐在水溶液中的电离二、 电解质与非电解质二 电解质的电离 教学反思 检查结果及修改意见:合格[ ] 不合格[ ] 组长(签字): 检查日期: 年 月 日
相关教案
这是一份高中化学第二节 离子反应教案设计,共3页。
这是一份高中人教版 (新课标)第一节 物质的分类教学设计及反思,共4页。
这是一份必修1第一节 化学实验基本方法教学设计,共4页。