





高中化学鲁科版 (2019)选择性必修1第1节 化学反应的热效应课文内容课件ppt
展开1.已知1ml石墨完全燃烧生成二氧化碳气体,放出393.5kJ的热量,写出石墨完全燃烧的热化学方程式。
C(石墨、s)+O2(g)=CO2(g)△H=-393.51kJ/ml
2.写出二氧化碳转化为石墨和氧气的热化学方程式
CO2(g)=C(石墨、s)+O2(g)△H=+393.51kJ/ml
如何获得化学反应焓变的数据?
通过实验测定——反应热的测定实验
所有化学反应的焓变都可以通过实验进行测定吗?例如碳和氧气反应生成一氧化碳气体的焓变,能否通过实验进行测定?若不能进行测定你认为原因是什么?
C燃烧时不可能完全生成CO,总有一部分CO2生成,因此这个反应的ΔH无法直接测得。
1.化学反应不计其数,每一个反应在不同温度下的反应焓变又不尽相同,通过实验测定反应焓变工作量大; 2.受反应条件的限制,有些反应的焓变很难直接测定。
如何得知碳单质与氧气生成CO这一反应的焓变呢?能否利用一些已知反应的焓变来计算其他反应的焓变呢?
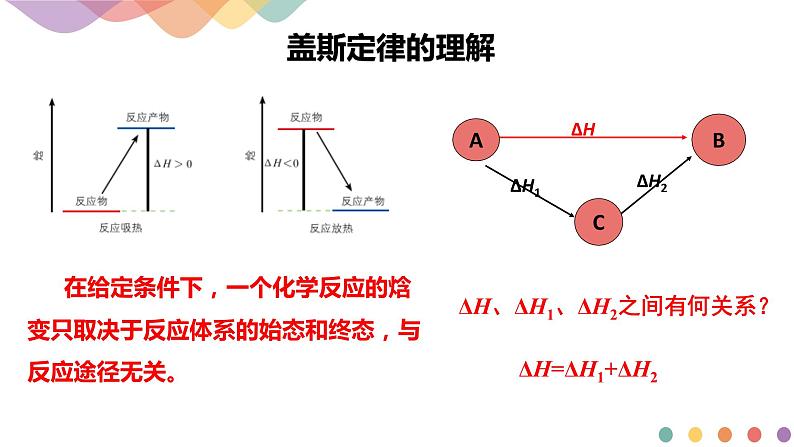
一个化学反应无论是一步完成还是分几步完成,反应热都是一样的。
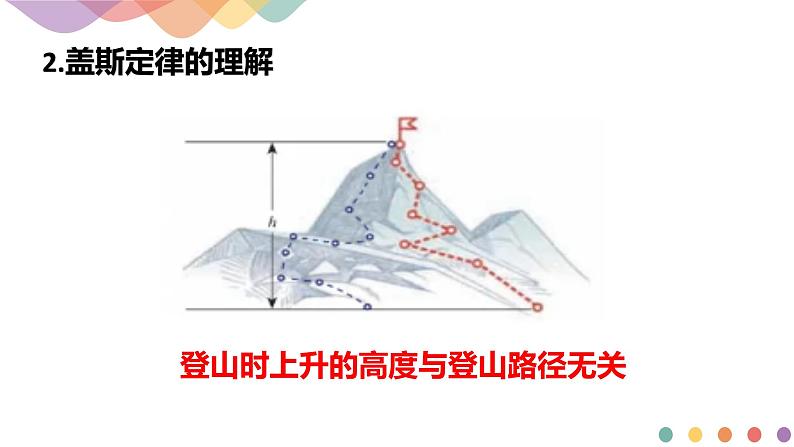
登山时上升的高度与登山路径无关
在给定条件下,一个化学反应的焓变只取决于反应体系的始态和终态,与反应途径无关。
ΔH、ΔH1、ΔH2之间有何关系?
【例】已知在298K时下列反应焓变的实验数据:(1)C(s,石墨)+O2(g)==CO2(g) ΔH1=–393.5 kJ·ml-1(2)CO(g)+1/2O2(g)==CO2(g) ΔH2=–283.0 kJ·ml-1计算此温度下C(s,石墨)+ 1/2O2(g)==CO(g)的反应焓变。
有些化学反应进行很慢或不易直接发生,很难直接测得这些反应的反应热,可通过盖斯定律获得它们的反应热数据。
解:此反应分两步进行:第一步:C(s,石墨)+O2(g)==CO2(g) ΔH1=–393.5 kJ·ml-1第二步:CO2(g)==CO(g)+1/2O2(g) ΔH2'=–ΔH2=+283.0 kJ·ml-1将上述两反应相加,得总反应为: C(s,石墨)+ 1/2O2(g)==CO(g) ΔH3=?根据盖斯定律,总反应的ΔH3为两步反应的ΔH之和,即:ΔH3=+ΔH1+ΔH2' =–393.5 kJ·ml-1+283.0 kJ·ml-1 =-110.5kJ·ml-1答:在298K时,反应C(s,石墨)+ 1/2O2(g)==CO(g)的ΔH为-110.5kJ·ml-1。
若一个化学反应的热化学方程式可由另外几个化学反应的热化学方程式相加减而得到,则该化学反应的焓变即为另外几个化学反应焓变的代数和。
方法: 1.分析给定反应与所求反应的物质关系和焓变关系。 2.将已知方程式进行变换、加和得到总反应的热化学方程式。 3.将焓变的数值根据关系进行加和计算出所求反应的焓变。
已知下列反应的反应热为⑴CH3COOH(l)+2O2(g)== 2CO2(g)+ 2H2O(l) ΔH1=-870.3 kJ·ml-1⑵C(s)+O2(g)==CO2(g) ΔH2=-393.5 kJ·ml-1⑶H2(g)+1/2O2(g)==H2O(l) ΔH3=-285.8 kJ·ml-1试计算下述反应的反应热:2C(s)+2H2(g)+O2(g)==CH3COOH(l)
【解析】由题意可知2[(2)+(3)]-(1)即得目标方程式。 即:ΔH=2[ΔH 2+ΔH3] -ΔH1
ΔH =2×[(-393.5 kJ·ml-1)+(-285.8 kJ·ml-1)]-(-870.3 kJ·ml-1) =-488.3 kJ·ml-1
人类的生活离不开能源,什么是能源?能源的利用存在哪些问题?如何合理利用能源?
1.能源总量丰富,人均能源可采储量低
2.能源结构不平衡、资源分布不均衡
3.能源消费快速增长,能源利用率低,能源危机趋势严重
4.使用的主要能源煤为主,石油、天然气为辅。
如何实现能源的可持续发展?
实现能源的可持续发展措施
开源:开发核能、风能、太阳能、氢能等新能源
节流:加大节能减排的力度 提高能源利用效率
1.燃料的合理利用和综合利用是提高能源利用效率的重要途径之一。人们通常会从哪些角度、依据什么标准来合理选择燃料?
燃料储存的条件、价格
燃料对生态环境的影响
在一定反应温度和压强条件下,1ml纯物质完全氧化为同温下的指定产物时的焓变。并指定物质中所含有的氮元素氧化为N2(g)、氢元素氧化为H2O(l)、碳元素氧化为CO2 (g)。
2.请结合表中几种物质的摩尔燃烧焓数据,评价煤、天然气、氢气、一氧化碳作为燃料的优缺点。(煤的燃烧焓可用石墨的燃烧焓粗略估计)
3.目前,煤在我国仍然是第一能源,但是,将煤直接用作燃料,不仅利用效率低,而且会产生大量固体垃圾和多种有害气体,为解决这一问题,工业上通过煤的干馏、气化和液化等方法来实现煤的综合利用,其中,煤的气化试讲煤转化为可燃气体的过程,主要反应为 C(s)+H2O(g) CO(g)+H2(g)(1)你认为煤的气化对于提高能源利用效率有哪些价值?
1.燃烧更充分,节约资源,减少成本。
2.减少燃料中N和S的含量,减少其氧化物对环境的污染
3.更有利于运输,气体通过管道运输,减少损耗,降低成本
(2)已知298K、101kPa时,1mlH2O(l)变为H2O(g)需要吸收44.0KJ的热量,则上述煤的气化反应的焓变是多少?
C(s)+O2(g)==CO2(g) ΔH1=-393.5 kJ·ml-1
CO(g)+1/2O2(g)==CO2(g) ΔH2=–283.0 kJ·ml-1
H2(g)+1/2O2(g)==H2O(l) ΔH3=-285.8 kJ·ml-1
H2O(l)==H2O(g) ΔH4=+44.0 kJ·ml-1
C(s)+H2O(g)==CO(g)+H2(g) ΔH=?
ΔH=ΔH1-ΔH2-ΔH3-ΔH4 =-393.5 kJ·ml-1 -(-283.0kJ·ml-1 )-(-285.8kJ·ml-1 )-44.0kJ·ml-1 =+131.3kJ·ml-1
一个化学反应无论是一步完成还是分几步完成,反应热都是一样的。
在给定条件下,一个化学反应的焓变只取决于反应体系的始态和终态,与反应途径无关
获得很难直接测得反应热的反应焓变
若一个化学反应的热化学方程式可由另外几个化学反应的热化学方程式相加减而得到,则该化学反应的焓变即为另外几个化学反应焓变的代数和。
高中鲁科版 (2019)第1节 化学反应的热效应多媒体教学课件ppt: 这是一份高中鲁科版 (2019)<a href="/hx/tb_c4002573_t3/?tag_id=26" target="_blank">第1节 化学反应的热效应多媒体教学课件ppt</a>,共20页。PPT课件主要包含了反应焓变的计算,盖斯定律,∆H3,实际问题解决,练一练等内容,欢迎下载使用。
鲁科版 (2019)选择性必修1第1节 化学反应的热效应教课内容ppt课件: 这是一份鲁科版 (2019)选择性必修1第1节 化学反应的热效应教课内容ppt课件,共46页。PPT课件主要包含了学业基础,核心素养,当堂评价,核心微网络,反应途径,ΔH+ΔH2,化石燃料,天然气,不可再生,摩尔燃烧焓等内容,欢迎下载使用。
高中化学鲁科版 (2019)选择性必修1第1节 化学反应的热效应图片ppt课件: 这是一份高中化学鲁科版 (2019)选择性必修1第1节 化学反应的热效应图片ppt课件,共47页。PPT课件主要包含了任务分项突破,课堂小结提升,学科素养测评,自主梳理,互动探究,题组例练,答案②④⑥⑦,J·mol-1,kJ·mol-1,题点一ΔH图像问题等内容,欢迎下载使用。













