人教版 (新课标)选修3 物质结构与性质第三章 晶体结构与性质第四节 离子晶体教案设计
展开第四节 离子晶体
在我们周围广泛存在着离子化合物,常温下,许多离子化合物以晶体形态存在,如碳酸钙等。这些晶体是如何形成的?在这些晶体中,微粒又是怎样堆积的呢?
依据前面研究金属晶体结构的方法,观察NaCl晶体,发现其中的微粒排布同样具有周期性,从中截取一个面心立方结构,就得到了NaCl晶体的晶胞。
在NaCl中,每个Na+周围分布有六个Cl-,同样每个Cl-周围分布有六个Na+,那么,在一个晶胞中实际拥有的Na+与Cl-各是多少个?
一、离子晶体
1.结构特点:
2.决定晶体结构的因素:
3.常见的离子晶体:
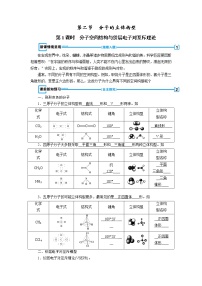
晶体类型
NaCl
CsCl
CaF2
晶胞
阳离子的
配位数
__6____
__6____
__8____
阴离子的
配位数
__8____
__8____
__4____
4.物理性质:
(1)硬 度__较大____,难于压缩。
(2)熔点和沸点__较高____。
(3)固体不导电,但在__熔融状态或水溶液____中能导电。
二、晶格能
1.概念:气态离子形成__1____mol离子晶体释放的能量。
2.影响因素:
晶格能—→越大
3.晶格能对离子晶体性质的影响。
晶格能越大,形成的离子晶体越__稳定____,而且熔点越__高____,硬度越__大____。
1.思考辨析:
(1)离子晶体中含有阴、阳离子,在固态时导电。( × )
(2)离子晶体中不存在共价键。 ( × )
(3)氯化钠、氟化钙晶体我们通常写为NaCl、CaF2,说明晶体中存在组成为NaCl、CaF2的分子。 ( × )
(4)在NaCl晶胞中正六面体的顶点上、面上、棱上的Na+或Cl-为该晶胞与其相邻的晶胞所共有,一个晶胞中Na+的个数为6;Cl-的个数为4。 ( × )
(5)氯化钠的熔点大于氯化钾的熔点。 ( √ )
(6)MgO的熔、沸点和硬度均高于CaO。 ( √ )
2.离子晶体中一定不会存在的相互作用是( D )
A.离子键 B.极性键
C.非极性键 D.范德华力
解析:离子化合物中一定含有离子键,也可能含有共价键,例如OH-和含氧酸根中的极性共价键,还有O中的非极性共价键。只有分子晶体中才含有范德华力,离子晶体中一定不会有范德华力。因此选D。
3.共价键、离子键和范德华力是粒子之间的三种作用力。下列晶体①Na2O2;②SiO2;③石墨;④金刚石;⑤NaCl;⑥白磷中,含有两种作用力的是( B )
A.①②③ B.①③⑥
C.②④⑤ D.①②③⑥
解析:过氧化钠中有离子键和共价键;石墨和白磷中存在共价键和分子间作用力。
4.下列说法一定正确的是( D )
A.固态时能导电的物质一定是金属晶体
B.熔融状态能导电的晶体一定是离子晶体
C.水溶液能导电的晶体一定是离子晶体
D.固态不导电而熔融态导电的晶体一定是离子晶体
解析:四种晶体在不同状态下的导电性区别如下:
分子晶体
原子晶体
金属晶体
离子晶体
固态
不导电
不导电(晶体硅导电)
可导电
不导电
熔融状态
不导电
不导电
可导电
可导电
水溶液
有的可导电
-
-
可导电
5.下列性质中,可以较充分说明某晶体是离子晶体的是( D )
A.具有较高的熔点
B.固态不导电,水溶液能导电
C.可溶于水
D.固态不导电,熔融状态能导电
解析:从熔点来看,离子晶体一般具有较高的熔点,但金刚石、石英等原子晶体也有很高的熔点,A项错误;从溶解性来看,蔗糖、葡萄糖等分子晶体也可溶于水,C项错误:从导电性来看,AlCl3、HCl都不是离子化合物,但它们的水溶液均能导电,B项错误;而如果固态不导电、熔融状态能导电,说明由固态变为熔融状态的过程是克服离子键(而不是共价键或金属键)的过程,即固态中原本有阴、阳离子,只是不能自由移动,而由阴、阳离子构成的晶体一定是离子晶体,D项正确。
6.下列热化学方程式中,能直接表示出氯化钠晶格能的是( A )
A.Na+(g)+Cl-(g)―→NaCl(s) ΔH1
B.Na(s)+Cl(g)―→NaCl(s) ΔH2
C.2Na+(g)+2Cl-(g)―→2NaCl(s) ΔH3
D.Na(g)+Cl(g)―→NaCl(s) ΔH4
解析:气态离子形成1 mol离子晶体释放的能量称为晶格能。
知识点一 离子晶体的结构
1.结构特点:
(1)离子晶体是由阳离子和阴离子通过离子键结合而成的晶体。
(2)离子晶体微粒之间的作用力是离子键。由于静电作用没有方向性,故离子键没有方向性。只要条件允许,阳离子周围可以尽可能多地吸引阴离子,同样,阴离子周围可以尽可能多地吸引阳离子,故离子键也没有饱和性。根据静电作用大小的影响因素可知,在离子晶体中阴、阳离子半径越小,所带电荷数越多,离子键越强。
(3)离子晶体的化学式只表示晶体中阴、阳离子的个数比,而不是表示其分子组成。
2.常见离子晶体的晶胞结构:
晶体
晶胞
晶胞详解
NaCl
①在NaCl晶体中,Na+的配位数为6,Cl-的配位数为6
②与Na+(Cl-)等距离且最近的Na+(Cl-)有12个
③每个晶胞中有4个Na+和4个Cl-
④每个Cl-周围的Na+构成正八面体图形
CsCl
①在CsCl晶体中,Cs+的配位数为8,Cl-的配位数为8
②每个Cs+与6个Cs+等距离相邻,每个Cs+与8个Cl-等距离相邻
CaF2
①在CaF2晶体中,Ca2+的配位数为8,F-的配位数为4
②每个晶胞中含有4个Ca2+和8个F-
典例1 高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0,部分为-2。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。下列说法正确的是( A )
A.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O
B.晶体中每个K+周围有8个O,每个O周围有8个K+
C.晶体中与每个K+距离最近的K+有8个
D.晶体中,0价氧元素与-2价氧元素的原子个数比为1︰3
解析:在一个超氧化钾晶胞中,含K+数为8×+6×=4,O2-数为12×+1=4,故化学式为KO2,且每个晶胞中含有4个K+和4个O,故A项正确;晶体中每个K+周围有6个O,每个O周围有6个K+,故B项不正确;晶体中与每个K+最近距离的K+有12个,故C项不正确;设0价氧原子个数为x,-2价氧原子个数为y,根据KO2为电中性得:2y=,=,故D项不正确。
方法技巧:解答该题时,一要利用“均摊法”,求得每个晶胞中所含离子的数目;二要根据晶体结构求得阴阳离子的配位数。同时也可联想NaCl晶体模型,利用熟悉的模型去解答有关问题。
〔变式训练1〕 (1)下图为离子晶体空间构型示意图,(●为阳离子,○为阴离子),以M代表阳离子,以N代表阴离子,写出各离子晶体的组成表达式:
A__MN____;B__MN2____;C__MN2____;D__MN____.
(2)下面是从NaCl或CsCl晶体结构中分割出来的部分结构图,其中属于从NaCl晶体中分割出来的结构图是__①④____。
解析:(1)运用立方晶胞结构的特征判断。在A项中M、N都在立方体的顶点且个数相等,故化学式为MN;在B项中,含M:×8+1=2个,含N:×4+2(体心)=4个;在C项中,含M:×4=个,含N:1个;在D项中,含M:×8=1个,含N:1个(体心)。
(2)NaCl晶体是简单立方体结构,每个Na+周围有6个Cl-,每个Cl-周围有6个Na+;与每个Na+等距离的Cl-有6个,且构成正八面体,同理,与每个Cl-等距离的6个Na+也构成正八面体,由此可知图①和④是属于NaCl晶体的。
知识点二 离子晶体的性质
性质
原因
熔沸点
离子晶体中有较强的离子键,熔化或气化时需消耗较多的能量。所以离子晶体有较高的熔点、沸点和难挥发性。通常情况下。同种类型的离子晶体,离子半径越小,离子键越强,熔、沸点越高
硬度
硬而脆。离子晶体表现出较高的硬度:当晶体受到冲击力作用时,部分离子键发生断裂,导致晶体破碎
导电性
不导电,但熔融或溶于水后能导电。离子晶体中,离子键较强,阴、阳离子不能自由移动,即晶体中无自由移动的离子,因此离子晶体不导电。当升高温度时,阴、阳离子获得足够的能量克服了离子间的相互作用力,成为自由移动的离子,在外加电场的作用下,离子定向移动而导电。离子晶体溶于水时,阴、阳离子受到水分子的作用成了自由移动的离子(或水合离子),在外加电场的作用下,阴、阳离子定向移动而导电
溶解性
大多数离子晶体易溶于极性溶剂(如水)中,难溶于非极性溶剂(如汽油、苯、CCl4)中。当把离子晶体放入水中时,水分子对离子晶体中的离子产生吸引,使离子晶体中的离子克服离子间的相互作用力而离开晶体,变成在水中自由移动的离子
延展性
离子晶体中阴、阳离子交替出现,层与层之间如果滑动,同性离子相邻而使斥力增大导致不稳定,所以离子晶体无延展性
典例2 下列有关离子晶体的数据大小比较不正确的是( A )
A.熔点:NaF>MgF2>AlF3
B.晶格能:NaF>NaCl>NaBr
C.阴离子的配位数:CsCl>NaCl>CaF2
D.硬度:MgO>CaO>BaO
解析:由于r(Na+)>r(Mg2+)>r(Al3+),且Na+、Mg2+、Al3+所带电荷数依次增大,所以NaF、MgF2、AlF3的离子键依次增强,晶格能依次增大,故熔点依次升高。r(F-)
物质
NaCl
MgCl2
AlCl3
SiCl4
单质B
熔点/℃
801
710
190
68
2300
沸点/℃
1465
1418
160
57
2500
A.SiCl4是分子晶体
B.单质B可能是原子晶体
C.AlCl3加热能升华
D.NaCl的键的强度比MgCl2小
解析:由表中所给的熔、沸点数据可知:SiCl4的熔、沸点最低,均低于100 ℃,为分子晶体;单质B的熔、沸点最高,高于2000 ℃,可能为原子晶体;AlCl3的沸点低于熔点,故可升华;NaCl的熔点高于MgCl2的熔点,表明NaCl中的离子键较难断裂,所以NaCl的键的强度比MgCl2大。
纳米技术
诺贝尔物理学奖获得者,美国科学家费曼(R.P.Feynman)在1959年的美国物理学年会上发表《底部有很大空间》的演讲中曾预言:“至少依我看来,物理学的规律不排除一个原子一个原子地制造物品的可能性。”这被公认为纳米科学技术思想的来源。1984年,德国萨尔兰大学的格莱特(H.Gleiter)在高真空的条件下将粒径为6 nm的铁粒子加压成形,烧结得到纳米量级的块状体,纳米材料由此得到迅速发展。1990年,纳米技术获得了重大突破。美国国际商用机器公司(IBM)阿尔马登研究中心的科学家成功地对单个的原子进行了重排。他们使用扫描隧道显微镜慢慢地把35个氙原子移动到各自的位置,组成了IBM三个字母,而三个字母加起来还没有3 nm长。中国科学家利用原子力显微镜(AFM)技术“刻”下了世界上字号最小的唐诗。
1.下列说法正确的是( D )
A.离子晶体中可能含有共价键,但一定含有金属元素
B.分子晶体一定含有共价键
C.离子晶体中一定不存在非极性键
D.含有离子键的晶体一定是离子晶体
解析:根据离子晶体的概念可知,只要含有离子键,形成的晶体就是离子晶体,但离子晶体中不一定只含有离子键,如Na2O2中含有非极性共价键,故C错,D正确。铵盐形成的晶体也是离子晶体,其中不含金属元素如NH4Cl,故A错。由稀有气体单原子分子形成的分子晶体中只含范德华力而无共价键,故B错。
2.下列说法中正确的是( D )
A.离子晶体中每个离子的周围均吸引着6个带相反电荷的离子
B.金属导电的原因是在外加电场的作用下金属产生自由电子,电子定向运动
C.分子晶体的熔沸点低,常温下均呈液态或气态
D.原子晶体中的各相邻原子都以共价键相结合
解析:A、C明显错误;金属中的自由电子并不是在外加电场的作用下产生的,B项不正确。
3.氧化钙在2 973 K时熔化,而氯化钠在1 074 K时熔化,二者的离子间距离和晶体结构都类似,有关它们熔点差别较大的原因叙述不正确的是( C )
A.氧化钙晶体中阴、阳离子所带的电荷数多
B.氧化钙的晶格能比氯化钠的晶格能大
C.氧化钙晶体的结构类型与氯化钠晶体的结构类型不同
D.在氧化钙与氯化钠的离子间距离类似的情况下,晶格能主要由阴、阳离子所带电荷数的多少决定
解析:氧化钙和氯化钠都属于离子晶体,熔点的高低可根据晶格能的大小判断。晶格能的大小与离子所带电荷数多少、离子间距离、晶体结构类型等因素有关。氧化钙和氯化钠的离子间距离和晶体结构都类似,故晶格能主要由阴、阳离子所带电荷数的多少决定。
4.下列性质适合于离子晶体的是( A )
A.熔点1037 ℃,易溶于水,水溶液能导电
B.熔点10.31 ℃,液态不导电,水溶液能导电
C.能溶于CS2,熔点112.8 ℃,沸点444.5 ℃
D.熔点97.81 ℃,质软、导电,密度0.97 g·cm-3
解析:四种晶体的熔、沸点一般是原子晶体高,离子晶体较高,金属晶体高低相差较大,一般较高,但有些高于一些原子晶体(如钨),有些低于一些分子晶体(如汞、钠等),分子晶体熔点较低。四种晶体中,原子晶体一般不导电(硅为半导体);分子晶体在固态和熔融态时不导电,溶于水时可能导电;金属晶体在固态和熔融态时均可导电;离子晶体在固态时不导电,但在熔融态和溶于水时可以导电。由此可以初步推断:A为离子晶体,B、C为分子晶体,D为金属晶体。
5.比较下列几组晶体熔、沸点的高低顺序
(1)金刚石、氯化钠、晶体硅、干冰
(2)石英晶体、铝硅合金、冰
(3)CaO、KI、KCl
(4)F2、Cl2、Br2、I2
答案:(1)金刚石>晶体硅>氯化钠>干冰
(2)石英晶体>铝硅合金>冰
(3)CaO>KCl>KI
(4)I2>Br2>Cl2>F2
解析:金刚石、晶体硅都属于原子晶体,C原子半径比Si原子半径小,键能大,金刚石熔点比晶体硅的高,原子晶体>离子晶体>分子晶体;故金刚石>晶体硅>氯化钠>干冰;石英为原子晶体熔点较高,并且合金的熔点比任一组分熔点都低,故冰<铝硅合金<金属铝<石英晶体;CaO、KCl、KI为离子晶体,熔点:CaO>KCl>KI;F2、Cl2、Br2、I2单质为分子晶体,熔点高低与相对分子质量大小有关,相对分子质量越大,熔点越高,故熔点高低顺序为:I2>Br2>Cl2>F2。
6.如图所示,直线交点处的圆圈为NaCl晶体中Na+或Cl-所处的位置。这两种离子在空间三个互相垂直的方向上都是等距离排列的。
(1)将其中代表Cl-的圆圈涂黑(不必考虑体积大小),以完成NaCl晶体结构示意图。
(2)晶体中,在每个Na+周围与它最近且距离相等的Na+共有__12____个。
(3)晶体中每一个重复的结构单元叫晶胞。在NaCl晶胞中,正六面体的顶点上、面上、棱上的Na+或Cl-为该晶胞与其相邻的晶胞所共有,一个晶胞中Cl-的个数等于__4____,即(计算式) __8×+6×=4____;Na+的个数等于__4____,即(填计算式) __12×+1=4____。
(4)设NaCl的摩尔质量为M g·mol-1,NaCl晶体的密度为ρ g·cm-3,阿伏加德罗常数为NA。NaCl晶体中两个钠离子间的最近距离为__×____cm。
解析:(1)如图所示。
(2)从体心的Na+看,与它最近且距离相等的Na+共有12个。
(3)根据离子晶体的晶胞中阴、阳离子个数的求算方法可知,NaCl晶胞中,含Cl-:8×+6×=4个,含Na+:12×+1=4个。
(4)设Cl-与Na+的最近距离为a cm,则两个最近的Na+间的距离为a cm,又·NA=M,即a=,所以Na+间的最近距离为× cm。
基 础 巩 固
一、选择题
1.下列叙述错误的是( A )
A.带相反电荷的离子之间的相互吸引称为离子键
B.金属元素与非金属元素化合时,不一定形成离子键
C.某元素的原子最外层只有一个电子,它跟卤素结合时所形成的化学键不一定是离子键
D.两种非金属原子间不可能形成离子键
解析:离子间的相互作用包括相互吸引和相互排斥两个方面,A项错;B项正确,如BeCl2、HgCl2中的化学键都是共价键;氢原子最外层只有一个电子,它与卤素结合时形成共价键,C项正确;两种非金属原子的电负性差值小,不能形成离子键,一定是形成共价键,D项正确。
2.如下图,在氯化钠晶体中,与每个Na+等距离且最近的几个Cl-所围成的空间几何构型为( B )
A.十二面体 B.正八面体
C.正六面体 D.正四面体
解析:首先要理解最近的离子在什么位置,以一个晶胞为例,处在中心位置上的Na+被六个面上的Cl-所包围,这6个Cl-离中心Na+最近将六个面心的Cl-连成一个图形即正八面体,如图,也可以有其它连接方法。
3.实现下列变化,需克服相同类型作用的是( B )
A.石墨和干冰的熔化 B.纯碱和烧碱的熔化
C.氯化钠和铁的熔化 D.食盐和冰醋酸的熔化
解析:要克服相同类型作用力,说明二者晶体类型相同,B选项都是离子晶体,熔化时破坏的是离子键。
4.下面的排序不正确的是( C )
A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4
B.硬度由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:Na>Mg>Al
D.晶格能由大到小:NaF>NaCl>NaBr>NaI
解析:A.分子晶体的相对分子质量越大,熔沸点越大,则晶体熔点由低到高顺序为CF4<CCl4<CBr4<CI4,故A正确;
B.键长越短,共价键越强,硬度越大,键长C-C<C-Si<Si-Si,则硬度由大到小为金刚石>碳化硅>晶体硅,故B正确;
C.金属离子的电荷越大、半径越小,其熔点越大,则熔点由高到低为Al>Mg>Na,故C错误;
D.离子半径越小、离子键越强,则晶格能越大,F、Cl、Br、I的离子半径在增大,则晶格能由大到小:NaF>NaCl>NaBr>NaI,故D正确;
故选C。
5.钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,有关说法不正确的是( B )
A.该晶体属于离子晶体
B.晶体的化学式为Ba2O2
C.该晶体晶胞结构与NaCl相似
D.与每个Ba2+距离相等且最近的Ba2+共有12个
解析:Ba是活泼金属,O是活泼非金属形成是离子化合物,A对;根据Ba和O在晶胞的位置,晶胞中共含有Ba的个数为8×1/8+6×1/2=4,O个数为12×1/4+1=4, 所以Ba与O的个数比为1:1,该氧化物为BaO,B错;NaCl晶胞结构也是该形状,C对;与每个Ba2+距离相等且最近的Ba2+为顶点和面心位置,每个晶胞中含有3×1/2个,每个顶点为8个晶胞共有,则共有8×3×1/2=12个,D对,选B。
6.已知食盐的密度为ρ g·cm-3,其摩尔质量为M g·mol-1,阿伏加德罗常数为NA,则在食盐晶体中Na+和Cl-的核间距大约是( B )
A. cm B. cm
C. cm D. cm
解析:已知一个晶胞中有4个“NaCl分子”,且食盐晶体中Na+与Cl-的核间距的2倍正好是晶胞的边长。设晶胞的边长为a,故有×NA=4,解得a=,则= cm。
7.KO2的晶体结构与NaCl相似,KO2可以看作是Na+的位置用K+代替,Cl-的位置用O代替,则下列对于KO2晶体结构的描述正确的是( B )
A.与K+距离相等且最近的O2-共有8个
B.与K+距离相等且最近的O2-构成的多面体是正八面体
C.与K+距离相等且最近的K+有8个
D.一个KO2晶胞中的K+和O粒子数均为8
解析:A.K+位于晶胞棱心,与K+距离相等且最近的O2-位于顶点和面心,共有6个,故A错误;B.与K+距离相等且最近的O2-共有6个,构成正八面体,K+位于正八面体中心,故B正确;C.K+位于晶胞棱心,则被横平面、竖平面和正平面共有,且每一个平面有4个K+距离最近,共4×3=12个,故C错误;D.K+位于晶胞棱心和体心,数目为12×1/4+1=4,O2-位于顶点和面心,数目为8×1/8+6×1/2=4,即一个KO2晶胞中摊得的K+和O2-粒子数均为4个,故D错误;故选B。
二、非选择题
8.下列叙述正确的是__BC____。
A.带相反电荷离子之间的相互吸引称为离子键
B.金属元素与非金属元素化合时,不一定形成离子键
C.某元素的原子最外层只有一个电子,它跟卤素结合时所形成的化学键不一定是离子键
D.非金属原子间不可能形成离子键,只含有非金属元素的化合物不可能是离子化合物
E.离子化合物中一定含有金属元素,含金属元素的化合物一定是离子化合物
F.离子键只存在于离子化合物中,离子化合物中一定含有离子键,不可能含有非极性键
G.强酸、强碱和大多数盐都属于离子化合物
H.离子化合物受热熔化破坏化学键,吸收热量,属于化学变化
I.NaCl和CsCl晶体中,每个离子周围带相反电荷离子的数目分别是6和8,由此可以说明离子键有饱和性
解析:离子键包括阴、阳离子之间的静电引力和静电斥力两个方面,A项错误;金属与非金属元素的电负性相差小于1.7时往往形成共价键,如Al与Cl、Be与Cl(AlCl3、BeCl2是共价化合物)等,B项正确;氢原子最外层只有一个电子,HX中的化学键均为共价键,C项正确;由铵盐是离子化合物可知D、E项均错误;离子化合物中一定含有离子键,还可能含有非极性键,如Na2O2,F项错误;强碱和大多数盐是离子化合物,但强酸(如H2SO4、HNO3、HI等)不属于离子化合物;G项错误;离子化合物受热熔化需破坏(削弱)离子键(静电作用),这个过程属于物理变化,H项错误。离子键没有饱和性和方向性,I项错误。
9.下图表示一些晶体中的某些结构,请回答下列问题:
(1)代表金刚石的是(填编号字母,下同)__D____,其中每个碳原子与__4____个碳原子最近且距离相等。金刚石属于__原子____晶体。
(2)代表石墨的是__E____,每个正六边形占有的碳原子数平均为__2____个。
(3)代表NaCl的是__A____,每个Na+周围与它最近且距离相等的Na+有__12____个。
(4)代表CsCl的是__C____,它属于__离子____晶体,每个Cs+与__8____个Cl-紧邻。
(5)代表干冰的是__B____,它属于__分子____晶体,每个CO2分子与__12____个CO2分子紧邻。
(6)已知石墨中碳碳键的键长比金刚石中碳碳键的键长短,则上述五种物质熔点由高到低的排列顺序为__石墨>金刚石>NaCl>CsCl>干冰____。
解析:根据晶体的结构特点来辨别图形所代表的物质。NaCl晶体是立方体结构,每个Na+与6个Cl-紧邻,每个Cl-又与6个Na+紧邻,每个Na+(或Cl-)周围与它最近且距离相等的Na+(或Cl-)有12个。CsCl晶体由Cs+、Cl-构成立方体结构,但Cs+组成的立方体中心有1个Cl-,Cl-组成的立方体中心又镶入一个Cs+,每个Cl-与8个Cs+紧邻,每个Cs+与8个Cl-紧邻。干冰也是立方体结构,但在立方体的每个正方形面的中央都有一个CO2分子,每个CO2分子与12个CO2分子紧邻。金刚石的基本结构单元是正四面体,每个碳原子紧邻4个其他碳原子。石墨的片层结构由正六边形结构组成,每个碳原子紧邻另外3个碳原子,即每个正六边形占有1个碳原子的,所以平均每个正六边形占有的碳原子数是6×=2。(6)离子晶体的熔点由其离子键的强弱决定,由于半径Na+
能 力 提 升
一、选择题
1.(双选)下列有关晶体结构或性质的描述中正确的是( AD )
A.冰中存在极性键,分子间作用力和氢键
B.因金属性K>Na,故金属钾的熔点高于金属钠
C.各1mol的金刚石与石墨晶体中所含的C-C键的数目相同
D.氧化镁的晶格能大于氯化钠,故其熔点高于氯化钠
解析: A.冰中存在极性键,分子间作用力和氢键,A正确;B.因原子半径:K>Na,故金属钾的熔点低于金属钠,B错误;C.金刚石中C原子形成4个C-C键,1molC形成2mol共价键,石墨中C原子与其它碳形成3个C-C键,1molC形成1.5mol共价键,因此各1mol的金刚石与石墨晶体中所含的C-C键的数目不相同,C错误;D.氧化镁的晶格能大于氯化钠,故其熔点高于氯化钠,D正确,答案选AD。
2.北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子化合物,具有良好的超导性。下列有关分析正确的是( C )
A.K3C60中只有离子键
B.K3C60中不含共价键
C.该晶体在熔融状态下能导电
D.C60与12C互为同素异形体
解析:K3C60中K+与C之间为离子键,C中的C—C键为共价键,A、B错误;K3C60为离子化合物,在熔融状态下能导电,C正确;C60为单质,12C为原子,而同素异形体为同种元素形成的不同单质,二者不属于同素异形体,D错误。
3.有关晶体的结构如图所示,则下列说法中不正确的是( D )
A.在NaCl晶体中,距Na+最近的Cl-形成正八面体
B.在CaF2晶体中,每个晶胞平均占有4个Ca2+
C.在金刚石晶体中,碳原子与碳碳键的个数比为1︰2
D.该气态团簇分子的分子式为EF或FE
解析:A.氯化钠晶体中,距Na+最近的Cl-是6个,即钠离子的配位数是6,6个氯离子形成正八面体结构,A正确;B.Ca2+位于晶胞顶点和面心,数目为8×+6×=4,即每个晶胞平均占有4个Ca2+,B正确;C碳碳键被两个碳原子共有,每个碳原子形成4条共价键,即平均1 mol C原子形成4×=2 mol碳碳键,碳原子与碳碳键的个数比为1︰2,C正确;D.该气态团簇分子不是晶胞,分子式为E4F4或F4E4,D错误。
4.下表中列出了有关晶体的说明,错误的是( B )
选项
A
B
C
D
晶体名称
氯化钾
氩
白磷(P4)
烧碱
构成晶体
微粒名称
阴、阳
离子
原子
分子
阴、阳离子
晶体中存在
的作用力
离子键
共价键、
范德华力
共价键、
范德华力
离子键、
共价键
解析:A.氯化钾为离子晶体,构成微粒为离子,构成晶体粒子间的作用力为离子键,A正确;B.氩为单原子分子,原子间没有共价键,B错误;C.白磷为分子晶体,构成微粒为分子,分子内原子之间以共价键结合,分子之间的作用力为范德华力,C正确;D.烧碱(NaOH)为离子晶体,含有离子键和共价键,构成微粒为阴、阳离子,D正确。
5.(2018·山西重点中学高三考试)有下列离子晶体空间结构示意图:●为阳离子,○为阴离子。以M代表阳离子,N代表阴离子,化学式为MN2的晶体结构为 ( B )
解析:A、阳离子位于顶点和面心,晶胞中总共含有阳离子数目为8×+6×=4,1个阴离子位于体心,为晶胞所独有,故晶胞中含有的阴离子数目为1,则阳离子和阴离子的比值为4︰1,化学式为M4N,故A错误;B、有4个阳离子位于顶点,晶胞中平均含有阳离子数目为4×=,1个阴离子位于体心,为晶胞所独有,故晶胞中含有的阴离子数目为1,则阳离子和阴离子的比值为︰1=1︰2,化学式为MN2,故B正确;C、有3个阳离子位于顶点,晶胞中平均含有阳离子数目为3×=,1个阴离子位于体心,为晶胞所独有,故晶胞中含有的阴离子数目为1,则阳离子和阴离子的比值为︰1=3︰8,化学式为M3N8,故C错误;D、有8个阳离子位于顶点,晶胞中平均含有阳离子数目为8×=1,1个阴离子位于体心,为晶胞所独有,故晶胞中含有的阴离子数目为1,则阳离子和阴离子的比值为1:1,化学式为MN,故D错误;故选B。
二、非选择题
6.参考下表中物质的熔点,回答下列问题。
物质
NaF
NaCl
NaBr
NaI
NaCl
KCl
熔点(℃)
995
801
755
651
801
776
物质
RbCl
CsCl
SiF4
SiCl4
SiBr4
SiI4
熔点(℃)
715
646
-90.4
-70.2
5.2
120
物质
SiCl4
GeCl4
SbCl4
PbCl4
熔点(℃)
-70.2
-49.5
-36.2
-15
(1)钠的卤化物及碱金属氯化物的熔点与卤离子及碱金属离子的__半径____有关,随着__半径____增大,熔点依次降低。
(2)硅的卤化物及硅、锗、锡、铅的氯化物熔点与__相对分子质量____有关,随着__相对分子质量____增大,__分子间作用力____增强,熔点依次升高。
(3)钠的卤化物的熔点比相应的硅的卤化物的熔点高得多,这与__晶体类型____有关,因为一般__离子晶体____比__分子晶体(本题主要考查物质熔沸点的高低与晶体类型和晶体内部微粒之间作用力的关系以及分析数据进行推理的能力____熔点高。
解析:(1)表中第一栏和第二栏RbCl、CsCl的熔点明显高于第二、三栏其余物质的熔点,前者为ⅠA族元素与ⅦA族元素组成的离子晶体,而后者为分子晶体。
(2)分析比较离子晶体熔点高低的影响因素:
物质熔化实质是减弱晶体内微粒间的作用力,而离子晶体内是阴、阳离子,因此离子晶体的熔化实际上是减弱阴、阳离子间的作用力——离子键,故离子晶体的熔点与离子键的强弱有关。从钠的卤化物进行比较:卤素离子半径是r(F-)
分子晶体内的微粒是分子,因此分子晶体的熔点与分子间的作用力有关。从硅的卤化物进行比较:硅的卤化物分子具有相似的结构,从SiF4到SiI4相对分子量逐步增大,说明熔点随相对分子质量的增加而增大。从硅、锗、锡、铅的氯化物进行比较:这些氯化物具有相似的结构,从SiCl4到PbCl4相对分子质量逐步增大,说明熔点随相对分子质量的增加而增大。
7.A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大。B、C、D同周期,A、D同主族,E和其他元素既不在同周期也不在同主族。B、C、D的最高价氧化物对应水化物均能互相发生反应生成盐和水。A和E可形成离子化合物,其晶胞结构如下图所示。
(1)A和E所形成化合物的电子式是______。
(2)A、B、C、D四种元素的原子半径由小到大的顺序为__F<Cl<Al<Na____(用元素符号表示)。
(3)A和E形成的化合物的晶体中,每个阳离子周围与它最近且距离相等的阳离子共有__12____个。
(4)已知A和E所形成化合物晶体的晶胞体积为1.6×10-22 cm3,则A和E组成的离子化合物的密度为(结果保留一位小数)__3.2_g/cm3____。
解析:由题意知B、C、D分别为Na、Al、S或Na、Al、Cl。E与其他元素不同周期也不同主族,只能为Ca。由晶胞可知A、E形成的离子化合物为EA2,则A为F。即A、B、C、D、E分别为F、Na、Al、Cl、Ca。(1)A、E形成的化合物为CaF2。(2)由同周期元素原子半径变化规律可知原子半径Na>Al>Cl,由同主族元素原子半径变化规律可知原子半径Cl>F。(3)由图可知为12个。(4)ρ==≈3.2 (g/cm3)。
化学选修3 物质结构与性质第一节 晶体的常识教案: 这是一份化学选修3 物质结构与性质第一节 晶体的常识教案,共17页。
高中化学人教版 (新课标)选修3 物质结构与性质第二节 分子晶体与原子晶体教学设计: 这是一份高中化学人教版 (新课标)选修3 物质结构与性质第二节 分子晶体与原子晶体教学设计,共17页。
人教版 (新课标)选修3 物质结构与性质第三节 金属晶体教案: 这是一份人教版 (新课标)选修3 物质结构与性质第三节 金属晶体教案,共20页。