苏教版必修一专题3 从矿物到基础材料综合与测试学案
展开专题3《从矿物到基础材料》知识汇总
一、从铝土矿到铝合金
铝在大自然以稳定的 化合 态存在。
1、从铝土矿中提取铝
⑴铝元素在地壳中含量仅次于 氧 、 硅 ,是地壳中含量最多的金属元素。
⑵工业提取铝涉及的主要反应有 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 、 NaAlO2+CO2+2H2O=Al(OH)3+NaHCO3 、 2Al(OH)3Al2O3+3H2O 、
2Al2O34Al+3O2↑
⑶由于氧化铝的熔点很高,在电解时人们往往会加入 冰晶石 来降低氧化铝的熔点。
2、铝的性质
⑴铝在空气中能表现出良好的抗蚀性是由于 铝的表面有致密的氧化保护膜 。
⑵铝是一种既可以与酸反应又可以与碱反应的金属。(分别写出化学方程式)
2Al+6HCl=2AlCl3+3H2↑ 、 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
⑶在 常温 下,铝(或者铁)遇 浓H2SO4、 浓HNO3 时会在表面生成致密的氧化膜而发生 钝化 。
⑷铝热反应: 2Al+Fe2O3AlCl3+2Fe ,常用于 焊接铁轨
3、氢氧化铝两性(两性氢氧化物)
(1)与盐酸反应 Al(OH)3+3HCl=AlCl3+3H2O 、
(2)与氢氧化钠反应 Al(OH)3+NaOH=Na[Al(OH)4]
⑶ 明矾的净水原理: KAl(SO4)2=K++Al3++2SO42-
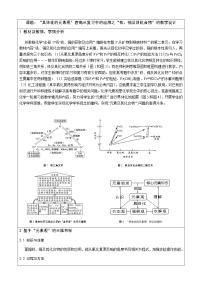
注意的是:①AlCl3中逐滴加入NaOH溶液,反应时可看作是经过两步反应:
第一步:Al3++3OH—═Al(OH)3↓ 第二步:Al(OH)3+OH—═AlO2—+2H2O
生成沉淀的量随加入NaOH溶液的体积变化曲线如右图:
②在NaAlO2溶液中逐滴加入盐酸,也是分两步进行的,先生成Al(OH)3沉淀,盐酸过量时沉淀消失。反应:NaAlO2+HCl(少)+H2O=Al(OH)3+NaCl、Al(OH)3+NaOH=NaAlO2+2H2O
小结:“铝三角”铝盐和偏铝酸盐的相互转化:
反应:①Al3+ + 4OH- = AlO2- + 2H2O
②AlO2-+ 4H+ = Al3+ + 2H2O
③Al(OH)3 + OH- = AlO2- + 2H2O
④AlO2- + H+ + H2O = Al(OH)3
⑤Al3+ + 3OH- = Al(OH)3
⑥Al(OH)3 + 3H+ = Al3+ + 3H2O
二、铁、铜的获取及应用
1、从自然界中获取铁和铜
⑴人类最早使用的的金属有 铁 、 铜 两种。人类经历了青铜器时代和铁器时代。
⑵铁、铜的存在:
人类最早利用的单质铁和单质铜直接来自于自然界。铁单质只存在于从天而降的 陨石 中,而铜则来自于自然存在的少量单质铜。铁和铜在自然界中主要以化合态形式存在。常见的铁矿石有磁铁矿(主要成分是 Fe3O4 )、赤铁矿(主要成分是 Fe2O3 );常见的铜矿石有黄铜矿、孔雀石。
(3)高炉炼铁:
①原料: 铁矿石 、 焦炭 、 空气 、 石灰石 ②设备: 炼铁高炉
③原理: 用还原剂将铁从其化合物中还原出来
主要反应:①还原剂的形成 C+O2CO2 、 CO2+C2CO
②还原铁矿石yCO+FexOyxFe+yCO2
③炉渣的形成 CaCO3CaO+CO2↑ 、 CaO+SiO2CaSiO3
④石灰石的作用是: 除去铁矿石中的炉渣 ,
反应为 CaCO3CaO+CO2↑ 、 CaO+SiO2CaSiO3
要求理解:一氧化碳的形成、高炉中各进出口的流经的物质(祥细见教材P70图3-11)
⑤在高炉中最终得到是含碳 2%—4.5% 的 生铁 ;钢的含碳量为 0.03%—0.2% 。因此从这层含义上讲生铁和钢都是铁的合金。
(4)铜的冶炼:①火法炼铜②湿法炼铜:其原理是_CuSO4+Fe=FeSO4+Cu _③生物炼铜
2、铁、铜及其化合物的应用
⑴铁、铜物理性质比较:
不同点:铁——银白色,质软,易被磁化 ; 铜——紫红色,导电性比铁好
⑵铁、铜化学性质:
| 铁 | 铜 | |
与非金属单质 | 与Cl2 | 2Fe + 3Cl22FeCl3 | Cu+ Cl2 CuCl2 |
与硫 | Fe + SFeS | 2Cu +S Cu2S | |
与酸 | 与HCl | Fe+2HCl=FeCl2+H2↑ | 不反应 |
离子方程式4 | Fe+2H+ = Fe2+ + H2↑ | 不反应 | |
与金属的盐溶液 | CuSO4+Fe=FeSO4+Cu | Cu+2AgNO3=Cu(NO3)2+Ag | |
与浓硫酸、硝酸 | 在常温下遇浓硫酸、浓硝酸发生钝化 | 在加热条件下可与浓硫酸反应(P95)常温下可与硝酸反应(P101) | |
铁和铜在一定条件下可以与某些非金属、酸和盐溶液等发生反应,铁、铜在反应中充当还原剂。铁、铜与氧化性较弱的氧化剂(如S 、I2)反应转化为 +2 价铁的化合物,而与氧化性较强的氧化剂(如 氯气、氧气 等)反应转化为 +3 价铁的化合物。
⑶Fe3+的检验:加入 KSCN 溶液,现象:溶液呈血红色 ,方程式 Fe3+ + 3SCN-=Fe(SCN)3
⑷由Fe2+转化为Fe3+ 2Fe2++Cl2=3Fe3++2Cl-
⑸由Fe3+转化为Fe2+ Fe+2Fe3+=3Fe2+
⑹Fe+H2O(g)Fe3O4+4H2↑
小结:“铁三角”
Fe、Fe2+、Fe3+的相互转化
请写出相应的离子方程式:
①Fe+2H+=Fe3++H2↑
②FeO+CO=Fe+CO2
③Fe+2Fe3+=3Fe2+
④2Fe2++Cl2=3Fe3++2Cl-
⑤2Fe+3Cl22FeCl3
⑥Fe2O3+2AlAl2O3+2Fe-
3、Fe2+、Fe3+的检验
⑴Fe2+的检验
① 滴加NaOH溶液,先产生白色沉淀,随后沉淀迅速变为灰绿色,最后为红褐色。
Fe2++2OH-=Fe(OH)2↓(白色) 4Fe(OH)2+O2+2H2O=4Fe(OH)3(红褐色)
② 先滴加KSCN无色溶液,无明显现象,再加入新制氯水,溶液立即变红色。
2Fe3++Cl2=2Fe3++2Cl- Fe3++3SCN-=Fe(SCN)3
⑵Fe3+的检验
① 滴加KSCN无色溶液,溶液变血红色。
Fe3++3SCN-=Fe(SCN)3
② 滴加NaOH溶液,产生红褐色沉淀。
Fe3++3OH-=Fe(OH)3↓ (红褐色)
⑶Fe2+、Fe3+的鉴别
①观察法:Fe2+盐溶液呈 浅绿 ,Fe3+盐溶液呈 黄
②KSCN法:滴入KSCN无色溶液,溶液呈 血红色 者是Fe3+溶液, 无明显变化 者是Fe2+溶液
③碱液法:分别加入碱液(氨水也可), 形成沉淀是红褐色 是Fe3+, 形成白色沉淀,后变灰褐色,最后变为红褐色 是Fe2+溶液
①在配制含Fe2+的溶液时,常常向溶液中加入少量的 铁粉 ,目的是 使被氧化成Fe3+ 的与Fe反应还原成Fe2+
应 ②为除去废水中的Fe2+,常先将废水中的 Fe2+氧化成Fe3+ ,再调节溶液的 PH值 Fe3+转化为 Fe(OH)2 析出。
用 ③在制作印刷电路板的过程中常利用铜与氯化铁溶液的反应,方程式为 2Fe3++Cu=2Fe2++Cu2+
④铁及铜的化合物的应用:见教材的P74相关内容
2020-2021学年第二单元 化学能与电能的转化学案及答案: 这是一份2020-2021学年第二单元 化学能与电能的转化学案及答案,共8页。
高中化学重点知识点汇总学案: 这是一份高中化学重点知识点汇总学案,共59页。
高三化学一轮复习重点知识汇总学案: 这是一份高三化学一轮复习重点知识汇总学案,共10页。