高中化学第一单元 从铝土矿到铝合金教案
展开专题3 从矿物到基础材料
第一单元 从铝土矿到铝合金
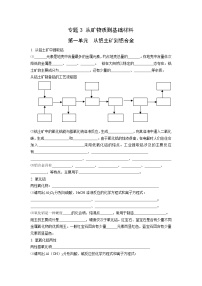
铝的制取
①溶解:Al2O3+2NaOH === 2NaAlO2+H2O
②过滤:除去杂质
③酸化:NaAlO2+CO2+2H2O === Al(OH)3↓+NaHCO3
④过滤:保留氢氧化铝
⑤灼烧:2Al(OH)3 ======= 4Al+3O2↑
铝合金特点:1、密度小2、强度高3、塑性好4、制造工艺简单5、成本低6、抗腐蚀力强
铝的化学性质
(1) 与酸的反应:2Al + 6HCl = 2AlCl3 + 3H2↑
(2) 与碱的反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑
第一步:2Al+6H2O= 2Al(OH)3+3H2↑
第二步:Al(OH)3+NaOH=NaAlO2+2H2O
★ 总方程式: 2Al+2NaOH+6H2O=2NaAlO2+ 4H2O +3H2↑
(3) 钝化:在常温下,铝与浓硝酸、浓硫酸时会在表面生成致密的氧化膜而发生钝化,不与浓硝酸、浓硫酸进一步发生反应。
(4) 铝热反应:
2Al + Fe2O3 === 2Fe + Al2O3
铝热剂:铝粉和某些金属氧化物(Fe2O3、FeO、Fe3O4、V2O5、Cr2O3、MnO2)组成的混合物。
氧化铝的化学性质(两性氧化物)
氧化铝的用途
高硬度、熔点高,常用于制造耐火材料
氢氧化铝(两性氢氧化物)
(1) 与酸的反应:Al(OH)3 + 3HCl = AlCl3 + 3H2O
(2) 与碱的反应:Al(OH)3 + NaOH = NaAlO2 + 2H2O
氯化铝的制取:
氯化铝与氨水反应 AlCl3+3NH3H2O=Al(OH)3↓+NH4Cl3
氯化铝与氢氧化钠溶液反应 AlCl3+3NaOH=Al(OH)3↓+3NaCl
AlCl3+4NaOH=NaAlO2+2H2O+3NaCl
苏教版必修一专题2 从海水中获得的化学物质第一单元 氯、溴、碘及其化合物教学设计: 这是一份苏教版必修一专题2 从海水中获得的化学物质第一单元 氯、溴、碘及其化合物教学设计,共2页。
化学必修一第二单元 钠、镁及其化合物教案设计: 这是一份化学必修一第二单元 钠、镁及其化合物教案设计,共4页。
必修一第一单元 从铝土矿到铝合金教案: 这是一份必修一第一单元 从铝土矿到铝合金教案,共2页。