

高中化学第二单元 钠、镁及其化合物教学设计及反思
展开第二单元 钠、镁及其化合物
第一课时 金属钠的性质与应用
教学目标:
1. 能够说出金属钠的物理性质
2. 能够准确描述并识记钠与氧气、氯气、水反应的实验现象,能对一些现象作出解释。
3. 能够正确书写有关钠反应的化学方程式。
4. 能够运用金属钠的性质来解决一些简单问题。
5. 培养学生根据实验现象探究、分析、推理和判断的能力。
教学重点:钠化学的性质。
教学难点:钠与水反应实验现象的观察和分析,Na2O2的氧元素的化合价。
教学用具:学生实验用品(四人一组):钠、玻片、小刀、镊子、滤纸、盛有水的小烧杯、酚酞。
教师演示用品:除学生实验用品外,酒精灯、火柴、石棉网、铁架台(附铁圈)、玻璃钠柱、集气瓶、玻璃棉。
教学过程:
[情境问题]: 若干神秘“水雷”惊现珠江。
• 2002年7月7日,一条船在珠江某处掉下七个金属桶。突然,一个金属桶冒起一股白烟,窜出黄色火苗,紧接着一声巨响,“没想到水里的东西也能着火爆炸。”一位妇女惊讶地说。还有许多未燃尽的白烟飘进旁边的公司内,这些灰白色的物体一遇到水就在水面不停地冒泡,有时甚至还突然着火。
问题:1.金属桶内装的是什么?
• 2.为什么会发生爆炸?
[板书]: 金属钠的性质与应用
[活动与探究]:
学生:分组实验,认真记录实验现象,填入下表。
教师:提示学生实验注意事项,指导学生观察的方法。
实验 | 注意事项 | 观察与思考 |
实验1:钠与氧气反应 | 1.手切勿与钠接触 2.取出的钠先用滤纸吸干表面物质 3.钠块取黄豆大小 4.剩余的钠块立即放回试剂瓶中 | 金属表面的颜色变化_______ 为什么会变暗? |
实验2:钠在氧气中燃烧 | 钠的状态、火焰颜色、生成物的颜色________________ 生成物是什么? | |
实验4:钠与水反应 | 钠投入水中后的位置、形状、运动情况、 溶液颜色变化、有无响声_________________ 思考:说明钠的哪些性质? |
[交流与讨论]:
学生:分组讨论,统一观察到的现象,对这些现象进行解释,填写P48页表2-5
教师:组织学生交流,在学生回答后多媒体呈现实验现象和解释,对学生的答案进行校正。
实验 | 实验现象 |
|
实验1:钠与氧气反应 | 由银白色变暗
| 4Na+O2 = 2Na2O |
实验2:钠在氧气中燃烧 | 熔化成光亮的小球→剧烈燃烧火焰黄色,→淡黄色固体 | 点燃 2Na+O2 == Na2O2 |
实验4:钠与水反应 | 浮在水面上,熔成光亮的小球,迅速游动嘶嘶声,滴有酚酞的溶液变红 | 2Na+2H2O == 2NaOH + H2↑ |
[观察与思考]:老师演示实验3,引导学生观察并思考如下问题:
观察:火焰的颜色、烟的颜色
思考:烟是什么物质?
实验内容 | 实验现象 | 结论或化学方程式 |
钠与氯气的反应 | 产生白色固体(白烟)。 | 点燃 2Na+Cl2 == 2NaCl |
教师在学生回答完毕后,多媒体呈现答案,并进行评讲校对。
[交流讨论]:钠的用途
让学生联系自己的生活实际说一说所了解关于钠的用途,然后对其进行总结。在此基础上补充如下用途。
1. 制备Na2O2(说明过氧化钠用在呼吸面具中)
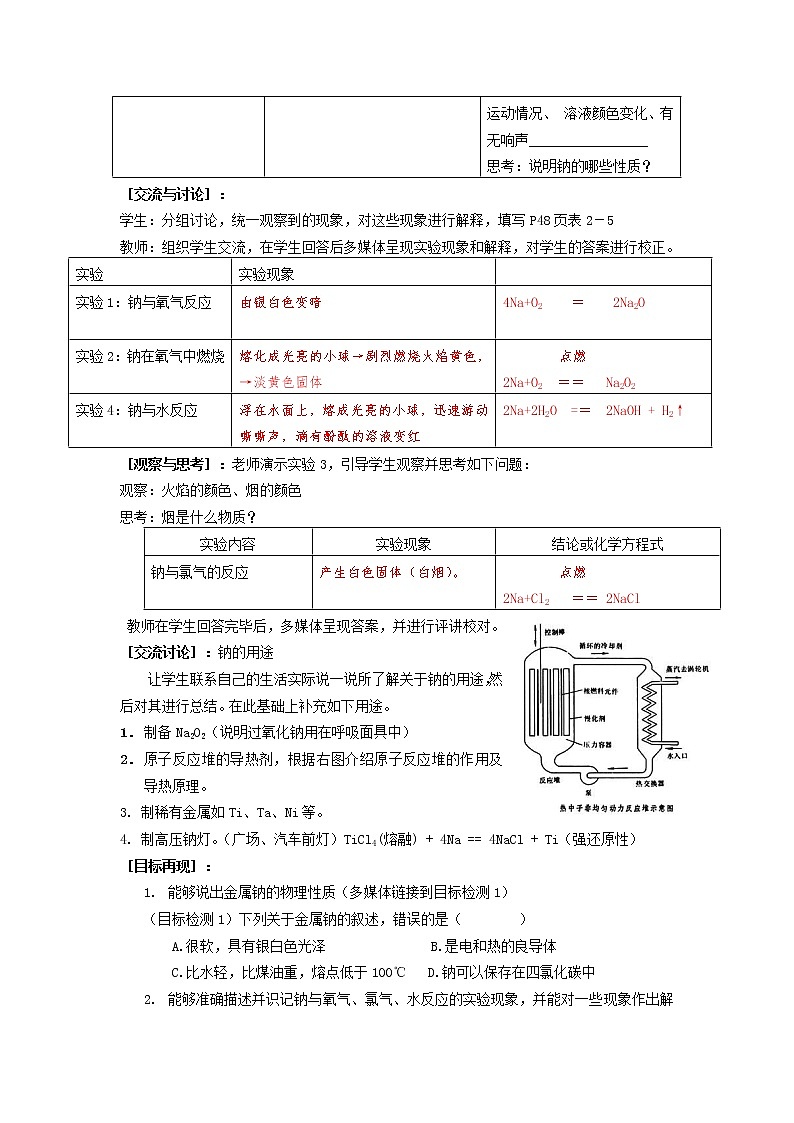
2. 原子反应堆的导热剂,根据右图介绍原子反应堆的作用及导热原理。
3. 制稀有金属如Ti、Ta、Ni等。
4. 制高压钠灯。(广场、汽车前灯)TiCl4(熔融) + 4Na == 4NaCl + Ti(强还原性)
[目标再现]:
- 能够说出金属钠的物理性质(多媒体链接到目标检测1)
(目标检测1)下列关于金属钠的叙述,错误的是( )
A.很软,具有银白色光泽 B.是电和热的良导体
C.比水轻,比煤油重,熔点低于100℃ D.钠可以保存在四氯化碳中
- 能够准确描述并识记钠与氧气、氯气、水反应的实验现象,并能对一些现象作出解释。(链接目标检测2)
(目标检测2)取一小块金屑钠放在燃烧匙里加热,下列实验现象,描述正确是( )
①金属先熔化;②在空气中燃烧,放出黄色火花;③燃烧后得白色固体;④燃烧时火焰为黄色;⑤燃烧后生成浅黄色固体物质。
A.①② B.①②③ C.①④⑤ D.④⑤
- 能够正确书写有关钠反应的化学方程式
- 能够运用金属钠的性质来解决一些简单问题(链接到问题解决)
[问题解决]若干神秘“水雷”惊现珠江。
2002年7月7日,一条船在珠江某处掉下七个金属桶。突然,一个金属桶冒起一股白烟,窜出黄色火苗,紧接着一声巨响, “没想到水里的东西也能着火爆炸。”还有许多未燃尽的白烟飘进旁边的公司内,这些灰白色的物体一遇到水就在水面不停地冒泡,有时甚至还突然着火。
问题:
1金属桶内装的是什么?说出你的推断依据。
2.为什么会爆炸?写出有关的化学方程式。
教师:待学生完成后在原文中标出依据的现象(变体字部分),评讲钠与水反应的方程式。
[作业]:市教研室教学质量检测讲义 专题2 第二单元 第一课时(第10题不做)
[板书设计]: 金属钠的性质与应用
一、钠的性质
1.钠的物理性质
银白色、有金属光泽的固体,热、电的良导体,质软、密度小、熔点低。
2.钠的化学性质 (强还原性)
结构:
Na → Na+
二、钠的用途
Na—K合金用做原子反应堆的导热剂; 制稀有金属如Ti、Ta、Ni等;
制高压钠灯; 制过氧化物。
三、钠的工业制法
[教学反思]:
这节课是参加市新苗大赛的老师上的,其中有很多值得学习的东西,尤其是教学设计和实验改进方面。
在教学设计方面,有根据“珠江水雷事件”设计成探究式教学模式,有的是用水取火的趣味实验引入,效果都很好。
在实验改进方面,有的将氯气依据瓶倒扣在熔化的钠上,有的将钠用大头针在固定在试管塞上,用试管来制取氯气,生成的氯气与钠反应。
第二课时 碳酸钠的性质与应用
教学目标:
1. 识记Na2CO3与CaCl2溶液,稀盐酸、石灰水反应的现象,能够正确写出反应的方程式。
2. 知道Na2CO3溶液的酸碱性及用途。
3. 对比实验的方法探究碳酸钠、碳酸氢钠的性质差异。
4.能用方程式表示碳酸钠、碳酸氢钠的相互转化。
5.通过对侯氏制碱法的学习,培养爱国主义思想,树立努力学习为国争光的志向。
教学重点:
碳酸钠、碳酸氢钠的性质差异。
教学难点:
碳酸氢钠与盐酸、氢氧化钙反应。
教学用具:
试管、滴管、集气瓶、铁夹子、Na2CO3、NaHCO3、CaCl2溶液,稀盐酸、石灰水、铜片。
教学过程:
[引言]:三酸(盐酸、硫酸、硝酸)两碱(纯碱、烧碱)的产量是衡量一个国家无机化工发展水平的标志之一,纯碱在玻璃、肥皂、合成洗涤剂、造纸、纺织、石油、冶金、食品等工业中有着广泛的应用。 本节课我们来学习有关碳酸钠、碳酸氢钠的性质、用途和制法等知识。
[板书]: 碳酸钠的性质与应用
一、碳酸钠的性质
[教师]:日常生活中,我们蒸馒头要用发酵粉,大家知道发酵粉中含有哪些成分吗?
(展示Na2CO3、NaHCO3粉末),这就是发酵粉中所含的两种物质。下面,我们就来学习它们的性质。请大家阅读教材50页,完成有关活动与探究内容。
[活动与探究1]:在两支洁净的试管中分别加入2---3mL澄清的石灰水和氯化钙溶液 ,再分别向两支试管中滴加碳酸钠溶液,振荡,观察实验现象。
[活动与探究2]:按图2---11所示组装仪器,将滴管中的浓盐酸滴入瓶中,观察实验现象。
[活动与探究3]:用PH试纸测定碳酸钠溶液的PH值。
[活动与探究4]:在一只烧杯中加入50mL0.5moL/L碳酸钠溶液,用酒精灯将碳酸钠溶液加热至接近沸腾。将一块有油污的铜片浸入碳酸钠溶液中,静置2min。用镊子将铜片从溶液中取出后,用水冲洗干净。比较浸入碳酸钠溶液前后铜片表面的情况。
填写好实验报告:
实验内容 | 实验现象 | 结论或方程式 |
在两支洁净的试管中分别加入2---3mL澄清的石灰水再分别向两支试管中滴加碳酸钠溶液,碳酸氢钠溶液,振荡,观察实验现象。 |
均有白色沉淀产生 | Na2CO3 + Ca(OH)2 === CaCO3 ↓ + 2NaOH NaHCO3 + Ca(OH)2 === CaCO3 ↓ + NaOH + H2O
|
在两支洁净的试管中分别加入2---3mL氯化钙溶液 ,分别向两支试管中滴加碳酸钠溶液,碳酸氢钠溶液,振荡,观察实验现象。 | 碳酸钠溶液有白色沉淀 碳酸氢钠没有 | Na2CO3 + CaCl2 === CaCO3 ↓ + 2NaCl |
按图2---11所示组装仪器,将滴管中的浓盐酸滴入瓶中,观察实验现象。 | 加入盐酸,碳酸钠溶液有气泡产生,气球体积膨胀。 | Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑ NaHCO3 + HCl === 2NaCl + H2O + CO2↑
|
用PH试纸测定碳酸钠溶液的PH值。 | PH>7 | 水溶液显碱性 |
在一只烧杯中加入50mL0.5moL/L碳酸钠溶液,用酒精灯将碳酸钠溶液加热至接近沸腾。将一块有油污的铜片浸入碳酸钠溶液中,静置2min。用镊子将铜片从溶液中取出后,用水冲洗干净。比较浸入碳酸钠溶液前后铜片表面的情况。 |
铜片上的油污去掉,变得光亮 |
水溶液显碱性,能除去油污 |
[讨论与思考]:碳酸钠俗称纯碱或苏打,而碳酸氢钠俗称小苏打,两者在一定的条件下可以相互转化。请同学们思考,写出二者相互转化的化学方程式。(让学生到黑板前写出化学方程式。)
Na2CO3 + CO2 + H2O ==== 2NaHCO3
2NaHCO3=====Na2CO3+CO2↑+H2O
[板书]:二、碳酸钠与碳酸氢钠的性质比较
[活动与探究]:请同学们根据表2---6提供的信息,设计区别碳酸钠和碳酸氢钠的实验方案。
性质 | Na2CO3 | NaHCO3 | 性质比较 |
水溶性 | 易溶 | 易溶 | 相同温度下Na2CO3 的溶解度大于NaHCO3 |
溶液的酸碱性 | 碱性 | 碱性 | 物质的量浓度相同时溶液的PH:Na2CO3 >NaHCO3 |
热稳定性 | 稳定 | 不稳定 | NaHCO3受热分解生成Na2CO3、H2O、CO2 |
与酸反应 | 反应 | 反应 | 都放出CO2气体,但NaHCO3与酸反应的剧烈程度强于 Na2CO3 |
[学生]:讲述自己设计的实验方案,同学和教师共同评价。
[方案]:利用Na2CO3与NaHCO3的热稳定性差别,加热固体,根据现象不同,鉴别二者......(演示实验)
[归纳总结]:学生自己 Na2CO3和NaHCO3的用途。
[补充实验]:在Na2CO3与NaHCO3的溶液中分别滴加BaCl2,观察实验现象。
[信息提示]:碳酸盐的正盐除Na+、K+、NH外,多数是不溶于水的,而碳酸盐中的酸式盐却都溶于水,鉴别Na2CO3与NaHCO3溶液时,我们即可据此用BaCl2或CaCl2做试剂来进行鉴别。
[板书]:三、侯德榜制碱法生产原理(学生阅读教材52页内容,自己总结。)
NaCl+ CO2 + H2O + NH3 ==== NaHCO3 + NH4Cl
2NaHCO3=====Na2CO3+CO2↑+H2O
[讲解]:简单介绍侯德榜制碱法的意义和现代化工生产中的地位。
[小结]:本节课我们重点讲了Na2CO3和NaHCO3的性质及差异和,了解了侯德榜制碱法生产原理及意义。
[作业]:市教研室教学质量检测讲义 专题2 第二单元 第二课时
[板书设计]: 碳酸钠的性质与应用
一、 碳酸钠与碳酸氢钠的性质比较
性质 | Na2CO3 | NaHCO3 | 性质比较 |
水溶性 | 易溶 | 易溶 | 相同温度下Na2CO3 的溶解度大于NaHCO3 |
溶液的酸碱性 | 碱性 | 碱性 | 物质的量浓度相同时,Na2CO3 溶液的PH比 NaHCO3溶液的大 |
热稳定性 | 稳定 | 不稳定 | NaHCO3受热分解生成Na2CO3、H2O、CO2 |
与酸反应 | 反应 | 反应 | 都放出CO2气体,但NaHCO3与酸反应的剧烈程度强于 Na2CO3 |
与氢氧化钙反应 | 反应 | 反应 | 均生成CaCO3沉淀 |
与氯化钙反应 | 反应 | 不反应 |
|
二、碳酸钠与碳酸氢钠相互转化
Na2CO3 + CO2 + H2O ==== 2NaHCO3
2NaHCO3=====Na2CO3+CO2↑+H2O
[教学反思]:
1.本节课我们对教材稍作加工,利用比较归纳法学习NaHCO3、Na2CO3 的性质,不仅有利于知识的结构化,更重要的是交给学生比较归纳的方法。从作业反馈来看,效果较好。
2.补充了NaHCO3与Ca(OH)2 、CaCl2 、HCl的反应。但没有补充与NaOH的反应,这几个反应都有一定的难度,以后还要多巩固复习。
3.我们在教学中深切地感到新课程教学中教师知识的条理化显得尤其重要,因为教材中的知识排列不再象老教材那么有条理,而知识缺少条理化不利于学生知识的内化和提取。但正是因这缺少统一的标准,我们感到知识的条理化有一定难度,各人对教材的理解不同,所条理化的结果就不相同。
第三课时 离子反应
教学目标:
1.了解强电解质和弱电解质的概念,识记常见的弱电解质。
2.能够书写弱电解质的电离方程式
3.了解离子反应的实质,能够正确书写离子方程式。
4.培养学生通过实验分析问题、归纳问题的能力,培养探究事物规律的意识。
教学重点:
离子反应的实质和离子反应方程式的书写。
教学难点:
离子反应方程式的书写方法。
教学方法:
实验探究、交流讨论。
教具准备:
电解质溶液导电性实验的仪器和装置一套。
0.1 mol·L-1的HCl、NaOH、NH3·H2O、CH3COOH溶液和H2O。
教学过程:
[复习检查]:回顾化学反应的分类知识。
[投影]:
1.下列属于电解质的是
A C2H5OH B SO3 C H2SO4 D BaSO4
E HClO F Al2O3 G Ba(OH)2 H Fe
2.写出下列电离方程式
(1)H2SO4 (2)Na2CO3 (3)HClO (4)NaHCO3
根据学生的练习情况进行评讲复习有关知识,强调以下几点:
1.电解质:在水溶液里或熔化状态下能够导电的化合物,如酸、碱、盐常见的金属氧化物
非电解质:在水溶液里和熔化状态下都不导电的化合物,如蔗糖、酒精等
2.HClO的电离是可逆的
3.NaHCO3电离生成Na+和 HCO3-。
[板书]: 离子反应
二、强电解质和弱电解质
[活动与探究]:观察5个灯泡的亮度并思考原因。
在4只相同的小烧杯中分别加入50mL物质的量浓度均为0.1moL/L的HCl、NaOH、NH3·H2O、CH3COOH溶液。接通电源,观察四种电解质溶液的导电性是否相同(灯泡的亮度)?并分析原因。
[学生]:HCl、NaOH溶液的灯泡明亮,NH3·H2O、CH3COOH溶液的灯泡暗。
[教师]:请同学们分析原因。
[学生]:电解质溶液靠自由移动的离子导电,可能它们的离子浓度不同。
[教师]:分析的很正确。相同条件下,不同的电解质溶液的导电能力不相同。电解质溶液导电能力的大小决定于溶液中自由移动的离子的浓度和离子所带电荷数。而当溶液体积、浓度和离子所带的电荷数都相同的情况下,取决于溶液中自由移动离子数目,导电能力强的溶液里的自由移动的离子数目一定比导电能力弱的溶液里的自由移动的离子数目多。HCl和NaOH溶于水后完全电离。
[板书]:HCl ==== H+ + Cl- NaOH ==== Na+ + OH-
[教师]:NH3·H2OH和CH3COOH的电离是不完全的。
板书]:CH3COOH H+ + CH3COO- NH3·H2O NH4+ + OH-
[设问]:溶液中自由移动的离子多少跟什么因素有关?(电解质的电离程度)
[板书]:1.强电解质:在水溶液中全部电离成离子的电解质。如NaCl、NaOH等(写出电离方程式)
2.弱电解质:在水溶液中只一部分电离成离子的电解质。如NH3·H2O、CH3COOH等。
3.强弱电解质的区别。
[小结]:强弱电解质的比较
强电解质:完全电离 强碱、强酸、大多数盐
弱电解质:部分电离 醋酸、氨水、水、HClO 、碳酸等
[讨论]:BaSO4、CaCO3、AgCl等难溶于水的盐是否属电解质?CH3COOH易溶,是否属强电解质?
[小结]:BaSO4、CaCO3、AgCl虽然难溶,但溶解的极少部分却是完全电离,所以它们为强电解质H3COOH体易溶于水,但它却不能完全电离,所以属弱电解质。因此,电解质的强弱跟其溶解度无必然联系,本质区别在于它们在水溶液中是否完全电离。
[投影总结]
[过渡]:电解质在水溶液里电离,电解质在水溶液中反应情况如何呢?下面学习离子反。应
[板书]:三、离子反应
[教师]:在上一节课我们做过Na2CO3溶液与澄清的石灰水和CaCl2溶液反应的实验,各有什么现象?
[学生]:都生成白色沉淀。
[教师]:白色沉淀都是CaCO3,这两个反应的本质是Ca2+与CO32-之间发生反应,产生CaCO3沉淀。
[板书]:1、离子反应:有离子参加的化学反应称为离子反应。
[教师]:两个反应的实质都可以用Ca2+ + CO32- ==== CaCO3↓来表示,这种式子称为离子方程式。
[板书]:2、离子方程式:用实际参加反应的离子符号表示化学反应的式子叫做离子方程式。
[教师]:如何书写离子方程式呢?
多媒体展示:离子方程式的书写
离子方程式的书写通常分四步进行,以碳酸钠溶液和盐酸的反应为例说明:
(1).写出反应的化学方程式。Na2CO3 + 2HCl ==== 2NaCl + CO2 ↑+ H2O
(2).把溶于水且完全电离的物质写成离子形式,难溶于水或溶于水但难电离的物质仍用化学式表示。2Na+ + CO32- + 2H+ + 2Cl- ==== 2Na+ + 2Cl- + CO2 ↑+ H2O
(3).删去化学方程式两边不参加反应的离子。CO32- + 2H+ ==== CO2 ↑+ H2O
(4).检查离子方程式两边各元素的原子数目和离子所带是电荷总数是否相等。
[板书]: 3.离子方程式的书写:写、拆、删、查
[小结]:1.四步中,“写”是基础,“拆”是关键,“删”是途径,“查”是保证。
既然拆是关键,拆时应注意作出准确判断,易溶、易电离物质应拆,难溶、难电离物质、气体、单质仍写化学式。
2.沉淀物要用“↓”,气体物质要用“↑”符号标明。
3.离子反应发生的条件:生成难溶物、难电离物或易挥发性物。
[问题解决]:完成下列反应的离子方程式(分三组)。
(1)、盐酸和氢氧化钠溶液反应。
(2)、硫酸和氢氧化钾溶液反应。
(3)、碳酸钠溶液和醋酸溶液反应。
(4)、大理石和盐酸反应。
[总结]:(1)、H++OH-====H2O
(2)、H++OH-====H2O
(3)、CO32- + 2 CH3COOH ==== 2CH3COO- + CO2 ↑+ H2O
(4)、CaCO3 + 2H+ ==== Ca2+ + CO2 ↑+ H2O
[分析]:以上(1)、(2)两个反应的离子方程式都是H++OH-====H2O ,所以说离子方程式能表示同一类化学反应(离子反应的实质)。
课堂小结:本节学习了电解质、非电解质、强电解质、弱电解质等概念,学习了离子反应和离子方程式的书写、意义,还有离子反应发生的条件。其中离子方程式的书写是一难点,又是重要的化学用语,能够正确书写离子方程式,将为化学学习带来众多方便。请同学们加强练习,尽早熟练掌握这部分知识。
布置作业:市教研室教学质量检测讲义 专题2 第二单元 第三课时。
板书设计: 离子反应
一、电解质和非电解质
二、强电解质和弱电解质
强电解质:在水溶液中全部电离成离子的电解质。
弱电解质:在水溶液中只一部分电离成离子的电解质。
三、离子反应
1.离子反应:有离子参加的化学反应。
2.离子方程式:用实际参加反应的离子符号来表示化学反应的方程式。
3.离子方程式的书写:写、拆、删、查
4.离子方程式的意义:离子方程式能表示同一类化学反应。
5.离子反应发生的条件:生成难溶物、难电离物或易挥发性物。
教学反思:
1.本节首先暴露出自己的教学机智有待提高,在检查复习环节中由于要求学生写7个方程式花了多达十分钟,然后仍然习惯性的找学生复述上节课的内容,结果不仅显得重复没必要,而且占用太多的时间,以至于后面的离子方程式程的书写教学太匆忙,而离子方程式又是本节课的教学重点和难点。
2.教学中时间观念不强,缺少预先计划,总是先松后紧,在一些次要的问题上如可逆反应、水的电离方程式等花的时间太多,以后要加强时间计划。
化学必修一专题2 从海水中获得的化学物质第二单元 钠、镁及其化合物教案设计: 这是一份化学必修一专题2 从海水中获得的化学物质第二单元 钠、镁及其化合物教案设计,共2页。
化学苏教版专题2 从海水中获得的化学物质第二单元 钠、镁及其化合物教案: 这是一份化学苏教版专题2 从海水中获得的化学物质第二单元 钠、镁及其化合物教案,共2页。
高中化学第二单元 钠、镁及其化合物教学设计: 这是一份高中化学第二单元 钠、镁及其化合物教学设计,共5页。













