

人教版 (新课标)选修3 物质结构与性质第一节 共价键教案及反思
展开江苏省兴化楚水实验学校高二化学集体备课教案
科目 | 化 学 | 年级 | 高二 | 班级 |
| 时间 |
| ||
课题 共价键(第一课时) | |||||||||
(知识、能力、品德) 教 学 目 标 | 1. 复习化学键的概念,能用电子式表示常见物质的离子键或共价键的形成过程。 2. 知道共价键的主要类型δ键和π键。 3. 说出δ键和π键的明显差别和一般规律。
| ||||||||
(重点、难点) 教 材 分 析 |
重点:价层电子对互斥模型
难点:价层电子对互斥模型
| ||||||||
板书 设计 示意 框图 | 1. δ键:(以“头碰头”重叠形式) a. 特征:以形成化学键的两原子核的连线为轴作旋转操作,共价键的图形不变,轴对称图形。 b. 种类:S-Sδ键 S-Pδ键 P-Pδ键 2. π键
3. δ键和π键比较 ① 重叠方式 δ键:头碰头 π键:肩并肩 ②δ键比π键的强度较大 ③成键电子:δ键 S-S S-P P-P π键 P-P δ键成单键 π键成双键、叁键 4.共价键的特征 饱和性、方向性
| ||||||||
教学操作过程设计(重点写怎么教及学法指导,含课练、作业) | 个人备课 | ||||||||
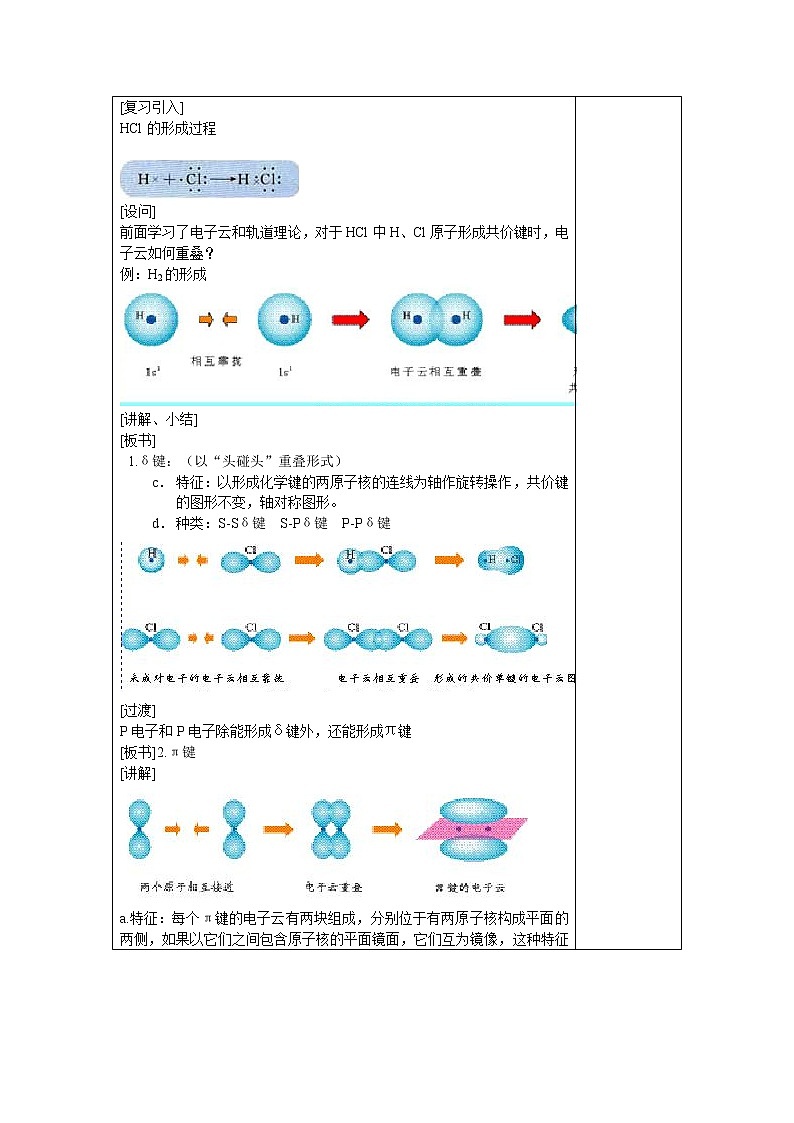
[复习引入] HCl的形成过程
[设问] 前面学习了电子云和轨道理论,对于HCl中H、Cl原子形成共价键时,电子云如何重叠? 例:H2的形成 [讲解、小结] [板书] 1.δ键:(以“头碰头”重叠形式) c. 特征:以形成化学键的两原子核的连线为轴作旋转操作,共价键的图形不变,轴对称图形。 d. 种类:S-Sδ键 S-Pδ键 P-Pδ键 [过渡] P电子和P电子除能形成δ键外,还能形成π键 [板书]2.π键 [讲解]
a.特征:每个π键的电子云有两块组成,分别位于有两原子核构成平面的两侧,如果以它们之间包含原子核的平面镜面,它们互为镜像,这种特征称为镜像对称。 4. δ键和π键比较 ② 重叠方式 δ键:头碰头 π键:肩并肩 ②δ键比π键的强度较大 ③ 成键电子:δ键 S-S S-P P-P π键 P-P δ键成单键 π键成双键、叁键 4.共价键的特征 饱和性、方向性 [科学探究] 讲解 [小结] 生归纳本节重点,老师小结
|
| ||||||||
教 学 后 记 |
| ||||||||
科目 | 化 学 | 年级 | 高二 | 班级 |
| 时间 |
| ||
课题 共价键(第二课时 ) | |||||||||
(知识、能力、品德) 教 学 目 标 | 1.认识键能、键长、键角等键参数的概念 2.能用键参数――键能、键长、键角说明简单分子的某些性质 3.知道等电子原理,结合实例说明“等电子原理的应用”
| ||||||||
(重点、难点) 教 材 分 析 |
重点:键参数的概念,等电子原理
难点:键参数的概念,等电子原理
| ||||||||
板书 设计 示意 框图 | 二、键参数 1.键能 ①概念:气态基态原子形成1mol化学键所释放出的最低能量。 ②单位:kJ/mol ③键能越大,形成化学键放出的能量越大,化学键越稳定。 2.键长 ①概念:形成共价键的两原子间的核间距 ②单位:1pm(1pm=10-12m) ③键长越短,共价键越牢固,形成的物质越稳定 3.键角:多原子分子中的两个共价键之间的夹角 | ||||||||
教学操作过程设计(重点写怎么教及学法指导,含课练、作业) | 个人备课 | ||||||||
[创设问题情境] N2与H2在常温下很难反应,必须在高温下才能发生反应,而F2与H2在冷暗处就能发生化学反应,为什么? [学生讨论] [小结]引入键能的定义 [板书] 二、键参数 1.键能 ①概念:气态基态原子形成1mol化学键所释放出的最低能量。 ②单位:kJ/mol [生阅读书33页,表2-1] 回答:键能大小与键的强度的关系? (键能越大,化学键越稳定,越不易断裂) 键能化学反应的能量变化的关系? (键能越大,形成化学键放出的能量越大) ③ 键能越大,形成化学键放出的能量越大,化学键越稳定。 [过渡] 2.键长 ①概念:形成共价键的两原子间的核间距 ②单位:1pm(1pm=10-12m) ③键长越短,共价键越牢固,形成的物质越稳定 [设问] 多原子分子的形状如何?就必须要了解多原子分子中两共价键之间的夹角。 3.键角:多原子分子中的两个共价键之间的夹角。 例如:CO2结构为O=C=O,键角为180°,为直线形分子。 H2O 键角105°V形 CH4 键角109°28′正四面体 [小结] 键能、键长、键角是共价键的三个参数 键能、键长决定了共价键的稳定性;键长、键角决定了分子的空间构型。 [板书] 三、等电子原理 1.等电子体:原子数相同,价电子数也相同的微粒。 如:CO和N2,CH4和NH4+ 2.等电子体性质相似 [阅读课本表2-3] [小结] 师与生共同总结本节课内容。 [补充练习] 1.下列分子中,两核间距最大,键能最小的是( ) A.H2 B.Br C.Cl D.I2 2.下列说法中,错误的是( ) A.键长越长,化学键越牢固 B.成键原子间原子轨道重叠越多,共价键越牢固 C.对双原子分子来讲,键能越大,含有该键的分子越稳定 D.原子间通过共用电子对所形成的化学键叫共价键 3.能够用键能解释的是( ) A.氮气的化学性质比氧气稳定 B.常温常压下,溴呈液体,碘为固体 C.稀有气体一般很难发生化学反应 D.硝酸易挥发,硫酸难挥发 4.与NO3-互为等电子体的是( ) A.SO3 B.BF3 C.CH4 D.NO2 5.根据等电子原理,下列分子或离子与SO42-有相似结构的是( ) A.PCl5 B.CCl4 C.NF3 D.N 6.由表2-1可知.H-H的键能为436kJ/mol.它所表示的意义是___________.如果要使1molH2分解为2molH原子,你认为是吸收能量还是放出能量?____.能量数值____.当两个原子形成共价键时,原子轨道重叠的程度越大,共价键的键能____,两原子核间的平均距离――键长____. 7.根据课本中有关键能的数据,计算下列反应中的能量变化: (1)N2(g)+3H2(g)====2NH3(g);⊿H= (2)2H2(g)+O2(g)===2H2O(g);⊿H= [答案]1.D 2.A 3.A 4.B 5.B 6.每2mol气态H原子形成1molH2释放出436kJ能量 吸收能量 436kJ 越大 越短 7.-90.8KJ/mol -481.9 KJ/mol
|
| ||||||||
教 学 后 记 |
| ||||||||
2021学年第一节 共价键教案及反思: 这是一份2021学年第一节 共价键教案及反思,共8页。
高中化学人教版 (新课标)选修3 物质结构与性质第二章 分子结构与性质第一节 共价键第2课时教案设计: 这是一份高中化学人教版 (新课标)选修3 物质结构与性质第二章 分子结构与性质第一节 共价键第2课时教案设计,共3页。教案主要包含了键参数,等电子原理等内容,欢迎下载使用。
高中化学人教版 (新课标)选修1 化学与生活第一节 合理选择饮食教案设计: 这是一份高中化学人教版 (新课标)选修1 化学与生活第一节 合理选择饮食教案设计,共13页。













