

陕西省洛南中学2021届高三上学期第一次模拟化学试题
展开2020—2021学年度第一学期第一次模拟考试
高三化学试题
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32
Cl 35.5 K 39 Ca 40 Fe 56 Cu 64 Zn 65 Ba 137
第І卷(选择题 共48分)
一、选择题(本题包括16小题,每小题3分,共48分,每小题只有一个选项符合题意)
1.下列物质在生活中的应用对应关系错误的是( )
| 性质 | 应用 |
A | 油脂在碱性溶液中水解 | 制肥皂 |
B | 聚氯乙烯化学性质稳定 | 作食品包装盒 |
C | Al2O3具有较高熔点 | 作耐火材料 |
D | SO2具有漂白性 | 用SO2漂白纸浆 |
2.下列化学用语表述正确的是( )
A. 核内质子数为117,核内中子数为174的核素Ts可表示为:
B. 乙醇的结构简式:C2H6O
C. COCl2 的结构式为:
D. CaO2的电子式为:
3.运用有关概念判断下列叙述正确的是 ( )
A.1molH2燃烧放出的热量为H2的燃烧热
B.Na2SO3和H2O2的反应为氧化还原反应
C.和互为同系物
D.Fe(OH)3胶体和 FeSO4溶液均能产生丁达尔效应
4.酸化的KI淀粉溶液中,加入(或通入)下物质不能使溶液变蓝的是( )
A. Fe(OH)3胶体 B. 漂白液 C. O2 D. 生石灰
5.设NA代表阿伏加德罗常数的数值,下列说法正确的是( )
A.22.0 g T2O中含有的中子数为10NA
B.一定条件下,6.4 g铜与过量的硫反应,转移电子数目为0.2NA
C.在标准状况下,2.8g N2和2.24L CO所含电子数均为1.4NA
D.标准状况下,22.4 L CH2Cl2中含C—H键数为2NA
6.下列关于强弱电解质的叙述正确的是 ( )
A.强电解质溶液的导电能力一定比弱电解质溶液强
B.NH3、CH3COOH、BaSO4、H3PO4都是弱电解质
C.CO2溶于水后能部分电离,故CO2是弱电解质
D.纯净的强电解质在液态时,有的导电,有的不导电
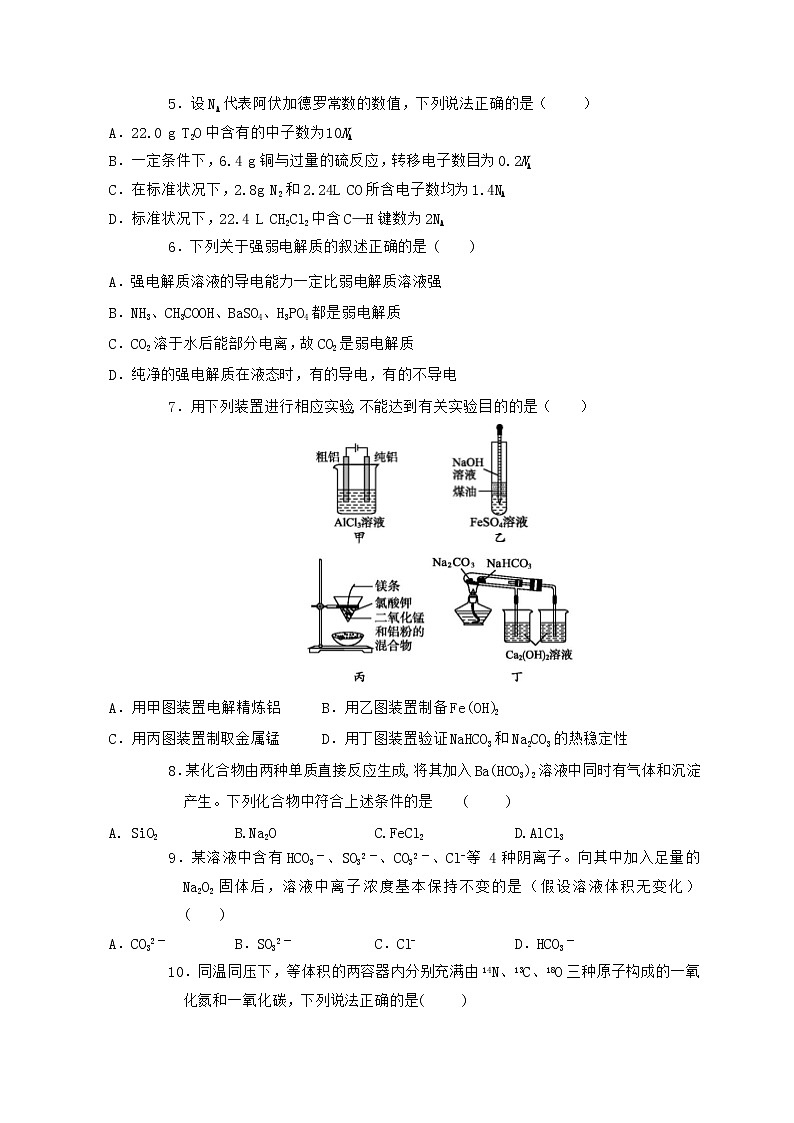
7.用下列装置进行相应实验,不能达到有关实验目的的是( )
A.用甲图装置电解精炼铝 B.用乙图装置制备Fe(OH)2
C.用丙图装置制取金属锰 D.用丁图装置验证NaHCO3和Na2CO3的热稳定性
8.某化合物由两种单质直接反应生成,将其加入Ba(HCO3)2溶液中同时有气体和沉淀产生。下列化合物中符合上述条件的是 ( )
A. SiO2 B.Na2O C.FeCl2 D.AlCl3
9.某溶液中含有HCO3一、SO32一、CO32一、Cl-等 4种阴离子。向其中加入足量的 Na2O2固体后,溶液中离子浓度基本保持不变的是(假设溶液体积无变化) ( )
A.CO32一 B.SO32一 C.Cl- D.HCO3一
10.同温同压下,等体积的两容器内分别充满由14N、13C、18O三种原子构成的一氧化氮和一氧化碳,下列说法正确的是( )
A.所含分子数和质量均不相同 B.含有相同的分子数和电子数
C.含有相同的质子数和中子数 D.含有相同数目的中子、原子和分子
11.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 使甲基橙变红的溶液中:Na+、Cl−、CH3COO−、Fe2+
B. 水电离的OH−浓度为10−12mol/L−1的溶液中:Mg2+、NH4+、AlO2−、SO32−
C. 无色溶液中:Al3+、NO3−、Cl−、SO42−
D. c(H2C2O4)=0.5 mol/L溶液中:Na+、K+、MnO4−、Cl−
12.把100 mL含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( )
A.20(2b-a) mol·L-1 B.20(b-2a) mol·L-1
C.10(2b-a) mol·L-1 D.10(b-2a) mol·L-1
13.下列有关实验原理或操作正确的是 ( )
A. 用20 mL量筒量取15 mL酒精,加水5 mL,配制质量分数为75%酒精溶液
B. 在200 mL某硫酸盐溶液中,含有1.5NA个硫酸根离子,同时含有NA个金属离子,则该硫酸盐的物质的量浓度为2.5 mol·L-1
C. 实验中需用2.0 mol·L-1的Na2CO3溶液950 mL,配制时应选用的容量瓶的规格和称取Na2CO3的质量分别为950 mL、201.4 g
D. 实验室配制500 mL 0.2 mol·L-1的硫酸亚铁溶液,其操作是:用天平称15.2 g绿矾(FeSO4·7H2O),放入小烧杯中加水溶解,转移到500 mL容量瓶,洗涤、稀释、定容、摇匀
14.除去下列物质中所含的少量杂质的方法正确的是( )
A.① B.② C.③ D.④
15.下列由实验得出的结论正确的是( )
选项 | 实验 | 结论 |
A | 向某钠盐中滴加浓盐酸。将产生的气体通入品红溶液,品红溶液褪色 | 该钠盐为Na2SO3或NaHSO3 |
B | 用乙酸浸泡水壶中的水垢。可将其清除 | 乙酸的酸性大于碳酸 |
C | 向某盐溶液中先加入少量氯水、再滴加几滴KSCN溶液,溶液变血红色 | 原溶液中一定含有Fe2+ |
D | 室温下。向饱和Na2CO3溶液中加入少量BaSO4粉末。过滤,向洗净的沉淀中加稀盐酸有气泡产生 | Ksp(BaCO3)< Ksp(BaSO4) |
16.W、X、Y、Z 是原子序数依次增大的短周期主族元素,W的氢化物水溶液能蚀刻玻璃,X、Y处于相邻位置,Y的最高正价与最低负价代数和为零,W、X 原子的最外层电子数之和与Y、Z 原子的最外层电子数之和相等。下列说法错误的是( )
A. 原子半径 : X > Y > Z > W B. 最高正价:W > Z > Y > X
C. 简单氢化物的热稳定性:W > Z > Y D. 简单离子的电子层结构: W与X相同
非选择题(52分)
二、填空题
17. (12分)将铁粉、铜粉、FeCl3溶液、FeCl2溶液和CuCl2溶液混合于某容器中充分反应(容器不参与反应),试判断下列情况溶液中存在的金属离子和金属单质。
(1)若铁粉有剩余,则容器不可能有______。
(2)若CuCl2有剩余,则容器中一定有______可能有_______。
(3)若FeCl3和CuCl2都有剩余,则容器中不可能有______,一定有_______。
(4)FeCl3和Fe粉反应时,氧化产物与还原产物的物质的量之比为______。
18.(12分)A、B、C、D、E、F、G是原子序数依次增大的短周期主族元素,A的原子核内无中子,B、F在元素周期表中的相对位置如图,B与氧元素能形成两种无色气体,D是地壳中含量最多的元素,E是地壳中含量最多的金属元素。
(1)BF2的结构式为____________。
(2)D和F的氢化物中沸点较高的是_________(填化学式)。
(3)实验室制取G2气体的离子方程式为______________________。
(4)在微电子工业中,C的最简单气态氢化物可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为________________________________。
(5)FD2气体通入BaCl2和C的最高价氧化物对应的水化物的混合溶液中,生成白色沉淀和无色气体,有关反应的离子方程式为___________________________________。
(6)火箭使用B2A8C2作燃料,N2O4为氧化剂,燃烧放出的巨大能量能把火箭送入太空,并且产生三种无污染的气体,其化学方程式为________________________________。
19.(12分)A、B、C、D、E是中学常见的几种化合物,相关物质间的关系如下图所示:
已知:X、Y是生活中常见的金属单质,A、B都是氧化物且A是红棕色粉末。
回答下列问题:
(1)单质X与A反应的化学方程式是________________________________;
(2)若试剂1和试剂2均是强电解质。
①若试剂1和试剂2的酸碱性相同,则C溶液显 (填“酸性”、“碱性”或“中性”);
②若试剂1和试剂2的酸碱性不同,试剂1和B的离子方程式是 。
(3)若试剂2是稀硝酸。
①Y单质与稀硝酸反应生成E时,Y单质必须过量,写出该反应的离子方程式 。如果稀硝酸过量,则会有Fe3+生成,可以选择试剂 进行验证。
②D的阳离子检验可以用试剂 检验。
20.(16分)已知A、B、C、D、E、F为前4周期的6种元素,原子序数依次增大,其中A位于周期表中s区,其原子中电子层数和未成对电子数相同;B原子价电子排布式为nsnnpn,B和E同主族,D原子的最外层电子数是其内层电子数的3倍;F元素位于元素周期表的第4行、第11列。试回答下列问题:
(1)基态F原子的核外电子排布式为 。
(2)下列关于B2A2的说法中正确的是 (填选项序号)
①B2A2中的所有原子都满足8电子稳定结构
②每个B2A2分子中σ键和π键数目比为1:1
③B2A2是含极性键和非极性键的非极性分子
④B2A2中心原子的杂化类型为sp杂化
(3)B、C、D三种元素第一电离能由大到小的顺序为 (用元素符号表示)。
(4)C的简单气态氢化物与C的最高价氧化物对应的水化物反应生成一种盐H,H晶体中存在的化学键类型有 (填选项符号)
①离子键 ②共价键 ③氢键 ④配位键 ⑤金属键
(5)基态E原子的最高能层具有的原子轨道数为 ;B和E的最高价氧化物中,熔沸点较高的是 ___________(写化学式)。
(6)F单质的晶体堆积方式为面心立方最密堆积(如下图),其配位数为 ;若F的相对原子质量为M,它的晶胞棱长为a cm,则F晶体的密度为 g·cm-3 。(阿伏伽德罗常数为NA)
2021届高三年级第一次模拟考试 化学参考答案
一、选择题(每小题3分,共48分)
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
B | C | B | D | C | D | A | D |
9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
C | D | C | A | B | D | B | B |
二、非选择题(52分)
17.(每空2 分,共12 分) (1)Fe3+和Cu2+ (2)亚铁离子 Fe3+(或铜粉)
(3)铁粉(或铜粉) Fe2+ (4)1 :2
18(每空2 分,共12 分) (1)S=C=S (2)H2O
(3)MnO2+4H++2Cl− Mn2++Cl2↑+2H2O (4)2NH3 +3H2O2=N2↑+6H2O
(5)3SO2 + 3Ba2+ + 2NO3- + 2H2O=3BaSO4↓ + 2NO↑ + 4H+
(6)C2H8N2 + 2N2O4=2CO2↑ + 3N2↑ + 4H2O↑
19(每空2分,共12分) (1)2Al+Fe2O3Al2O3+2Fe
(2)①酸性 ②Al2O3+2OH-=AlO2-+H2O
(3)①3Fe +8H++2NO3-=3Fe2++3NO↑+4H2O; KSCN溶液 ② K3Fe(CN)6或KMnO4
20(每空2分,共16分) (1)1s22s22p63s23p63d104s1 (或[Ar]3d104s1) (2)③④
(3)N>O>C (4)①②④ (5)9 SiO2 (6) 12 4M/NAa3








