



化学必修 第一册第二节 元素周期律课堂教学课件ppt
展开【学习目标与核心素养】
通过对碱金属元素、卤素的原子结构和性质的研究,我们已经知道元素周期表中同主族元素的性质有着相似性和递变性。那么,周期表中同周期元素的性质有什么变化规律呢?
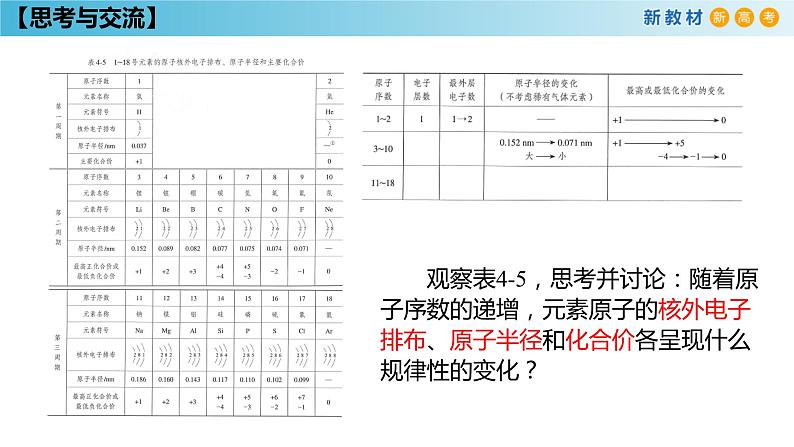
观察表4-5,思考并讨论:随着原子序数的递增,元素原子的核外电子排布、原子半径和化合价各呈现什么规律性的变化?
同一周期元素,随着原子序数的递增,元素原子核外电子排布的变化规律是 ;元素化合价的变化规律是 ,负价呈现由 的周期性变化;元素的原子半径呈现 的周期性变化。
最高正价呈现由+1到+7
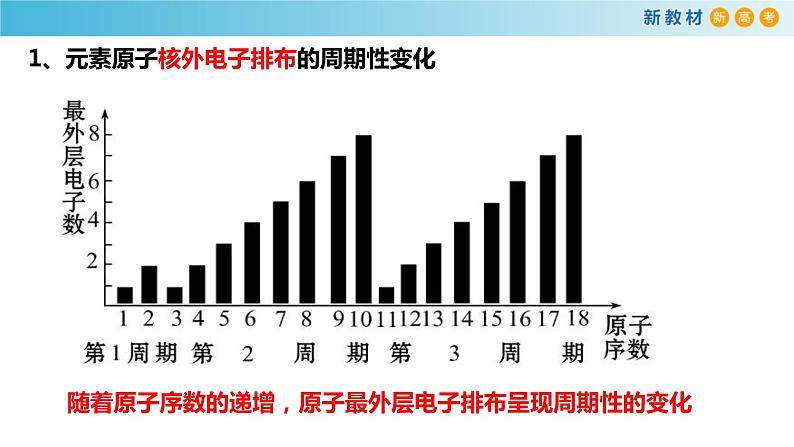
最外层电子数呈现由1到8的周期性变化
1、元素原子核外电子排布的周期性变化
随着原子序数的递增,原子最外层电子排布呈现周期性的变化
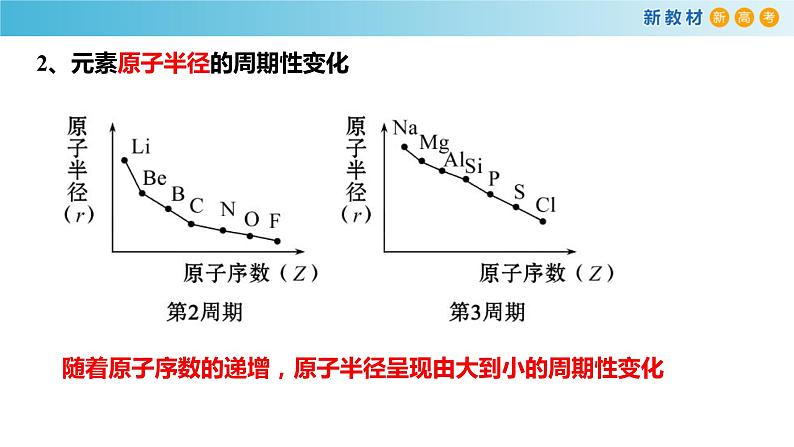
随着原子序数的递增,原子半径呈现由大到小的周期性变化
2、元素原子半径的周期性变化
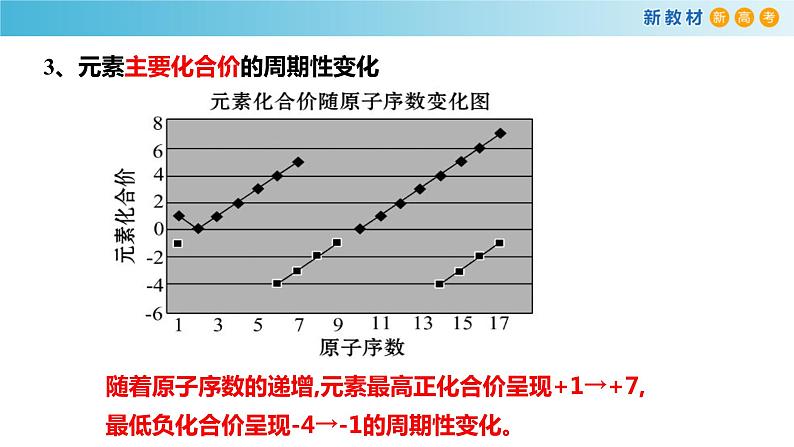
随着原子序数的递增,元素最高正化合价呈现+1→+7,最低负化合价呈现-4→-1的周期性变化。
3、元素主要化合价的周期性变化
通过上面的讨论我们知道,随着原子序数的递增,元素原子的核外电子排布、原子半径和化合价都呈现周期性的变化。那么,元素的金属性和非金属性是否也随着原子序数的递增而呈现周期性变化呢?
【思考】同一周期的元素,原子结构有何异同?
电子层数相同,原子序数依次增大,最外层电子数增多
我们通过第三周期元素的一些化学性质来探讨这一问题。
【问题讨论】根据第三周期元素原子的核外电子排布规律,你能推测出该周期元素金属性和非金属性的变化规律吗?
最外层电子数少,容易失去
半径减小,失电子能力减弱
最外层电子数多,容易得到
半径减小,得电子能力减弱
单质的还原性强弱来证明
单质的氧化性强弱来证明
4.1 钠、镁、铝和水的反应
4、第三周期金属还原性强弱变化规律
常温下,Na与水反应剧烈
2Na + 2H2O = 2NaOH + H2
加热时,Mg与热水反应较快
Mg + 2H2O = Mg(OH)2 + H2
加热时,Al与热水无明显现象
单质还原性:Na>Mg>Al
4.2 镁、铝和盐酸的反应
镁有气泡放出,镁反应剧烈
Mg + 2HCl = MgCl2+H2 ↑
铝也有气泡放出,反应较缓和
2Al + 6HCl = 2AlCl3+3H2 ↑
白色沉淀Mg(OH)2
白色沉淀Al(OH)3
4.3镁、铝氢氧化物性质
Mg(OH)2不和碱反应
Mg(OH)2为典型金属元素性质
Al(OH)3和碱反应溶解
Al(OH)3呈非金属元素性质
Al(OH)3+NaOH=NaAlO2+2H2O
元素金属性:Na>Mg>Al
①钠、镁、铝置换出水(或酸)中的氢时,由易到难的顺序为 ;②钠、镁、铝的最高价氧化物对应的水化物的碱性由强到弱的顺序为 ;③钠、镁、铝的金属性由强到弱的顺序为 。
NaOH>Mg(OH)2>Al(OH)3
5、第三周期非金属单质氧化性强弱变化规律
①硅、磷、硫、氯单质与氢气化合时条件由易到难的顺序为 ;②硅、磷、硫、氯最高价氧化物对应水化物的酸性由强到弱的顺序为 ;③硅、磷、硫、氯元素非金属性由强到弱的顺序为 。
HClO4>H2SO4>H3PO4>H2SiO3
第三周期元素金属性和非金属性强弱变化规律
随着原子序数的递增,元素金属性和非金属性呈现周期性变化
同一周期从左往右,金属性逐渐减弱,非金属性逐渐增强
元素周期律(1)元素周期律是指元素的性质随着原子序数的递增而 的变化。(2)元素的性质包括: 、 、 、 等。(3)元素周期律实质是 的必然结果。
核外电子排布发生周期性变化
1.已知下列原子的半径:根据以上数据,P原子的半径可能是( )×10-10 m ×10-10 ×10-10 m ×10-10 m
2.下列各组元素性质或原子结构递变情况错误的是( ) A. Li、Be、B原子最外层电子数依次增多 B. P、S、Cl元素最高正化合价依次升高 C. N、O、F原子半径依次增大 D. Na、K、Rb的电子层数依次增多
3.已知X、Y、Z是三种原子序数相连的元素,最高价氧化物对应水化物的酸性相对强弱的顺序是HXO4>H2YO4>H3ZO4,则下列判断正确的是( ) A. 气态氢化物的稳定性:HX>H2Y>ZH3 B. 非金属活泼性:Y<X<Z C. 原子半径:X>Y>Z D. 原子最外层电子数:X
人教版 (2019)必修 第一册第二节 元素周期律教学ppt课件: 这是一份人教版 (2019)必修 第一册第二节 元素周期律教学ppt课件,共33页。PPT课件主要包含了素养要求,元素性质的递变规律,当堂练习等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 元素周期律说课课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第二节 元素周期律说课课件ppt,共24页。PPT课件主要包含了最外层电子数1→2,最外层电子数1→8,原子半径逐渐减小等内容,欢迎下载使用。
化学第二节 元素周期律课文内容ppt课件: 这是一份化学第二节 元素周期律课文内容ppt课件,共27页。PPT课件主要包含了元素金属性减弱,元素非金属性增强,元素周期律等内容,欢迎下载使用。













