

高中化学人教版 (2019)必修 第一册第一节 铁及其化合物第二课时教案设计
展开学习目标:1.了解铁的氧化物的性质及应用。2.了解Fe(OH)2、Fe(OH)3的制备原理及化学性质。3.掌握Fe2+、Fe3+间的相互转化以及Fe3+、Fe2+的检验方法。
1.铁的氧化物
(1)物理性质
(2)化学性质
①氧化亚铁不稳定,在空气中受热易被氧化为Fe3O4。
②氧化亚铁和氧化铁属于碱性氧化物,与非强氧化性酸反应生成Fe2+和Fe3+。
③写出氧化亚铁和氧化铁分别与盐酸反应的离子方程式:
a.氧化亚铁:FeO+2H+===Fe2++H2O。
b.氧化铁:Fe2O3+6H+===2Fe3++3H2O。
(3)主要用途
氧化铁俗称铁红,常用作红色油漆和涂料。
2.铁的氢氧化物
(1)铁的氢氧化物的制备
(2)化学性质
3.铁盐和亚铁盐
常见的铁盐有Fe2(SO4)3、FeCl3等,常见的亚铁盐有FeSO4、FeCl2等。
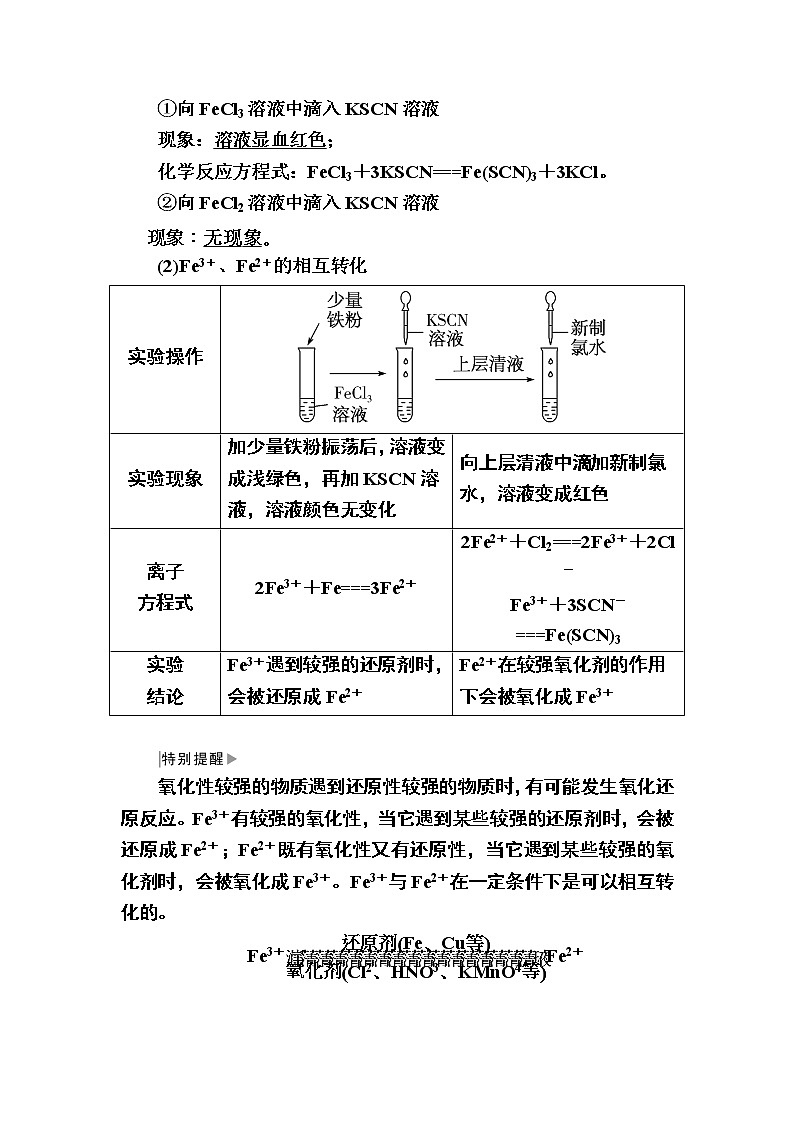
(1)Fe3+的检验
①向FeCl3溶液中滴入KSCN溶液
现象:溶液显血红色;
化学反应方程式:FeCl3+3KSCN===Fe(SCN)3+3KCl。
②向FeCl2溶液中滴入KSCN溶液
eq \a\vs4\al(现象:无现象。)
(2)Fe3+、Fe2+的相互转化
氧化性较强的物质遇到还原性较强的物质时,有可能发生氧化还原反应。Fe3+有较强的氧化性,当它遇到某些较强的还原剂时,会被还原成Fe2+;Fe2+既有氧化性又有还原性,当它遇到某些较强的氧化剂时,会被氧化成Fe3+。Fe3+与Fe2+在一定条件下是可以相互转化的。
Fe3+eq \(,\s\up15(还原剂Fe、Cu等),\s\d15(氧化剂Cl2、HNO3、KMnO4等))Fe2+
1.判断正误(正确的打“√”,错误的打“×”)
(1)Fe3O4可由单质直接化合而得到( )
(2)FeCl2、FeCl3、Fe(OH)3都可通过化合反应生成( )
(3)Fe3+、Cu2+、H+、Fe2+四种离子中氧化能力最强的是Fe3+( )
(4)在配制FeSO4溶液时,为防止FeSO4被氧化而变质,常在溶液中加入少量的铁粉( )
(5)某溶液中滴加氯水,然后滴加KSCN溶液,溶液显红色,该溶液中一定含有Fe2+( )
[答案] (1)√ (2)√ (3)√ (4)√ (5)×
2.下列说法不正确的是( )
A.铁的氧化物均为黑色固体,均难溶于水
B.Fe(OH)2在空气中易变质,生成红褐色Fe(OH)3
C.铁在氧气中剧烈燃烧,火星四射,生成黑色的Fe3O4
D.氢氧化亚铁为白色絮状沉淀
[解析] 铁的氧化物有黑色FeO和Fe3O4以及红棕色Fe2O3均不溶于水,铁丝在氧气中燃烧生成Fe3O4,在空气中缓慢氧化生成Fe2O3;Fe(OH)2为白色絮状沉淀具有极强还原性,易被O2氧化生成红褐色Fe(OH)3。
[答案] A
知识点一 铁的氧化物和氢氧化物
1.铁的氧化物
(1)Fe的常见化合价只有+2价和+3价,Fe3O4是黑色具有磁性的晶体,可以看成由FeO和Fe2O3按物质的量之比1∶1组合而成的复杂氧化物,通常也可写成FeO·Fe2O3的形式。
(2)FeO、Fe2O3属于碱性氧化物,Fe3O4不属于碱性氧化物,均不溶于水。
(3)Fe3O4与盐酸反应可分别看作Fe2O3、FeO与盐酸反应,然后把两个反应式相加。
Fe3O4+8HCl===2FeCl3+FeCl2+4H2O
(4)从价态分析,FeO有还原性,Fe2O3有氧化性,Fe3O4既有氧化性又有还原性。但FeO与Fe2O3中Fe元素价态相邻,两者不会反应。FeO、Fe3O4遇氧化性酸(如HNO3)发生氧化还原反应,+2价的铁均被氧化成+3价。
2.氢氧化物
(1)Fe(OH)3红褐色,Fe(OH)2白色,均不溶于水。
(2)Fe(OH)2具有强还原性,易被空气中的O2氧化生成Fe(OH)3。
①转化过程中的特殊现象是:白色沉淀迅速变成灰绿色,最终变成红褐色。
②转化方程式:4Fe(OH)2+O2+2H2O===4Fe(OH)3
反应类型属于化合反应。
(3)Fe(OH)2、Fe(OH)3受热均分解生成同价态的氧化物。
【典例1】 用足量的CO还原32.0 g某种氧化物,将生成的气体通入足量的澄清石灰水中,得到60 g沉淀,则该氧化物是( )
A.FeO B.Fe2O3
C.CuO D.Fe3O4
[思路启迪] 解决本题的关键是准确把握氧化还原反应过程的元素守恒,并灵活运用n1/n2=N1/N2确定化学式。
[解析] 由生成CaCO3 60 g可得反应掉CO为0.6 ml,即32 g金属氧化物中含氧原子为0.6 ml,铁原子:eq \f(32.0 g-0.6 ml×16 g·ml-1,56 g·ml-1)=0.4 ml,N(Fe)∶N(O)=0.4∶0.6=2∶3,即氧化物为Fe2O3。
[答案] B
灵活运用守恒思想:
由COeq \(――→,\s\up15(结合O))CO2eq \(――→,\s\up15(CaOH2))CaCO3
可知n(CaCO3)=n(氧化物中氧原子)。
[针对训练1] 下列说法正确的是( )
A.赤铁矿的主要成分是Fe3O4
B.Fe2O3为碱性氧化物,可与水反应生成Fe(OH)3
C.铁锈的主要成分是Fe2O3
D.Fe3O4中铁元素有+2价和+3价,Fe3O4是混合物
[解析] 赤铁矿、铁锈的主要成分是Fe2O3,A错误,C正确;Fe2O3为碱性氧化物,但不与水反应,B错误;Fe3O4为化合物,不是混合物,D错误。
[答案] C
知识点二 Fe(OH)2的制备
1.操作
将吸有NaOH溶液的胶头滴管插入新制备的亚铁盐(以FeSO4为例)溶液的液面以下,缓慢挤出NaOH溶液。
2.原理:Fe2++2OH-===Fe(OH)2↓
3.注意事项
(1)Fe2+必须是新制的并加入Fe粉,以防Fe2+被氧化成Fe3+;(2)除去溶液中溶解的O2,其方法是加热煮沸NaOH溶液;(3)滴管末端插入试管内的液面以下;(4)必要时可在液面上加植物油或苯进行液封。
4.改进方法
为了防止Fe(OH)2被O2氧化,在制备Fe(OH)2时,一般从两个角度考虑,一是反应试剂,二是反应环境。
(1)反应试剂
取用最新配制的FeSO4溶液;NaOH溶液加热煮沸并冷却后使用,以驱除溶液中溶解的O2。
(2)反应环境
方法1:装置如图所示。在试管中加入适量的5% FeSO4溶液,并覆盖一层苯,再用长滴管注入不含O2的1 ml·L-1NaOH溶液。由于苯的液封作用,防止了生成的Fe(OH)2被氧化,因而可较长时间观察到白色的Fe(OH)2沉淀。
方法2:装置如下图所示。实验时,先打开弹簧夹K,再将分液漏斗的旋塞打开,使稀硫酸与铁粉作用,用产生的H2排出装置中的空气;然后关闭K,使生成的H2将试管中的FeSO4溶液压入NaOH溶液中,则可较长时间观察到生成的白色Fe(OH)2沉淀。若拔去广口瓶上的橡皮塞,则白色沉淀迅速变成灰绿色,最后变成红褐色。
【典例2】 下列各图中能较长时间看到Fe(OH)2白色沉淀的是( )
A.①③ B.①②
C.①②③ D.②③
[思路启迪] 制备纯净的Fe(OH)2的关键点就是给反应体系制造一个无氧气的环境,从而防止Fe(OH)2被O2氧化为Fe(OH)3,另外为保证实验成功,Fe2+不能长时间放置,而应随时制备。
[解析] 要较长时间看到Fe(OH)2沉淀,必须在制取过程中尽可能减少和空气接触。对比3个实验可以发现:①中盛有氢氧化钠溶液的滴管伸入放有还原性铁粉的硫酸亚铁溶液中,可以较长时间观察到Fe(OH)2白色沉淀;②中生成的氢氧化亚铁能够与空气中氧气发生反应:4Fe(OH)2+O2+2H2O===4Fe(OH)3,导致不能长时间观察到氢氧化亚铁白色沉淀。③中加入有机物作隔离层,和空气接触少,能较长时间观察到Fe(OH)2白色沉淀。
[答案] A
制备纯净的Fe(OH)2时制造无氧气的环境可采用以下几种方法:
(1)加热煮沸NaOH溶液;
(2)长胶头滴管末端插入试管内的液面以下;
(3)在FeSO4溶液液面上加植物油或苯进行液封;
(4)改进实验装置,排尽装置内空气。
[针对训练2] 按如图所示装置,用两种不同操作分别进行实验,观察B管中的现象。(注:操作过程中不考虑稀H2SO4与NaOH溶液的作用)
(1)操作Ⅰ:先夹紧止水夹a,使A管开始反应,实验中B管观察到的现象是____________________________________________。B管发生反应的化学方程式是______________。
(2)操作Ⅱ:打开止水夹a,使A管开始反应一段时间后再夹紧止水夹a,实验中在B管观察到的现象是_____________________。B管中发生反应的离子方程式是_____________。
[解析] (1)当夹紧止水夹a时,A管便成了一个封闭体系,产生的H2使A管内压强增大,将生成的FeSO4溶液压入B管中,从而与NaOH溶液发生反应生成Fe(OH)2,而NaOH溶液中溶解的O2可将Fe(OH)2迅速氧化,最后转变成Fe(OH)3,所以观察到白色沉淀迅速变成灰绿色,最后变成红褐色。(2)当进行操作Ⅱ时,产生的H2首先通过导气管通入到B管中的NaOH溶液中,将其中溶解的O2赶走,再夹紧止水夹a时,FeSO4溶液压入B管中,此时反应所产生的Fe(OH)2在一段时间内不变色。
[答案] (1)先出现白色絮状沉淀,然后沉淀迅速变为灰绿色,最后变为红褐色 FeSO4+2NaOH===Fe(OH)2↓+Na2SO4、4Fe(OH)2+O2+2H2O===4Fe(OH)3
(2)打开止水夹a时,溶液中的导气管口有气泡冒出;夹紧止水夹a后,出现白色沉淀,短时间内沉淀不变色 Fe2++2OH-===Fe(OH)2↓
知识点三 铁盐和亚铁盐
1.“铁三角”
铁元素有三种价态:0价、+2价和+3价,这三种价态的铁在一定条件下可相互转化,我们称之为“铁三角”。
(1)Fe只有还原性,可以被氧化成+2价或+3价的铁
Fe—eq \b\lc\|\rc\ (\a\vs4\al\c1(\(――→,\s\up15(较弱氧化剂),\s\d15(如I2、S、H+、Cu2+、Ag+等))Fe2+,\(――→,\s\up15(较强氧化剂),\s\d15(如Cl2、Br2、稀硝酸足量等))Fe3+,\(――→,\s\up15(氧化剂O2、H2O等),\s\d15( ))Fe3O4FeO·Fe2O3))
如:Fe+2H+===H2↑+Fe2+,
2Fe+3Cl2eq \(=====,\s\up15(点燃))2FeCl3,
3Fe+4H2O(g)eq \(=====,\s\up15(高温))Fe3O4+4H2。
(2)Fe2+既有氧化性又有还原性
Fe2+—eq \b\lc\|\rc\ (\a\vs4\al\c1(\(――→,\s\up15(强氧化剂),\s\d15(如Cl2、Br2、HNO3、HClO等))Fe3+,\(――→,\s\up15(还原剂),\s\d15(如C、Al、Zn、CO等))Fe))
如:2Fe2++Cl2===2Fe3++2Cl-,
Zn+Fe2+===Fe+Zn2+。
(3)Fe3+具有较强的氧化性,可被还原为+2价或0价的铁
Fe3+—eq \b\lc\|\rc\ (\a\vs4\al\c1(\(――→,\s\up15(还原剂),\s\d15(如Cu、Fe等))Fe2+,\(――→,\s\up15(还原剂),\s\d15(如C、Zn、CO等))Fe))
如:2Fe3++Cu===2Fe2++Cu2+,
3CO+Fe2O3eq \(=====,\s\up15(△))2Fe+3CO2。
注:“铁三角”转化关系的两个应用
(1)判断离子共存
Fe2+eq \(――→,\s\up15(不共存))NOeq \\al(-,3)(H+)、ClO-(次氯酸根)、MnOeq \\al(-,4)(H+);
Fe3+eq \(――→,\s\up15(不共存))S2-、I-、SOeq \\al(2-,3)。
(2)除杂
2.Fe3+和Fe2+的检验
(1)Fe3+的检验方法
eq \x(\a\al(未,知,溶,液))—eq \b\lc\|\rc\ (\a\vs4\al\c1(\(――→,\s\up15(观察颜色),\s\d15( ))溶液呈棕黄色―→含有Fe3+,\(――→,\s\up15(NaOH),\s\d15( ))产生红褐色沉淀―→含有Fe3+,\(――→,\s\up15(KSCN),\s\d15( ))溶液呈红色―→含有Fe3+,\(――→,\s\up15(氢碘酸、淀粉溶液),\s\d15(利用Fe3+的氧化性))\a\vs4\al(溶液变蓝色,说明溶液中,存在Fe3+)))
(2)Fe2+的检验方法
eq \x(\a\al(未,知,溶,液))—eq \b\lc\|\rc\ (\a\vs4\al\c1(\(――→,\s\up15(观察颜色),\s\d15( ))溶液呈浅绿色―→含有Fe2+,\(――→,\s\up15(NaOH),\s\d15( ))\a\vs4\al(产生白色沉淀,然后迅速变为灰绿,色,最后变成红褐色―→含有Fe2+),\(――→,\s\up15(KSCN),\s\d15( ))\a\vs4\al(溶液不变红\(――→,\s\up15(氯水))溶液呈红色―→,含有Fe2+),\(――→,\s\up15(酸性KMnO4溶液),\s\d15(利用Fe2+的还原性))\a\vs4\al(溶液紫色褪去,说明溶液中,存在Fe2+)))
【典例3】 欲证明某溶液中含有Fe2+不含Fe3+,进行如下实验操作时最佳顺序为( )
①加入少量氯水 ②加入少量KMnO4溶液 ③加入少量KSCN溶液
A.①③ B.③② C.③① D.①②③
[思路启迪] 在分析Fe2+、Fe3+检验题型时,既要熟悉各自的检验方法,又要注意二者因性质差异而导致的相互干扰,结合题干信息选择正确的试剂。
[解析] Fe3+与KSCN溶液反应变红色,Fe2+与KSCN溶液不反应,但加入氧化剂后Fe2+被氧化成Fe3+,使KSCN变红色。所以,应先加入KSCN,如果溶液不变色,再加入氯水,溶液变成红色,则可证明溶液中含有Fe2+不含Fe3+。
[答案] C
(1)Fe2+既有氧化性又有还原性。可被强氧化剂[Cl2、KMnO4(H+)等]氧化为Fe3+。
(2)Fe3+只具有氧化性,可被弱还原剂(Fe、Cu等)还原为Fe2+。
(3)只有Fe3+能与SCN-结合形成血红色物质,Fe2+遇到SCN-不会产生血红色物质。
[针对训练3] FeCl3、CuCl2的混合溶液中加入一定量的铁粉,充分反应后仍有固体存在,则下列判断不正确的是( )
A.溶液中一定含Cu2+
B.溶液中一定含Fe2+
C.加入KSCN溶液一定不变红色
D.剩余固体中一定含Cu
[解析] 加入铁粉后,因为Fe3+氧化性强于Cu2+,铁粉先与FeCl3反应,然后与CuCl2反应,充分反应后仍存在
的固体一定含有Cu,可能含有Fe,D正确;所得溶液中一定不含Fe3+,可能含Cu2+,一定含有Fe2+,加入KSCN一定不变红色,B、C正确,A错误。
[答案] A
1.下列有关铁及其化合物的说法正确的是( )
A.赤铁矿的主要成分是Fe3O4
B.铁与水蒸气在高温下的反应产物为Fe2O3和H2
C.除去FeCl3溶液中的FeCl2杂质可以向溶液中通入足量的氯气
D.Fe3+与KSCN反应产生红色沉淀
[解析] 赤铁矿的主要成分是Fe2O3,A选项错误;铁与水蒸气在高温下反应产生Fe3O4和H2,B选项错误;Fe3+与SCN-结合生成红色可溶物而非沉淀,D选项错误。
[答案] C
2.将下列四种化合物溶于稀盐酸,滴加硫氰化钾溶液,没有颜色变化,再加氯水即呈现红色的是( )
A.FeO B.Fe2O3
C.FeCl3 D.Fe2(SO4)3
[解析] 根据题意可知溶液中含有Fe2+,只有FeO溶于稀盐酸产生Fe2+,A项符合题意。
[答案] A
3.除去FeCl2溶液中少量的FeCl3,最好的办法是( )
A.加入氢氧化钠溶液 B.通入氯气
C.加入铜粉 D.加入铁粉
[解析] 根据反应:Fe+2FeCl3===3FeCl2,可知除去FeCl2中少量FeCl3最好的办法是加入铁粉。
[答案] D
4.下列描述不正确的是( )
A.FeSO4可用于防止食品氧化变质,延长食品的保质期
B.向FeSO4溶液中加入NaOH溶液,观察到有白色沉淀生成,白色沉淀迅速变成灰绿色,最后变成红褐色
C.向Fe2(SO4)3溶液中加入足量铁粉,充分反应后滴加KSCN溶液,溶液立即变成血红色
D.铁在氧气中燃烧,生成黑色的Fe3O4
[解析] 向Fe2(SO4)3溶液中加入足量铁粉,充分反应后生成FeSO4,滴加KSCN溶液,溶液不会变成血红色。
[答案] C
5.几种物质间的相互转化关系如图所示:
(1)A转化为B及气体的反应中应加入的试剂是________(填化学式)。
(2)写出B的化学式:________,F的化学式:________。
(3)写出G→H的化学方程式:_______________。
(4)写出检验D溶液中金属阳离子的方法:____________(用离子方程式表示);
向D溶液中加入A,发生反应的离子方程式是___________。
[解析] 根据框图信息,可以推出A为Fe,B为FeCl2,C为Cl2,D为FeCl3,E为KOH,F为KCl,G为Fe(OH)2,H为Fe(OH)3,J为AgCl。
[答案] (1)HCl (2)FeCl2 KCl
(3)4Fe(OH)2+O2+2H2O===4Fe(OH)3
(4)Fe3++3SCN-===Fe(SCN)3 2Fe3++Fe===3Fe2+
课后作业(十五)
[基础巩固]
一、铁的氧化物和氢氧化物
1.在一些高档茶叶、点心等食品的包装盒中有一个小袋,将小袋打开,可以看到灰黑色粉末,其中有些已变成棕褐色。将上述粉末溶于稀盐酸,取上层清液,滴入几滴氯水,再滴加KSCN溶液,马上出现红色。以下结论不正确的是( )
A.该灰黑色粉末用作抗氧化剂
B.该灰黑色粉末不可食用
C.小袋中原来装有铁粉
D.小袋中原来装有氧化铁
[解析] 从溶液遇KSCN出现红色看,黑色粉末应该含铁元素。氧化铁为红棕色粉末,D错误;该灰黑色粉末为还原铁粉,起到吸收包装盒中的氧气,防止高档茶叶、点心等食品变质的作用,故A、B、C正确。
[答案] D
2.“秦砖汉瓦”是我国传统建筑文化的一个缩影。同时由黏土烧制的砖瓦,有的是黑色的,有的却是红色的,猜测其中的原因可能是( )
A.土壤中含有铁粉、二氧化锰等
B.黑砖瓦是煅烧过程中附着了炭黑,红砖瓦则是添加了红色耐高温染料
C.土壤中含有的铜元素经过不同工艺煅烧,分别生成了黑色CuO和红色Cu
D.土壤中含有的铁元素经过不同工艺煅烧,分别生成了黑色Fe3O4或FeO和红色Fe2O3
[解析] 土壤中含有铁,经过不同工艺煅烧,分别生成了黑色Fe3O4或FeO和红色Fe2O3,灼烧时不会存在铁粉、铜等,故只有D正确。
[答案] D
二、Fe(OH)2的制备
3.下列物质不能通过化合反应得到的是( )
A.Al(OH)3 B.Fe(OH)3
C.Al2O3 D.Fe3O4
[解析] 不溶于水的氧化物,不能与水反应制取相应的氢氧化物,如Fe2O3不溶于水,不能与水化合生成Fe(OH)3,但反应4Fe(OH)2+O2+2H2O===4Fe(OH)3为化合反应。
[答案] A
4.下列实验方案可以得到白色纯净的Fe(OH)2的是( )
A.在Fe2(SO4)3溶液中加入过量的铁粉,过滤,在滤液中加入过量的NaOH溶液
B.将铁粉与稀硫酸充分反应,然后再加入过量的氨水
C.在FeCl2溶液上加一层苯,然后将滴管插入到FeCl2溶液液面以下,慢慢滴加NaOH溶液(溶液中不能有气泡,配制FeCl2溶液和NaOH溶液的蒸馏水必须加热煮沸)
D.在生成Fe(OH)3的悬浊液中加过量的铁粉
[解析] 必须防止Fe(OH)2被氧化,可以用油封(如苯等),同时在配制碱和Fe2+溶液时,也不能用含有氧气的蒸馏水。
[答案] C
三、铁盐和亚铁盐
5.下列离子的检验方法最合理的是( )
A.向某溶液中滴入KSCN溶液呈红色,说明原溶液中不含Fe2+
B.向某溶液中通入Cl2,然后再加入KSCN溶液变红色,说明原溶液中含有Fe2+
C.向某溶液中加入NaOH溶液,得到红褐色沉淀,说明原溶液中含有Fe3+
D.向某溶液中加入NaOH溶液得白色沉淀,又观察到沉淀颜色逐渐变为红褐色,说明原溶液中含有Fe2+,不含有Mg2+
[解析] Fe3+与SCN-生成红色Fe(SCN)3,A项中现象可以证明存在Fe3+,但无法确定Fe2+的存在,A项不合理;B项中现象可以证明通入Cl2后存在Fe3+,但原溶液是只存在Fe2+,还是只存在Fe3+或Fe2+、Fe3+均含有,不能确定,B项不合理;Fe(OH)2转化为红褐色Fe(OH)3时会干扰其他白色沉淀的观察,所以当含Fe2+的溶液中含有其他能与碱生成白色沉淀的离子时,也同样出现D项所述现象,D项不合理。
[答案] C
6.选择合适试剂完成甲、乙两组实验。
甲组:检验含Fe3+的溶液中是否含有Fe2+;
乙组:检验含Fe2+的溶液中是否含有Fe3+。
下列试剂及加入试剂顺序能达到实验目的的是( )
[解析] 甲组,在Fe3+存在的条件下,检验Fe2+,要排除Fe3+干扰。所选试剂具备下列条件:一是能与Fe2+发生有明显现象的反应;二是与Fe3+不反应,不干扰现象观察。只有酸性KMnO4溶液符合条件:5Fe2++MnOeq \\al(-,4)+8H+===5Fe3++Mn2++4H2O,现象是紫红色变浅(或褪去)。乙组,在Fe2+存在的条件下,检验Fe3+,用KSCN溶液检验Fe3+,Fe2+无干扰。
[答案] B
7.向某晶体的水溶液中加入含有Fe2+的溶液后,无明显变化,当滴加几滴溴水后,混合溶液出现血红色,由此得出的结论错误的是( )
A.该晶体的水溶液中一定含有SCN-
B.Fe3+的氧化性比Br2强
C.Fe2+被Br2氧化成Fe3+
D.Fe2+与SCN-不能形成血红色的化合物
[解析] 向水溶液中加入含有Fe2+的溶液后,溶液无明显变化,随后加入溴水,出现血红色,说明Fe2+被Br2氧化成Fe3+,即Br2的氧化性比Fe3+强,且原溶液中含有SCN-,Fe2+与SCN-不能形成血红色的化合物。
[答案] B
8.将1.12 g铁粉加入到25 mL 2 ml·L-1的氯化铁溶液中,充分反应后,其结果是( )
A.铁粉剩余,溶液呈浅绿色,Cl-基本不变
B.向溶液中滴入无色KSCN溶液,仍无色
C.溶液中Fe2+与Fe3+物质的量之比为6∶1
D.氧化产物与还原产物的物质的量之比为2∶5
[解析] n(Fe)=0.02ml,n(FeCl3)=0.05ml,由Fe+2Fe3+===3Fe2+知,Fe3+过量0.01 ml,铁粉全部溶解,反应生成Fe2+ 0.06 ml;Fe3+过量,滴入无色KSCN溶液,溶液显红色;氧化生成的Fe2+和还原生成的Fe2+的物质的量之比为1∶2。
[答案] C
[能力提升]
9.某溶液中含有Mg2+、Fe2+、Fe3+和Al3+四种阳离子,若向其中加入过量的NaOH溶液,微热并搅拌,过滤,在滤渣中再加入过量的盐酸,所得溶液中大量增加的阳离子是( )
A.Mg2+ B.Fe2+
C.Fe3+ D.Al3+
[解析]
[答案] C
10.某200 mL溶液中含0.1 ml Fe2+、0.2 ml Fe3+,加入0.2 ml铁粉,待Fe3+完全还原后,溶液中Fe2+的物质的量浓度为(假设反应前后体积不变)( )
A.0.4 ml/L B.2 ml/L
C.0.8 ml/L D.1.0 ml/L
[解析] 根据反应2Fe3++Fe===3Fe2+可知,0.2 ml Fe3+和0.1 ml铁粉反应可生成0.3mlFe2+,故Fe2+的物质的量浓度为:eq \f(0.1 ml+0.3 ml,0.2 L)=2 ml/L。
[答案] B
11.下列各组物质中,X是主体物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的一组是( )
[解析] A项中Cl2能把FeCl2氧化,B项中Fe能把FeCl3还原,D项除去了COeq \\al(2-,3)和SOeq \\al(2-,4)又引入了Cl-,均不合要求。
[答案] C
12.电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中Fe3+存在的试剂是________,证明Fe3+存在的现象是_____________。
(2)写出FeCl3溶液与金属铜发生反应的化学方程式:
______________。
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液,准备采用下列步骤:
A.请写出上述实验中加入或生成的有关物质的化学式。
①________,②________,③________,
④________,⑤________,⑥________。
B.请写出相关反应的化学方程式。
__________________________________________________,
__________________________________________________,
__________________________________________________,
__________________________________________________。
[解析] 从腐蚀铜的废液中回收铜。
[答案] (1)KSCN溶液 溶液变成红色
(2)2FeCl3+Cu===2FeCl2+CuCl2
(3)A.①Fe ②FeCl2 ③Fe和Cu ④HCl ⑤FeCl2 ⑥Cl2
B.CuCl2+Fe===FeCl2+Cu
Fe+2HCl===FeCl2+H2↑
2FeCl3+Fe===3FeCl2
2FeCl2+Cl2===2FeCl3
13.某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 ml·L-1的溶液。在FeCl2溶液中需加入少量铁屑,其目的是________。
(2)甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为__________________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL 煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是___________。
(4)丙组同学取10 mL 0.1 ml·L-1KI溶液,加入6 mL 0.1 ml·L-1 FeCl3溶液混合。分别取 2 mL 此溶液于3支试管中进行如下实验:
①第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是________(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有________(填离子符号),由此可以证明该氧化还原反应为________________________________。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为_________;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是______________。
[解析] (1)Fe2+易被氧化,因此加入少量铁屑的目的是防止Fe2+被氧化。(2)由题意写出离子方程式为2Fe2++Cl2===2Fe3++2Cl-。(3)煤油的作用是隔绝空气,从而防止空气中的氧气将Fe2+氧化为Fe3+对实验造成干扰。(4)实验②中,试管加入K3[Fe(CN)6],与该溶液作用生成蓝色沉淀,因此实验②中检验的离子是Fe2+。混合后发生的反应为2Fe3++2I-2Fe2++I2,实验①③说明在I-过量时溶液中仍有Fe3+,因此该反应为可逆反应。(5)由题意写出离子方程式为:2Fe2++H2O2+2H+===2Fe3++2H2O,一段时间后,H2O2仍过量,因此产生气泡的原因为Fe3+催化H2O2分解产生O2。
[答案] (1)防止Fe2+被氧化
(2)2Fe2++Cl2===2Fe3++2Cl-
(3)隔绝空气(排除氧气对实验的影响)
(4)Fe2+ Fe3+ 可逆反应
(5)H2O2+2Fe2++2H+===2Fe3++2H2O Fe3+催化H2O2分解产生O2
14.Ⅰ.铁及其化合物之间的相互转化可用下式表示:
Fe2+eq \(,\s\up15(①),\s\d15(④))Fe3+eq \(,\s\up15(②),\s\d15(③))FeOeq \\al(2-,4)
回答下列有关问题:
(1)Fe与过量盐酸反应可以制取FeCl2。若用反应所得的酸性溶液,实现上述①、④的转化,要求产物纯净,可选用________(选填字母)。
a.Cl2 b.Fe
c.Cu d.KMnO4
(2)某同学为了检验家中的一瓶补铁药(成分为FeSO4)是否变质,查阅了有关资料,得知Fe2+能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,并结合已学的知识设计了如下实验:
将药片除去糖衣研细后,溶解过滤,取滤液分别加入两支试管中,在试管Ⅰ中滴入酸性高锰酸钾溶液,在试管Ⅱ中滴入KSCN溶液。
①请你填出该同学实验中出现以下现象时应得出的结论:
②能不能将KMnO4和KSCN滴入到同一试管中进行验证,为什么?试进行解释:___________________。
Ⅱ.硫酸亚铁是一种重要的工业原料,同时可以用于制造补血药物,但具有毒性,故严禁在食品中滥用硫酸亚铁。某同学为探究富含硫酸亚铁且保存时间较长的糕点的情况,设计了如图所示实验方案:
eq \x(糕点)eq \(――→,\s\up15(水),\s\d15(过滤))eq \x(淡黄色溶液)eq \(――→,\s\up15(试剂1))eq \x(淡红色溶液)eq \(――→,\s\up15(新制氯水))eq \x(血红色溶液)
(1)该同学在实验中加入了过量新制氯水,放置一段时间后,发现血红色褪去,现对褪色原因进行探究(已知SCN-有还原性)。
【提出假设】
假设1:溶液中的+3价铁被氧化为更高的价态;
假设2:_______________________________。
【设计方案】
(2)为了对你所提出的假设2进行验证,实验方案是
______________。
[解析] Ⅰ.(1)要使产物纯净,必须物质间发生反应后,没有杂质生成;氯气有氧化性,能氧化二价铁离子生成三价铁离子,同时有氯离子生成,没有杂质生成,故a正确;铁与铁离子反应生成二价铁离子,不引入其他杂质,故b正确;铜与铁离子反应生成铜离子和亚铁离子,引入了铜离子杂质,故c错误;酸性高锰酸钾氧化亚铁离子时,产物会有钾离子、锰离子引入,不符合,故d错误;故选ab。(2)①亚铁离子具有还原性,可以被酸性高锰酸钾溶液氧化,所以若酸性高锰酸钾溶液褪色,说明样品中含有亚铁离子;铁离子与KSCN可以形成血红色的溶液,所以若出现血红色,说明样品中含有铁离子,即样品变质了。a.试管Ⅰ褪色,说明含有亚铁离子,试管Ⅱ不变血红色,说明不含铁离子,即样品没有变质;b.试管Ⅰ不褪色,说明不含有亚铁离子,试管Ⅱ变血红色,说明含铁离子,即样品完全变质;c.试管Ⅰ褪色,说明含有亚铁离子,试管Ⅱ变血红色,说明含铁离子,即样品部分变质。②酸性高锰酸钾溶液呈紫红色,铁离子与KSCN会形成血红色,两者颜色较近,不容易观察到血红色;同时KSCN具有较强的还原性,也可以被酸性高锰酸钾溶液氧化,使酸性高锰酸钾溶液褪色,影响亚铁离子的检验,所以不能将两者滴入同一个试管中进行验证。
Ⅱ.(1)实验中加入了过量的新制氯水,放置一段时间后,发现红色褪去,说明Fe(SCN)3的浓度逐渐减小。而Fe(SCN)3的生成与Fe3+、SCN-有关,故可能是溶液中的Fe3+被Cl2氧化为更高的价态,也可能是由于SCN-具有还原性,Cl2是一种强氧化剂,SCN-被过量的新制氯水氧化,导致红色褪去。(2)假设Fe3+没有被氧化,而是SCN-被氧化,则只要向褪色后的溶液中加入过量KSCN溶液,溶液出现血红色,说明假设2成立;若溶液不出现血红色,说明假设2不成立。
[答案] Ⅰ.(1)ab
(2)①a.没有变质 b.完全变质 c.部分变质
②不能。原因是KMnO4溶液呈紫红色,影响Fe3+的检验;KSCN具有还原性,影响Fe2+的检验
Ⅱ.(1)SCN-被过量的新制氯水氧化
(2)取少量褪色后的溶液,滴加过量KSCN溶液,若溶液变为血红色,则说明假设2成立;若溶液不变为血红色,则假设2不成立
实验操作
实验现象
加少量铁粉振荡后,溶液变成浅绿色,再加KSCN溶液,溶液颜色无变化
向上层清液中滴加新制氯水,溶液变成红色
离子
方程式
2Fe3++Fe===3Fe2+
2Fe2++Cl2===2Fe3++2Cl-
Fe3++3SCN-===Fe(SCN)3
实验
结论
Fe3+遇到较强的还原剂时,会被还原成Fe2+
Fe2+在较强氧化剂的作用下会被氧化成Fe3+
溶液
杂质
除杂方法
FeCl2
FeCl3
加过量铁粉后过滤
FeCl3
FeCl2
通Cl2或加氯水或加H2O2
FeCl2
CuCl2
加过量铁粉后过滤
试剂
选项
甲组
乙组
A
新制氯水、
KSCN溶液
NaOH溶液
B
酸性KMnO4溶液
KSCN溶液
C
KOH溶液
溴水
D
溴水
酸性KMnO4溶液
选项
A
B
C
D
X
FeCl2溶液
FeCl3溶液
Fe
Na2SO4溶液
Y
FeCl3
CuCl2
Al
Na2CO3
Z
Cl2
Fe
NaOH溶液
BaCl2溶液
高中化学人教版 (2019)必修 第一册第三节 化学键第二课时教案设计: 这是一份高中化学人教版 (2019)必修 第一册第三节 化学键第二课时教案设计,共22页。
人教版 (2019)必修 第一册实验活动2 铁及其化合物的性质教学设计: 这是一份人教版 (2019)必修 第一册实验活动2 铁及其化合物的性质教学设计,共16页。
化学必修 第一册第二节 金属材料教案: 这是一份化学必修 第一册第二节 金属材料教案,共9页。教案主要包含了铁及其化合物,铝及铝合金,Cl-外还有等内容,欢迎下载使用。













