

高中化学第一节 原子结构与元素周期表第一课时教学设计
展开第一课时 原子结构
学习目标:1.知道核外电子能量高低与分层排布的关系。2.能够根据核外电子排布规律写出常见简单原子的原子结构示意图。3.知道元素、质量数的含义。
1.原子的构成 质量数
(1)原子的构成
①原子的构成
如碳原子的原子结构模型
②原子的表示方法
(2)质量数
①概念
原子核内所有质子和中子的相对质量取近似整数值后相加所得的数值。
②构成原子的微粒间的两个关系
a.质量数(A)=质子数(Z)+中子数(N)。
b.质子数=核外电子数=核电荷数=原子序数。
(3)原子和离子中微粒间的数量关系
①原子:核外电子数=质子数=核电荷数,如N原子:。
②阳离子:核外电子数=质子数-所带电荷数,如Na+:。
③阴离子:核外电子数=质子数+所带电荷数,如S2-:。
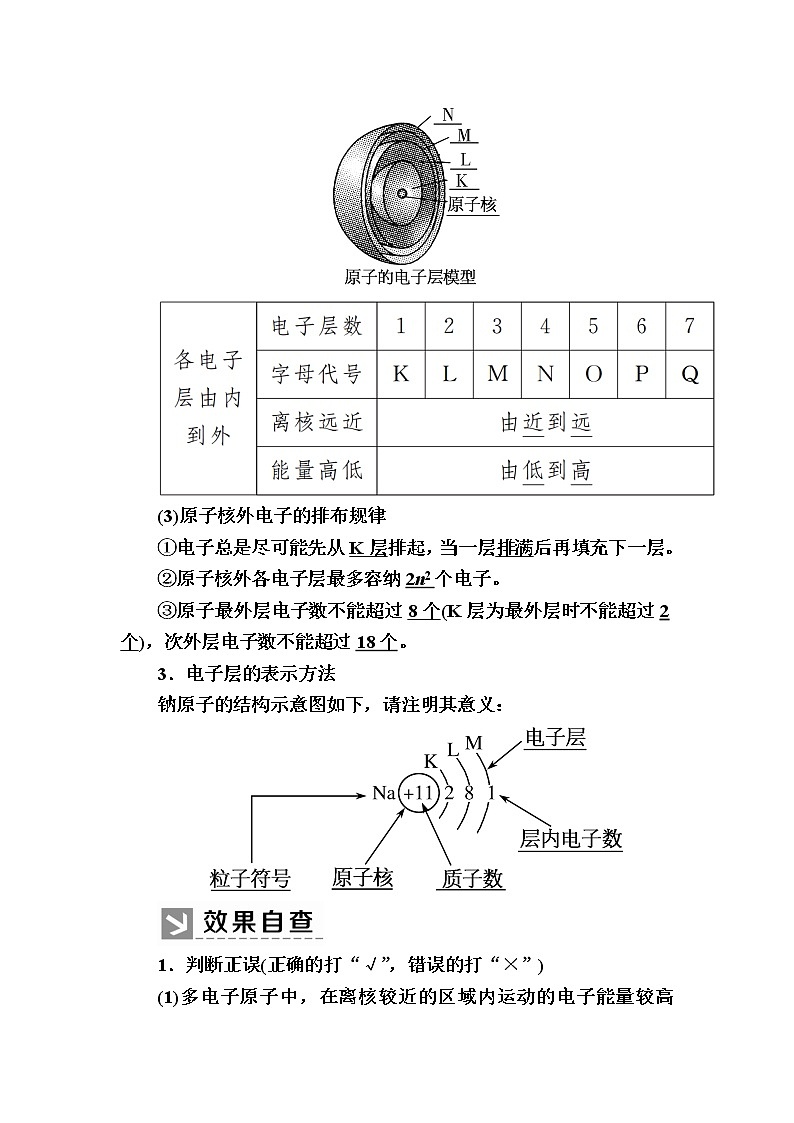
2.电子层
(1)电子的能量
①在多电子原子里,电子的能量不同。
②在离核近的区域运动的电子的能量低,在离核远的区域运动的电子的能量高。
(2)电子层
①概念:在多电子的原子里,把电子运动的不同的区域简化为不连续的壳层,称作电子层。
②不同电子层的表示及能量关系
(3)原子核外电子的排布规律
①电子总是尽可能先从K层排起,当一层排满后再填充下一层。
②原子核外各电子层最多容纳2n2个电子。
③原子最外层电子数不能超过8个(K层为最外层时不能超过2个),次外层电子数不能超过18个。
3.电子层的表示方法
钠原子的结构示意图如下,请注明其意义:
1.判断正误(正确的打“√”,错误的打“×”)
(1)多电子原子中,在离核较近的区域内运动的电子能量较高 ( )
(2)稀有气体元素的原子最外层都有8个电子( )
(3)M层为最外层时容纳的最多电子数不超过8个( )
(4)原子核外各电子层容纳的电子数为2n2个( )
(5)中子数=质量数-质子数( )
[答案] (1)× (2)× (3)√ (4)× (5)√
2.根据硅原子的结构示意图可知,在硅原子的核外电子层中,电子没有出现的电子层为( )
A.K层 B.L层 C.M层 D.N层
[解析] 从硅原子的结构示意图可知,核外有三个电子层,依次为K、L、M层,电子没有在N层出现,D项符合题意。
[答案] D
3.下列关于原子核外电子排布规律的说法错误的是( )
A.K层是能量最低的电子层
B.原子失电子时先失去能量低的电子
C.核外电子总是优先排布在能量较低的电子层上
D.N层为次外层时,最多可容纳的电子数为18
[解析] 离原子核近的电子能量低,离原子核远的电子能量高,则K层是能量最低的电子层,A正确;原子最先失去最外层电子,最外层电子的能量最高,所以原子失电子时先失去能量高的电子,B错误;核外电子总是优先排布在能量较低的电子层上,C正确;电子层的次外层最多容纳18个电子,所以N层为次外层时,最多可容纳的电子数为18,D正确。
[答案] B
知识点一 原子的构成 质量数
1.原子的构成微粒
2.有关粒子间的关系
(1)质量关系
①质量数(A)=质子数(Z)+中子数(N)。
②原子的相对原子质量近似等于质量数。
(2)电性关系
①电中性微粒(原子或分子):
核电荷数=核内质子数=核外电子数。
②带电离子:
质子数≠电子数,具体如下表:
(3)数量关系:原子序数=质子数。
3.符号eq \\al(A,Z)eq \(X,\s\up6(±c))eq \\al(m±,n)中各个字母的含义:
【典例1】 已知R2+核外有a个电子,b个中子。表示R原子符号正确的是( )
A.eq \\al(b,a)R B.eq \\al(a+b-2, a+2)R
C.eq \\al(a+b+2, a+2)R D.eq \\al(a+b,a-2)R
[思路启迪] 解决此类问题应熟练掌握微粒各种物理量之间的定量关系及微粒的表示方法:A=Z+N;阳离子(Z)=电子数+电荷数。
[解析] R2+核外有a个电子,则R原子核外有(a+2)个电子,即核内有(a+2)个质子,R的质量数为a+2+b。
[答案] C
组成原子、离子的各种微粒及相互关系
[针对训练1] 下列有关钯原子(eq \\al(106, 46)Pd)的说法错误的是( )
A.原子序数为46 B.质子数为46
C.电子数为46 D.中子数为46
[解析] 由eq \\al(106, 46)Pd可知,钯的原子序数为46,核外电子数=原子序数=质子数=46;核内中子数为106-46=60,D选项错误。
[答案] D
知识点二 原子核外电子的排布规律
1.原子核外电子的排布规律
2.核外电子排布的表示方法——结构示意图
(1)原子结构示意图
①用小圆圈和圆圈内的符号及数字表示原子核和核电荷数。
②用弧线表示电子层。
③弧线上的数字表示该电子层上的电子数。
④原子结构示意图中,核内质子数=核外电子数。如钠的原子结构示意图:
(2)离子结构示意图
①当主族中的金属元素原子失去最外层所有电子变为离子时,电子层数减少一层,形成与上一周期稀有气体元素原子相同的电子层结构(电子层数相同,每层上所排布的电子数也相同)。如Mg:eq \(――→,\s\up17(-2e-))Mg2+:。
②非金属元素的原子得电子形成简单离子时,形成和同周期稀有气体元素原子相同的电子层结构。
如F:eq \(――→,\s\up17(+e-))F-:
③离子结构示意图中,阳离子核内质子数大于核外电子数,阴离子核内质子数小于核外电子数,且差值为离子所带电荷数。
④单个原子形成简单离子时,其最外层可形成8电子稳定结构(K层为最外层时可形成2电子稳定结构)。
【典例2】 下列说法正确的是( )
A.原子核外各层电子数相等的元素是非金属元素
B.原子最外层只有1个电子的元素一定是金属元素
C.最外层电子数比次外层电子数多的元素一定位于第二周期
D.某元素的离子最外层电子数与次外层电子数相同,该元素一定位于第三周期
[思路启迪] 熟练掌握1~20号元素原子的核外电子排布,找出符合上述要求的元素,从而判断选项是否正确。
[解析] 原子核外各层电子数相等的不一定是非金属元素,如铍元素原子有两个电子层,每层上都是2个电子,但铍元素是金属元素,故A错误;B中原子最外层只有1个电子的元素不一定是金属元素,如H。D中如K+最外层电子数与次外层电子数相同,但K位于第四周期,故A、B、D错误。
[答案] C
短周期元素原子结构的几个特殊关系
[针对训练2] 短周期元素中,A元素原子最外层电子数是次外层电子数的2倍;B元素原子最外层电子数是其内层电子总数的3倍;C元素原子M层电子数等于其L层电子数的一半;D元素原子最外层有1个电子,D的阳离子与B的阴离子电子层结构相同,则4种元素原子序数关系中正确的是( )
A.C>D>B>A B.D>B>A>C
C.A>D>C>B D.B>A>C>D
[解析] A元素原子的次外层电子数只能是2,最外层电子数是4,A的原子序数为6;B元素的内层电子总数只能是2,最外层电子数为6,B的原子序数为8;C元素原子有3个电子层,L层必有8个电子,M层有4个电子,C的原子序数为14;D的阳离子与B的阴离子(即O2-)电子层结构相同,D为Na,原子序数为11;故原子序数C>D>B>A。
[答案] A
知识点三 常见的等电子微粒
1.常见的“10电子”粒子
2.常见的“18电子”粒子
(1)分子:Ar、HCl、H2S、PH3、SiH4、F2、H2O2、N2H4等。
(2)阳离子:K+、Ca2+。
(3)阴离子:P3-、S2-、HS-、Cl-。
【典例3】 A+、B+、C-、D、E五种粒子(分子或离子),它们都分别含有10个电子,已知它们有如下转化关系:
①A++C-eq \(――→,\s\up17(△))D+E↑
②B++C-―→2D
(1)写出①的离子方程式:_____________________;
写出②的离子方程式:_______________________。
(2)除D、E外,请再写出两种含10个电子的分子:________。
(3)除A+、B+外,请再写出两种含10个电子的阳离子:
_________________________________________________。
[思路启迪] 解决涉及“10电子”微粒的相关题目时,既要熟练记忆常见的“10电子”微粒,又要重点掌握相互间发生的反应,最后结合题干信息做出准确判断。
[解析] 先列出常见的10电子粒子,对照分析找出其转化关系。
①分子:Ne、HF、H2O、NH3、CH4
②阳离子:Na+、Mg2+、Al3+、NHeq \\al(+,4)、H3O+
③阴离子:F-、O2-、OH-、N3-、NHeq \\al(-,2)。
其中发生题给模式的反应分别为NHeq \\al(+,4)+OH-eq \(=====,\s\up17(△))NH3↑+H2O,H3O++OH-===2H2O,故A+为NHeq \\al(+,4),B+为H3O+,C-为OH-,D为H2O,E为NH3。
[答案] (1)NHeq \\al(+,4)+OH-eq \(=====,\s\up17(△))H2O+NH3↑
H3O++OH-===2H2O
(2)Ne、CH4(合理即可)
(3)Na+、Mg2+(合理即可)
A、B、C、D均为10电子粒子,其转化关系如下:
该转化一定为NHeq \\al(+,4)+OH-===NH3+H2O,即A为NHeq \\al(+,4)、B为OH-、C为NH3、D为H2O。
[针对训练3] 与OH-具有相同质子数和电子数的粒子是( )
A.H2O B.F-
C.Na+ D.NH3
[解析] OH-有9个质子,10个电子,与F-的质子数和电子数完全相同。
[答案] B
课堂归纳小结
[知识脉络]
[核心要点]
1.常见的“10电子”粒子
(1)分子:Ne、HF、H2O、NH3、CH4
(2)阳离子:Na+、Mg2+、Al3+、NHeq \\al(+,4)、H3O+
(3)阴离子:N3-、O2-、F-、OH-、NHeq \\al(-,2)
1.下列是几种粒子的结构示意图,有关说法不正确的是( )
A.①和②属同种元素
B.②属于稀有气体元素
C.①和③的化学性质相似
D.④属于金属元素
[解析] A项,①和②分别是O和O2-,都属于氧元素,正确;B项,②属于氧元素,不属于稀有气体元素,错误;C项,③为硫原子,①为氧原子,其最外层上均有6个电子,化学性质相似,正确;D项,④为金属钠,正确。
[答案] B
2.某元素的原子核外有三个电子层,M层的电子数是L层电子数的eq \f(1,2),则该元素的原子是 ( )
A.Li B.Al C.Si D.K
[解析] 三个电子层即K、L、M,K层2个电子,L层8个电子,可知M层4个电子,该元素的核外电子排布为2、8、4,是Si元素。
[答案] C
3.1996年2月,德国某研究所在高能加速器中,将eq \\al(70,30)Zn撞入一个eq \\al(208, 82)Pb的原子核并释放出一个中子后,合成一种人造超重元素的原子,该元素原子内中子数为( )
A.278 B.277 C.166 D.165
[解析] eq \\al(70,30)Zn+eq \\al(208, 82)Pb→eq \\al(277,112)X+eq \\al(1,0)n所以该元素原子内中子数为277-112=165。
[答案] D
4.根据元素周期表判断,下列叙述不正确的是( )
A.K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等
B.L层电子为偶数的所有主族元素所在族的序数与该元素原子L层电子数相等
C.L层电子为奇数的所有主族元素所在族的序数与该元素原子L层电子数相等
D.M层电子为奇数的所有主族元素所在族的序数与该元素原子M层电子数相等
[解析] A项,K层电子为奇数,K层最多容纳2个电子,因此K层电子数为1,属于ⅠA族,正确;B项,L层最多容纳8个电子,如果为偶数是2、4、6、8,若是2、4、6所在的族是ⅡA、ⅣA、ⅥA,如果是8,该元素可能是0族,也可能是其他族,错误;C项,L层为奇数,可能是1、3、5、7,所在族分别是ⅠA、ⅢA、ⅤA、ⅦA,与L层电子数相等,正确;D项,M层属于第三层,电子为奇数,数值分别是1、3、5、7,分别位于ⅠA、ⅢA、ⅤA、ⅦA,与原子M层电子数相等,正确。
[答案] B
5.按要求填空。
(1)某元素原子K层和M层电子数相同,该元素的元素符号是________。
(2)某元素原子最外层电子数是次外层电子数的2倍,该元素的原子结构示意图是________。
(3)某元素原子M电子层的电子数为K、L电子层电子数和的一半,该元素的元素名称是________。
[解析] (1)K层最多容纳2个电子,M层的电子数和K层相同,则M层上有2个电子,其原子结构示意图为,为镁元素。(2)最外层电子数不超过8,最外层电子数是次外层电子数2倍的元素,其原子结构示意图为。(3)M电子层上有电子,则K、L层已充满电子,电子数分别为2、8,那么M层电子数为5,即是15号磷元素。
[答案] (1)Mg (2) (3)磷
课后作业(十八)
[基础巩固]
一、原子的构成 质量数
1.eq \\al(131, 53)I是常规核裂变产物之一,可以通过测定大气或水中eq \\al(131, 53)I的含量变化来检测核电站是否发生放射性物质泄漏。下列有关eq \\al(131, 53)I的叙述中错误的是( )
A.eq \\al(131, 53)I的化学性质与eq \\al(127, 53)I相同
B.eq \\al(131, 53)I的原子序数为53
C.eq \\al(131, 53)I的原子核外电子数为78
D.eq \\al(131, 53)I的原子核内中子数多于质子数
[解析] 核外电子数=质子数=53。
[答案] C
2.有aXn+和bYm-两种元素的简单离子,若它们的电子层结构相同,则下列关系正确的是( )
A.b-a=n+m B.a-b=n-m
C.核电荷数Y
[解析] 因为两种离子的电子层结构相同,即其核外电子数相同,且阴离子的核电荷数(或质子数)小于阳离子的核电荷数(或质子数)。由此可知:①a-n=b+m,a-b=m+n,A、B选项不正确;②a>b,C正确,D不正确。
[答案] C
3.下列各组中两种微粒所含电子数不相等的是( )
A.H3O+和OH- B.CO和N2
C.HNO2和NOeq \\al(-,2) D.CHeq \\al(+,3)和NHeq \\al(+,4)
[解析] H3O+和OH-均为10电子微粒,A项错误;CO和N2均为14电子微粒,B项错误;HNO2和NOeq \\al(-,2)均为24电子微粒,C项错误;CHeq \\al(+,3)为8电子微粒,NHeq \\al(+,4)为10电子微粒,D项正确。
[答案] D
二、原子核外电子的排布规律
4.某短周期元素的原子最外层电子数是次外层电子数的3倍,那么该原子( )
A.有3个电子层 B.有2个电子层
C.最外层电子数是8 D.核电荷数是10
[解析] 第一层排满为2个电子,第二层排满为8个电子,第三层为最外层时,最多排8个电子,若该原子有3个电子层,依题意可知最外层(第3层)要排到24个电子,这不可能,则该原子只有2个电子层,第一层为2个电子,第二层为6个电子。
[答案] B
5.某元素原子的最外层电子数是次外层的m倍(m为大于1的整数),则该原子的核外电子总数为( )
A.2m B.2m+10
C.2m+2 D.m+2
[解析] 按照原子核外电子排布的一般规律,最外层电子数不超过8个,最外层电子数是次外层的m倍,所以次外层电子数<8,即次外层只能为K层,电子数为2,最外层电子数是2m,该原子的核外电子总数为(2m+2)。
[答案] C
6.下列关于核外电子排布的说法中不正确的是( )
A.第二电子层最多可容纳的电子数为8
B.次外层最多可容纳的电子数为18
C.最多可容纳2个电子的电子层一定是第一电子层
D.最多可容纳8个电子的电子层一定是第二电子层
[解析] 根据核外电子排布规律可知,第二电子层最多可容纳的电子数为8,A正确;次外层最多可容纳的电子数为18,B正确;最多可容纳2个电子的电子层一定是第一电子层,即K层,C正确;由于最外层电子数不超过8,因此最多可容纳8个电子的电子层不一定是第二电子层,D错误。
[答案] D
三、常见的等电子微粒
7.与NHeq \\al(+,4)含有不同电子数的微粒是( )
A.Al3+ B.H2O2 C.OH- D.CH4
[解析] Al3+中具有13个质子和10个电子,则与NHeq \\al(+,4)具有相同电子数,故A不符合题意;H2O2中有18个质子和18个电子,则与NHeq \\al(+,4)具有不相同电子数,故B符合题意;OH-中有9个质子和10个电子,则与NHeq \\al(+,4)具有相同电子数,故C不符合题意;CH4中具有10个质子和10个电子,则与NHeq \\al(+,4)具有相同电子数,故D不符合题意;综上所述,故选B。
[答案] B
8.和Na+离子都具有相同电子数的一组微粒是( )
A.Na NHeq \\al(+,4) B.CO N2
C.CH4 H2O D.Mg N2H4
[解析] Na+离子核外电子总数为10。Na核外电子总数为11,NHeq \\al(+,4)核外电子总数为10,故A错误;CO和N2核外电子总数为14,故B错误;CH4和H2O核外电子总数为10,故C正确;Mg核外电子总数为12;N2H4核外电子总数为18,故D错误;故选C。
[答案] C
[能力提升]
9.同温同压下,等容积的两个密闭集气瓶中分别充满12C18O和14N2两种气体。关于这两个容器中气体的说法正确的是( )
A.质子数相等,质量不等
B.分子数和质量都不相等
C.分子数、质量均相等
D.原子数、中子数和质量数均相等
[解析] 由阿伏加德罗定律可知两容器中所盛气体的分子数相等;因12C18O中原子质量数之和为30,故其摩尔质量为30 g/ml,而14N2中原子质量数之和为28,故其摩尔质量为28 g/ml,故两容器气体的质量不相等;一个12C18O分子中质子数为14,中子数为(12-6)+(18-8)=16,而一个14N2分子中质子数为7×2=14,中子数为(14-7)×2=14,故两容器气体的中子数不同,质子数相同;故A项正确。
[答案] A
10.下列叙述中,正确的是( )
A.核外电子排布完全相同的两种微粒,其化学性质一定相同
B.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布
C.核外电子排布相同的两原子一定属于同种元素
D.阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同
[解析] 核外电子排布完全相同的两种微粒,化学性质不一定相同,如K+和Cl-,A项错误;H+核外没有电子,不具有稀有气体元素原子的核外电子排布,B项错误;阴离子的核外电子排布一般与同一周期稀有气体元素原子的核外电子排布相同,D项错误。
[答案] C
11.在离子ROeq \\al(n-,3)中,共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数目是( )
A.A-x+n+48 B.A-x+n+24
C.A-x-n-24 D.A+x-n-24
[解析] 在离子ROeq \\al(n-,3)中,共有x个核外电子,则R原子的核外电子数为x-n-24,则R原子核内质子数为x-n-24,则R原子核内含有的中子数目是A-x+n+24。
[答案] B
12.由eq \\al(2,1)H和eq \\al(18, 8)O组成的11 g水中,含有的中子的物质的量为( )
A.4.5 ml B.5 ml C.5.5 ml D.6 ml
[解析] 由eq \\al(2,1)H和eq \\al(18, 8)O组成的水相对分子质量为22,
1 ml 2Heq \\al(18,2)O含12 ml中子,故11 g水中含有中子的物质的量为eq \f(11 g,22 g·ml-1)×12=6 ml。
[答案] D
14.某微粒的结构示意图如图所示:
(1)x表示________,y表示________。
(2)当y=7时,若该微粒为中性原子,则x =________。
(3)当y=8时,若该微粒带有两个单位负电荷,则该微粒的表示符号为________;若该微粒带有一个单位正电荷,则该微粒的表示符号为________。
[解析] (1)x表示质子数(或核电荷数),y表示最外层电子数;(2)当y=7时,该微粒为中性原子,则质子数=核外电子数=2+8+7=17;(3)当y=8时,若该微粒带有两个单位的负电荷,质子数=核外电子数-所带电荷数=18-2=16,故该微粒为S2-;若该微粒带有一个单位的正电荷,质子数=核外电子数+所带电荷数=18+1=19,故该微粒为K+。
[答案] (1)质子数 最外层电子数
(2)17 (3)S2- K+
15.已知A、B、C三种元素的原子中,质子数为A
(1)三种元素的名称和符号:
A________,B________,C________。
(2)画出三种元素的原子结构示意图:
A________,B________,C________。
[解析] 由A元素的原子最外层电子数是次外层电子数的2倍,可知A是碳元素;B元素的原子核外M层电子数是L层电子数的一半,可知B为硅元素;C元素的原子次外层电子数比最外层电子数多1个,可知C应为氯元素。
[答案] (1)碳C 硅Si 氯Cl
(2)
16.Ⅰ.已知A、B、C、D是中学化学中常见的四种不同微粒。它们之间存在如下图中转化关系:
如果A、B、C、D均是10电子的微粒,请写出:A的化学式________;D的化学式________。
Ⅱ.用A+、B-、C2-、D、E、F和G分别表示含有18个电子的七种微粒(离子或分子),请回答:
(1)A元素是________,B元素是________,C元素是________(用元素符号表示)。
(2)D是由两种元素组成的双原子分子,其分子式是________。
(3)F是由两种元素组成的三原子分子,其分子式是________,将其通入足量的NaOH溶液,反应的离子方程式为_______。
(4)G分子中含有4个原子,其分子式是________。
[解析] Ⅰ.如果A、B、C、D均是10电子的微粒,结合10电子微粒的结构性质特征,可知A为NHeq \\al(+,4),B为OH-,C为NH3,D为H2O。
Ⅱ.常见的18e-微粒有:
阳离子:K+、Ca2+;阴离子:P3-、S2-、HS-、Cl-;分子有Ar、HCl、H2S、PH3、SiH4、F2、H2O2、N2H4、C2H6等。结合题目所给条件,不难确定答案。
[答案] Ⅰ.NHeq \\al(+,4) H2O
Ⅱ.(1)K Cl S (2)HCl (3)H2S H2S+2OH-===S2-+2H2O (4)H2O2(或PH3)
14.以下是四种粒子的结构示意图:
(1)上述粒子中其单质具有两性的元素是________(填字母序号),将其加入氢氧化钠溶液反应的离子方程式为:
______________________________________________。
(2)C单质与水发生反应的离子方程式为___________。
(3)电子层结构与C相同、化学性质最稳定的元素原子的核电荷数是________,用原子结构与元素性质的关系说明它化学性质稳定的原因_____________________________________。
(4)A的一种同位素可用于考古测定文物的年代,这种同位素的符号是________,这种用途取决于它的________性。
[解析] 四种粒子按A~D的顺序依次是C、Cl、Na+、Al3+,其中单质具有两性的元素为Al,Al能与NaOH溶液反应生成H2;Na能与水反应产生H2;电子层结构与Na+相同的原子为Ne,其最外层已达8电子稳定结构,故化学性质稳定;考古工作者利用eq \\al(14, 6)C来测定文物的年代。
[答案] (1)D 2Al+2OH-+2H2O===2AlOeq \\al(-,2)+3H2↑ (2)2Na+2H2O===2Na++2OH-+H2↑
(3)10 该原子最外层已达8电子稳定结构,故化学性质稳定 (4)eq \\al(14, 6)C 放射
阳离子(Rm+)
质子数>电子数
质子数=电子数+m
阴离子(Rm-)
质子数<电子数
质子数=电子数-m
特殊关系
元素
最外层电子数等于次外层电子数的一半
Li、Si
最外层电子数等于次外层电子数
Be、Ar
最外层电子数等于次外层电子数的2倍
C
最外层电子数等于次外层电子数的3倍
O
最外层电子数等于次外层电子数的4倍
Ne
最外层电子数等于电子层数
H、Be、Al
分子
离子
一核10电子
Ne
N3-、O2-、F-、Na+、Mg2+、Al3+
二核10电子
HF
OH-
三核10电子
H2O
NHeq \\al(-,2)
四核10电子
NH3
H3O+
五核10电子
CH4
NHeq \\al(+,4)
高中人教版 (2019)实验活动3 同周期、同主族元素性质的递变第一课时教案设计: 这是一份高中人教版 (2019)实验活动3 同周期、同主族元素性质的递变第一课时教案设计,共19页。
高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表第三课时教案设计: 这是一份高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表第三课时教案设计,共22页。
高中化学人教版 (2019)必修 第一册第二节 金属材料第一课时教案设计: 这是一份高中化学人教版 (2019)必修 第一册第二节 金属材料第一课时教案设计,共19页。













