高中化学苏教版选修4 化学反应原理第二单元 化学反应的方向和限度一课一练
展开系列微专题2:化学反应速率和化学平衡图象
1.解答化学平衡图象题的方法
2.化学平衡图象题的解答“两原则”
(1)“定一议二”原则
在化学平衡图象中,了解纵坐标、横坐标和曲线所表示的三个量的意义。确定横坐标所表示的量后,讨论纵坐标与曲线的关系,或确定纵坐标所表示的量后,讨论横坐标与曲线的关系。
(2)“先拐先平,数值大”原则
对于同一化学反应在化学平衡图象中,先出现拐点的反应先达到平衡,先出现拐点的曲线表示的温度较高[如图甲所示,α(转化率)表示反应物的转化率]或表示的压强较大[如图乙所示,φ(A)表示反应物的体积分数]。
甲 乙
甲表示:T2>T1;正反应放热。
乙表示:p1<p2;正反应为气体分子数减小的反应。
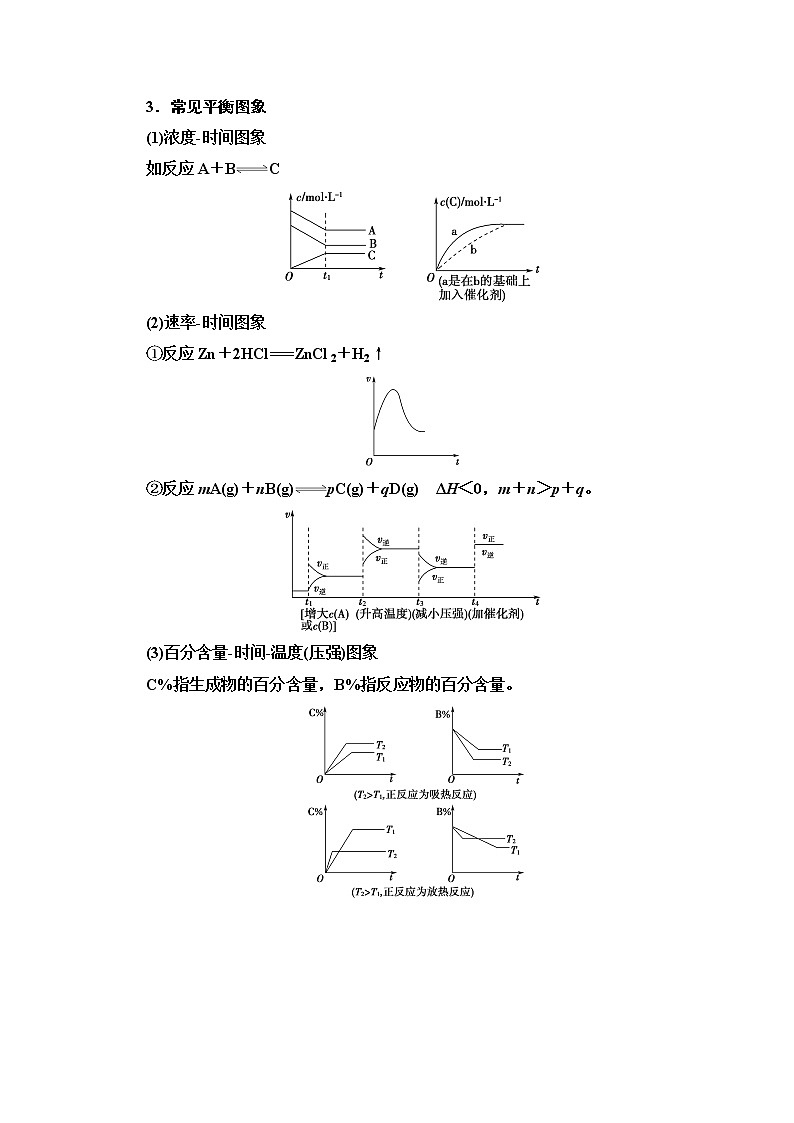
3.常见平衡图象
(1)浓度时间图象
如反应A+BC
(2)速率时间图象
①反应Zn+2HCl===ZnCl2+H2↑
②反应mA(g)+nB(g)pC(g)+qD(g) ΔH<0,m+n>p+q。
(3)百分含量时间温度(压强)图象
C%指生成物的百分含量,B%指反应物的百分含量。
(4)恒压(温)线
该类图的纵坐标为反应物的转化率(α)或物质的平衡浓度(c),横坐标为温度(T)或压强(p),常见类型如图所示:
(5)其他
如图所示曲线是其他条件不变时,某反应物的最大转化率(α)与温度(T)的关系曲线,图中标出的1、2、3、4四个点,表示v(正)>v(逆)的点是3,表示v(正)<v(逆)的点是1,而2、4点表示v(正)=v(逆)。
可逆反应mA(s)+nB(g)eC(g)+fD(g),反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示,下列叙述中正确的是( )
A.达到平衡后,若升高温度,平衡右移
B.达到平衡后,加入催化剂C%增大
C.化学方程式中“n>e+f”
D.达到平衡后,增加A的量有利于平衡向右移动
C [压强不变时,升高温度(200 ℃→300 ℃→400 ℃),C%减小,说明平衡逆向移动,逆反应为吸热反应,则正反应为放热反应。A.该反应的正反应是放热反应,达到平衡后,若升温,平衡左移,故A错误;B.达到平衡后,加入催化剂不会影响化学平衡的移动,C的百分含量不变,故B错误;C.压强增大,C%含量增大,说明平衡正向进行,正反应是气体体积减小的反应,n>e+f,故C正确;D.达到平衡后,A是固体,不影响平衡移动,所以增加A的量平衡不移动,故D错误。]
1.在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
A.图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响
B.图Ⅱ表示的是t1时刻加入催化剂对反应速率的影响
C.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化剂效率比乙高
D.图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高
B [A项,图Ⅰ改变的条件应是缩小容器体积;B项,由于同等程度地加快正、逆反应速率,所以加入的应是催化剂;C项,由于平衡发生了移动,所以加入的不是催化剂,改变的应是温度,且乙的温度高;D项,增大压强,SO2的转化率增大,与图Ⅲ表示的不一致。]
2.对于可逆反应:aA(g)+bB(g)cC(g)+dD(g) ΔH,使之同时符合如下两图中各曲线的条件是( )
A.a+b>c+d T1>T2 ΔH>0
B.a+b>c+d T1<T2 ΔH<0
C.a+b<c+d T1>T2 ΔH>0
D.a+b<c+d T1<T2 ΔH<0
B [由于T2时反应先达到化学平衡,则T2>T1,且T2时生成物的平衡浓度较小,说明升高温度使平衡逆向移动,即ΔH<0;反应平衡(v正=v逆)后,增大压强,v正>v逆,即平衡正向移动,说明正反应是气体分子数减小的反应,即a+b>c+d。综上可知,B项正确。]
高中化学苏教版选修4 化学反应原理第二单元 溶液的酸碱性第2课时课堂检测: 这是一份高中化学苏教版选修4 化学反应原理第二单元 溶液的酸碱性第2课时课堂检测,共8页。
苏教版选修4 化学反应原理第二单元 化学反应的方向和限度第3课时当堂检测题: 这是一份苏教版选修4 化学反应原理第二单元 化学反应的方向和限度第3课时当堂检测题,共9页。
高中化学苏教版选修4 化学反应原理专题二 化学反应与化学平衡第三单元 化学平衡的移动练习: 这是一份高中化学苏教版选修4 化学反应原理专题二 化学反应与化学平衡第三单元 化学平衡的移动练习,共10页。