人教版 (新课标)必修1第四章 非金属及其化合物综合与测试教案设计
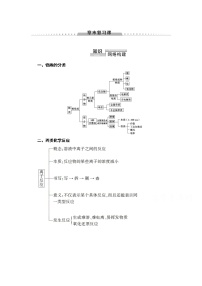
展开一、非金属及其化合物的性质及其应用
二、非金属及其化合物间的转化关系
1.硅及其化合物的转化关系
2.氯及其化合物的转化关系
3.硫及其化合物的转化关系
4.氮及其化合物的转化关系
5.不同非金属之间的转化关系
常见非金属单质及化合物的性质及其应用 |
1.硅及其化合物
(1)Si、SiO2与碱、氢氟酸的反应。
(2)H2SiO3的弱酸性及其制备。
2.氯及其化合物
(1)Cl2与变价金属(Fe、Cu)、H2O、碱的反应。
(2)次氯酸的弱酸性、强氧化性等。
3.硫的化合物
(1)SO2酸性氧化物的性质、漂白性、还原性、氧化性等。
(2)H2SO4的三大特性等。
4.氮的化合物
(1)NO、NO2的性质及制备。
(2)NH3与H2O、O2、酸的反应。
(3)铵盐的不稳定性和铵盐与碱的反应。
(4)HNO3的强氧化性。
1.实验室检验SO2中混有CO2的装置如图所示。下列说法正确的是( )
A.①、②、③中可依次盛放饱和NaHCO3溶液、品红溶液、澄清石灰水
B.②的主要作用是除去SO2
C.③中观察到的现象是先有白色沉淀产生,当沉淀量达最大后再不断溶解
D.该装置也可用于检验NO2中混有NO
C [SO2与NaHCO3反应会生成CO2,无法判断CO2的来源,A错误;①是用来除去SO2的,②是用来检验SO2是否除尽的,B错误;③中澄清石灰水与CO2反应,先生成碳酸钙,CO2过量后生成碳酸氢钙,观察到的现象是先有白色沉淀产生,当沉淀量达最大后再不断溶解,C正确;NO2与水反应会生成NO,无法检验NO2中混有NO,D错误。]
2.甲和乙两种物质混合反应(反应可加热),将所得气体通入适量的丙中,丙中没有明显现象产生的是 ( )
选项 | 甲 | 乙 | 丙 |
A | C | 浓硫酸 | 澄清石灰水 |
B | MnO2 | 稀盐酸 | 品红溶液 |
C | 浓氨水 | 碱石灰 | AlCl3溶液 |
D | Cu | 浓硝酸 | Ba(HSO3)2溶液 |
B [A项,C与浓硫酸在加热条件下反应生成CO2、SO2和H2O,澄清石灰水能与CO2、SO2反应产生白色沉淀;B项,MnO2与稀盐酸不反应,加热时也得不到Cl2,所以品红溶液不褪色;C项,浓氨水与碱石灰作用可得NH3,NH3溶于水与AlCl3溶液反应产生白色沉淀;D项,Cu与浓硝酸反应产生NO2,NO2溶于水生成HNO3和NO,HNO3能将HSO氧化为SO,从而产生BaSO4白色沉淀。]
常见气体的制法与性质探究 |
气体的制备与性质探究是化学试题的重要题型,综合考查化学的核心素养,是近几年高考试题的热点内容。其主要命题点有:
(1)常见气体(H2、O2、CO2、Cl2、NH3、SO2等)的制备原理。
(2)常见气体制备的发生装置类型
固+固气,固+液―→气,固+液气。
(3)常见气体的干燥,除杂试剂及其装置。
(4)常见气体的性质探究装置。
(5)常见气体的收集和尾气处理装置或方法。
3.钌(Ru)是一种硬而脆的多价稀有金属,性质很稳定。实验室用H2还原RuO2来制备金属钌的装置如图所示。下列说法不正确的是( )
A.加热试管前,应先收集气体并点燃,通过爆鸣声判断气体的纯度
B.洗气瓶中盛装的可能是NaOH溶液,用于除去HCl
C.结束反应时,先关闭活塞K,再停止加热
D.启普发生器不可用于二氧化锰与浓盐酸反应制备氯气
C [可燃性气体加热前必须验纯,可通过爆鸣声判断氢气的纯度,A正确。盐酸具有挥发性,洗气瓶的作用是除去挥发出的HCl气体,可以盛装NaOH溶液,B正确。结束反应时,应先停止加热,再关闭活塞K,否则产生的金属容易再次被氧化,C错误。二氧化锰与浓盐酸反应制备氯气需要加热,故启普发生器不可用于二氧化锰与浓盐酸反应制备氯气,D正确。]
4.漂白粉在工业上有着重要的应用,某同学利用下列仪器在实验室中进行制备漂白粉的实验。请回答下列问题:
Ⅰ.氯气的制备
(1)装置C的名称为 。
(2)实验室选择图中的装置制备并收集干燥的氯气,其连接顺序为 (填字母)。
(3)装置F的作用为 。
Ⅱ.漂白粉的制备
(4)已知:氯气和石灰乳在反应的过程中会放热,当温度较高时会生成Ca(ClO3)2。为了制得纯度较高的漂白粉并提高产率,实验中可采取的措施有 、 (不改变石灰乳的浓度和体积)。
(5)若将100 mL 12.0 mol·L-1盐酸与3.48 g MnO2反应制得的氯气全部通入足量的石灰乳中,理论上最多可制得Ca(ClO)2 g。
[解析] (2)实验室利用MnO2与浓盐酸在加热条件下反应制备Cl2,因为浓盐酸易挥发,所以制得的Cl2中混有HCl和水蒸气两种杂质气体,要收集干燥的Cl2,则要先用饱和食盐水除去其中的HCl气体,再用浓硫酸除去其中的水蒸气,最后用向上排空气法收集Cl2,多余的Cl2用碱石灰吸收,故仪器的连接顺序为BFEDC。
(3)根据(2)中分析可知,饱和食盐水用来除去Cl2中混有的HCl杂质。
(4)为了制得纯度较高的漂白粉并提高产率,则应减少副产物的生成,根据题意知,温度较高时会生成Ca(ClO3)2,故可采用冷却反应装置、缓慢通入氯气让反应物充分接触等措施。
(5)n(MnO2)==0.04 mol,n(HCl)=12.0 mol·L-1×100×10-3 L=1.2 mol,由MnO2与浓盐酸反应的化学方程式:
MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
1 4
0.04 mol 1.2 mol
可判断出浓盐酸远远过量,故要用MnO2的量进行计算。设生成Ca(ClO)2的质量为x。根据反应方程式可得出如下关系式:
2MnO2~2Cl2~Ca(ClO)2
2 mol 143 g
0.04 mol x
解得x=2.86 g。
[答案] (1)球形干燥管 (2)BFEDC
(3)除去Cl2中混有的HCl杂质
(4)缓慢通入氯气 充分冷却反应装置(其他合理答案也可)
(5)2.86
选修4 化学反应原理第二章 化学反应速率和化学平衡综合与测试教学设计: 这是一份选修4 化学反应原理第二章 化学反应速率和化学平衡综合与测试教学设计,共9页。
高中化学人教版 (新课标)选修4 化学反应原理第一章 化学反应与能量综合与测试教案及反思: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第一章 化学反应与能量综合与测试教案及反思,共4页。
高中化学人教版 (新课标)必修1第三章 金属及其化合物综合与测试教学设计: 这是一份高中化学人教版 (新课标)必修1第三章 金属及其化合物综合与测试教学设计,共4页。