化学选修4 化学反应原理第1节 化学反应的方向教学设计
展开高二化学 学科课时教学设计
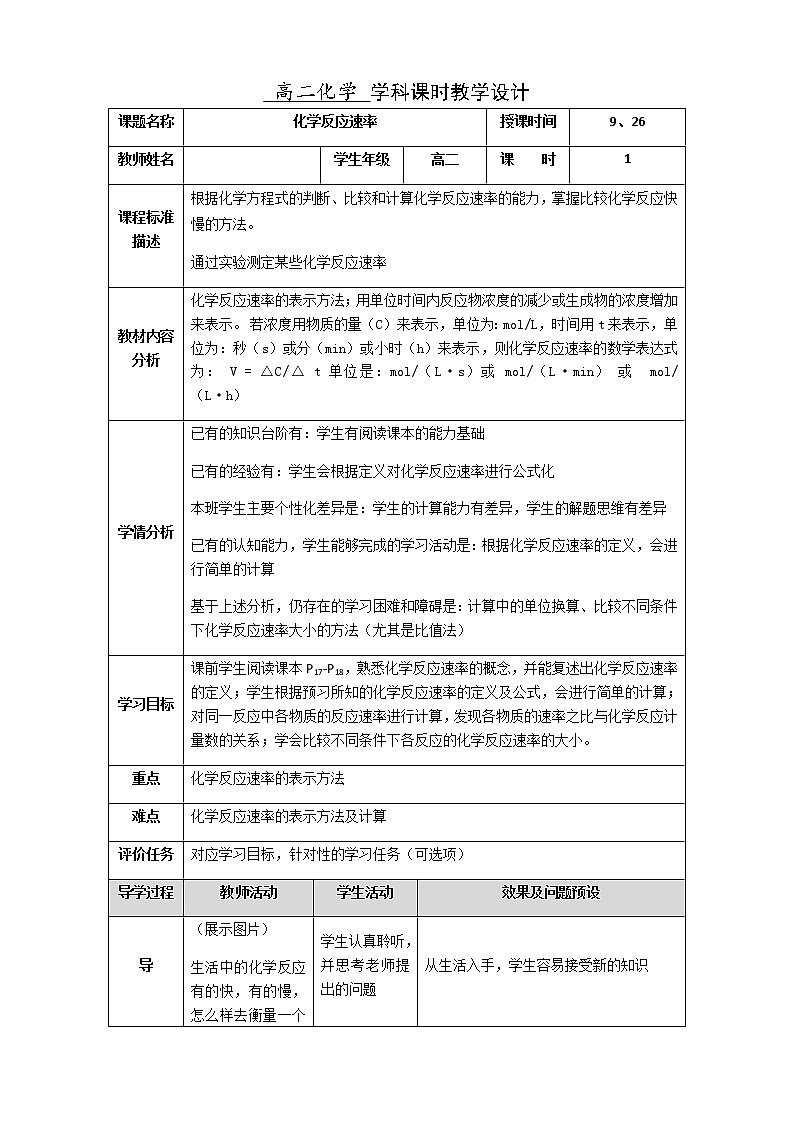
课题名称 | 化学反应速率 | 授课时间 | 9、26 | ||||
教师姓名 |
| 学生年级 | 高二 | 课 时 | 1 | ||
课程标准描述 | 根据化学方程式的判断、比较和计算化学反应速率的能力,掌握比较化学反应快慢的方法。 通过实验测定某些化学反应速率 | ||||||
教材内容分析 | 化学反应速率的表示方法;用单位时间内反应物浓度的减少或生成物的浓度增加来表示。 若浓度用物质的量(C)来表示,单位为:mol/L,时间用t来表示,单位为:秒(s)或分(min)或小时(h)来表示,则化学反应速率的数学表达式为: V = △C/△ t 单位是:mol/(L·s)或 mol/(L·min) 或 mol/(L·h) | ||||||
学情分析 | 已有的知识台阶有:学生有阅读课本的能力基础 已有的经验有:学生会根据定义对化学反应速率进行公式化 本班学生主要个性化差异是:学生的计算能力有差异,学生的解题思维有差异 已有的认知能力,学生能够完成的学习活动是:根据化学反应速率的定义,会进行简单的计算 基于上述分析,仍存在的学习困难和障碍是:计算中的单位换算、比较不同条件下化学反应速率大小的方法(尤其是比值法) | ||||||
学习目标 | 课前学生阅读课本P17-P18,熟悉化学反应速率的概念,并能复述出化学反应速率的定义;学生根据预习所知的化学反应速率的定义及公式,会进行简单的计算;对同一反应中各物质的反应速率进行计算,发现各物质的速率之比与化学反应计量数的关系;学会比较不同条件下各反应的化学反应速率的大小。 | ||||||
重点 | 化学反应速率的表示方法 | ||||||
难点 | 化学反应速率的表示方法及计算 | ||||||
评价任务 | 对应学习目标,针对性的学习任务(可选项) | ||||||
导学过程 | 教师活动 | 学生活动 | 效果及问题预设 | ||||
导 | (展示图片) 生活中的化学反应有的快,有的慢,怎么样去衡量一个反应的快慢呢? | 学生认真聆听,并思考老师提出的问题 | 从生活入手,学生容易接受新的知识 | ||||
思 | 请同学们阅读课本P24-P25,用黑笔画出重点和疑点,并完成导学提纲中的基础感知部分 活动一:巡视课堂,记录学生预习过程中存在的问题 活动二:根据需要对小组内的个别学生进行辅导 | 活动一:阅读课本
活动二:独立完成导学提纲中的预设问题 | 1、定义:通常用单位时间内 或 来表示。 2、计算公式: 3、单位: 或 【练习】在2SO2+O2 2SO3 反应中:如果2s内SO2的浓度由6 mol/L下降为2 mol/L ,那么,用SO2浓度变化来表示的化学反应速率为 。
| ||||
议 | 请同学们全体起立,以小组为单位来讨论“深入学习”部分的内容 | 小组起立讨论 | 任务一:同一化学反应中,各物质的化学反应速率与化学计量数有什么关系?
任务二:如果比较不同条件下个反应的速率大小?有哪些办法?
| ||||
展 | 同学们把学习的成果展示给大家 | 学生上黑板计算出各物质的反应速率 |
| ||||
评 | 点评学生活动
归纳总结今天所学的知识
|
学生认真听讲
整理笔记 | 1、定义:单位时间内反应物的浓度减少量或生成物浓度的增加量 2、计算公式:V = △C/△ t 3、单位:mol/(L·s)或 mol/(L·min) 4、规律
| ||||
检 |
请同学们在3分钟之内完成导学提纲中的“迁移应用”部分
巡视课堂,查看学生堂测的效果
根据需要来评讲习题,规范答题要求 |
活动一:独立完成“迁移应用”
活动二:小组核对答案 | 1. 下列关于化学反应速率的说法中,正确的是( ) A.化学反应速率是指某一时刻,某种反应物的瞬时反应速率 B.化学反应速率为0.8 mol·L-1·s-1是指反应1s时某物质的浓度为0.8 mol·L-1 C.根据化学反应速率的大小可以推知化学反应进行得快慢 D.对于一个化学反应来说,其反应速率越大,反应现象就越明显 2. A和B反应生成C,假定反应由A、B开始,它们的起始浓度均为1mol/L。反应进行2min后A的浓度为0.8mol/L,B的浓度为0.6mol/L,C的浓度为0.6mol/L。则2min内反应的平均速率 v A= ,v B= ,v C= 。该反应的化学反应方程式为 。 | ||||
板书设计 | 化学反应速率 5、定义:单位时间内反应物的浓度减少量或生成物浓度的增加量 6、计算公式:V = △C/△ t 7、单位:mol/(L·s)或 mol/(L·min) 8、规律 | ||||||
教学反思 |
| ||||||
检查结果及修改意见:合格[ ] 不合格[ ]
组长(签字): 检查日期: 年 月 日
高中化学鲁科版选修4 化学反应原理第2章 化学反应的方向、限度与速率第4节 化学反应条件的优化——工业合成氨教案及反思: 这是一份高中化学鲁科版选修4 化学反应原理第2章 化学反应的方向、限度与速率第4节 化学反应条件的优化——工业合成氨教案及反思,共3页。
高中化学鲁科版选修4 化学反应原理第1节 化学反应的方向第1课时教学设计及反思: 这是一份高中化学鲁科版选修4 化学反应原理第1节 化学反应的方向第1课时教学设计及反思,共4页。
鲁科版选修4 化学反应原理第3节 化学反应的速率教学设计: 这是一份鲁科版选修4 化学反应原理第3节 化学反应的速率教学设计,共3页。