
所属成套资源:2021版浙江高考选考化学一轮复习教师用书精品教案
2021版浙江高考选考化学一轮复习教师用书:专题61 第一单元 化学反应中的热效应
展开
第一单元 化学反应中的热效应
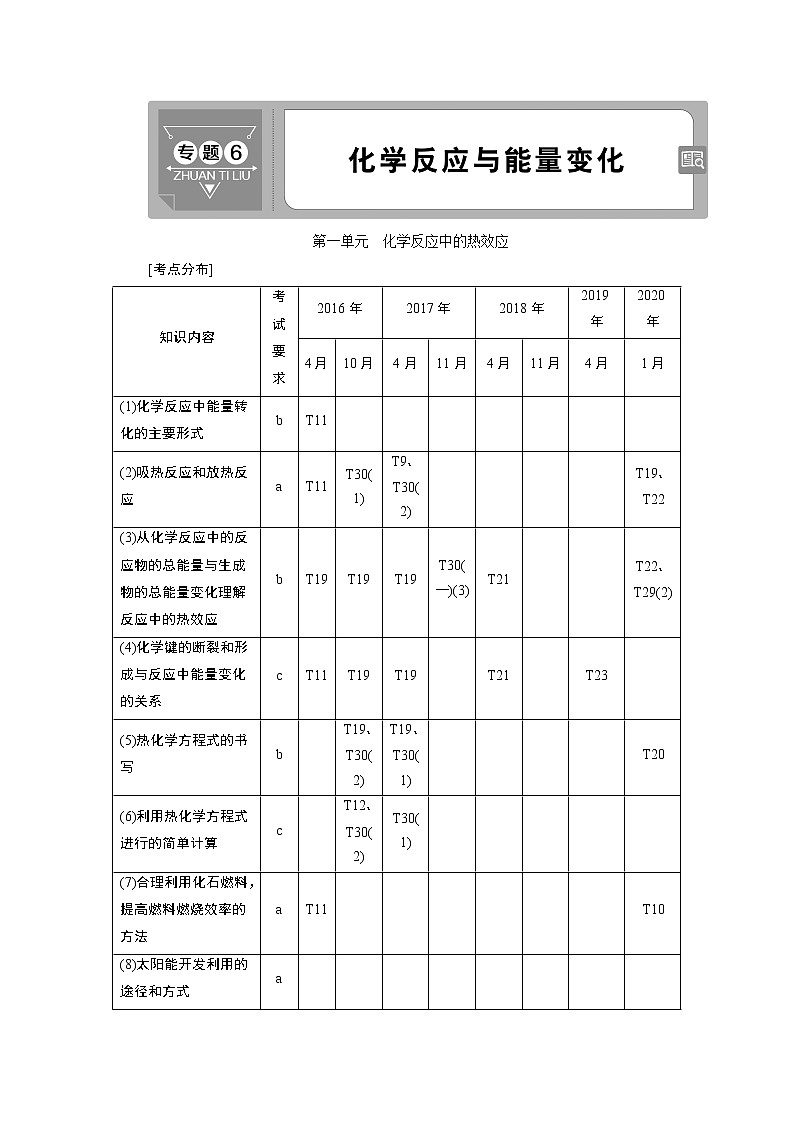
[考点分布]
知识内容
考试
要求
2016年
2017年
2018年
2019年
2020年
4月
10月
4月
11月
4月
11月
4月
1月
(1)化学反应中能量转化的主要形式
b
T11
(2)吸热反应和放热反应
a
T11
T30(1)
T9、T30(2)
T19、T22
(3)从化学反应中的反应物的总能量与生成物的总能量变化理解反应中的热效应
b
T19
T19
T19
T30(一)(3)
T21
T22、T29(2)
(4)化学键的断裂和形成与反应中能量变化的关系
c
T11
T19
T19
T21
T23
(5)热化学方程式的书写
b
T19、T30(2)
T19、T30(1)
T20
(6)利用热化学方程式进行的简单计算
c
T12、T30(2)
T30(1)
(7)合理利用化石燃料,提高燃料燃烧效率的方法
a
T11
T10
(8)太阳能开发利用的途径和方式
a
(9)生物质能的利用途径
a
T10
(10)氢能的优点、开发与利用,了解化石燃料的不可再生性及其给环境带来的问题
a
T11
T9
T6
T5
T8
(11)反应热
a
T12
T22
(12)焓变的涵义
a
T12
T22
(13)焓变与键能的关系
c
T19
T21
T23
(14)中和热的测定
b
(15)标准燃烧热的概念
a
T30(2)
(16)热值的概念
a
(17)盖斯定律及其简单计算
b
T30(2)
T30(2)
T30(1)
T19
T21
T23
焓变与反应热
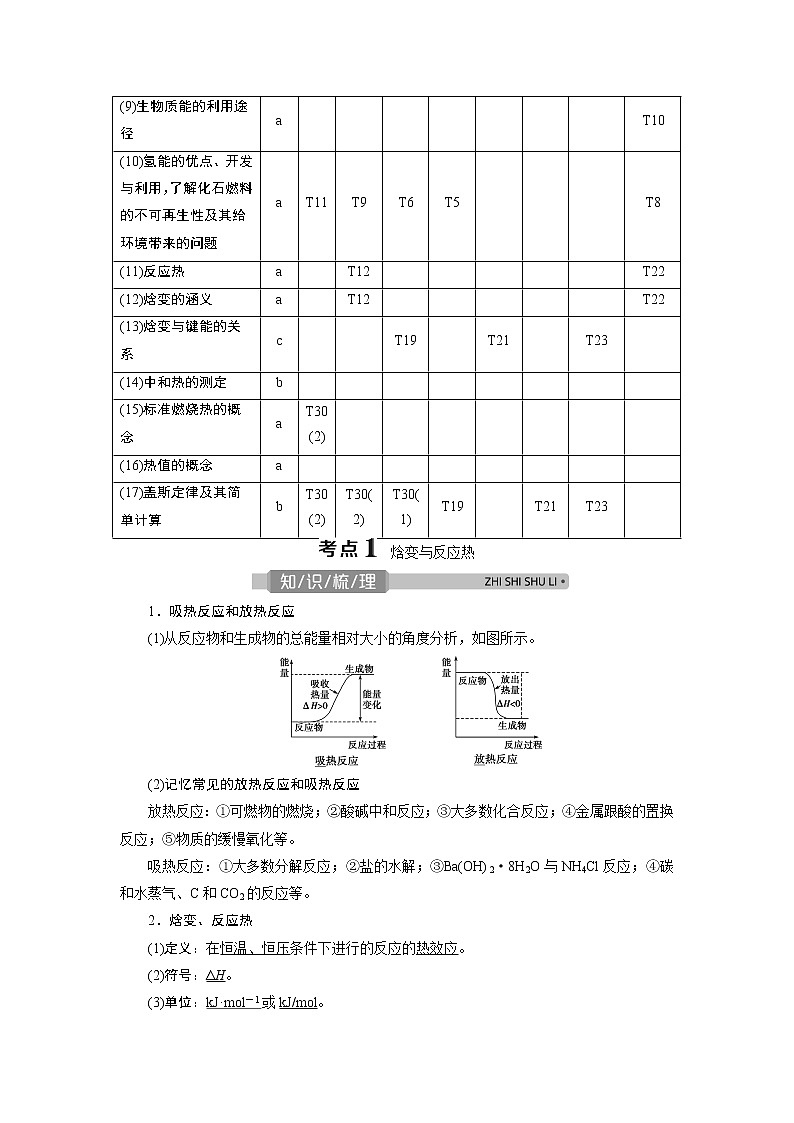
1.吸热反应和放热反应
(1)从反应物和生成物的总能量相对大小的角度分析,如图所示。
(2)记忆常见的放热反应和吸热反应
放热反应:①可燃物的燃烧;②酸碱中和反应;③大多数化合反应;④金属跟酸的置换反应;⑤物质的缓慢氧化等。
吸热反应:①大多数分解反应;②盐的水解;③Ba(OH)2·8H2O与NH4Cl反应;④碳和水蒸气、C和CO2的反应等。
2.焓变、反应热
(1)定义:在恒温、恒压条件下进行的反应的热效应。
(2)符号:ΔH。
(3)单位:kJ·mol-1或kJ/mol。
3.从反应热的量化参数——键能的角度分析
题组一化学反应中的能量变化
1.(2020·浙江1月选考,T22)在一定温度下,某反应达到了化学平衡,其反应过程对应的能量变化如图。下列说法正确的是( )
A.Ea为逆反应活化能,E′a为正反应活化能
B.该反应为放热反应,ΔH=E′a-Ea
C.所有活化分子的平均能量高于或等于所有分子的平均能量
D.温度升高,逆反应速率加快幅度大于正反应加快幅度,使平衡逆移
答案:D
2.(2020·浙江“七彩阳光”联盟期初联考)下列反应中生成物的总能量大于反应物总能量的非氧化还原反应是( )
A.铝热反应
B.碳酸钙分解
C.氢氧化钠和盐酸反应
D.焦炭在高温下与水蒸气反应
解析:选B。由题意可知,该反应为吸热反应,且为非氧化还原反应,故B项符合题意。
题组二键能与反应热
3.已知1 g氢气完全燃烧生成液态水时放出热量143 kJ,18 g 水蒸气变成液态水放出44 kJ的热量。其他相关数据如下表:
O===O
H—H
H—O
1 mol化学键断裂
时需要吸收的能量/kJ
496
x
463
则表中x为( )
A.920 B.557
C.436 D.188
解析:选C。根据题意,可得热化学方程式为2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1;而18 g水蒸气变成液态水时放出44 kJ热量,则2H2(g)+O2(g)===2H2O(g) ΔH=-484 kJ·mol-1,即-484 kJ=2x kJ+496 kJ-4×463 kJ,解得x=436。
4.(2017·浙江4月选考,T19)已知断裂1 mol H2(g)中的H—H键需要吸收436.4 kJ的能量,断裂1 mol O2(g)中的共价键需要吸收498 kJ的能量,生成H2O(g)中的1 mol H—O键能放出462.8 kJ的能量。下列说法正确的是( )
A.断裂1 mol H2O中的化学键需要吸收925.6 kJ的能量
B.2H2(g)+O2(g)===2H2O(g)
ΔH=-480.4 kJ·mol-1
C.2H2O(l)===2H2(g)+O2(g)
ΔH=471.6 kJ·mol-1
D.H2(g)+O2(g)===H2O(l)
ΔH=-240.2 kJ·mol-1
答案:B
5.反应N2(g)+O2(g)===2NO(g)的能量变化如图所示。已知:断开1 mol N2(g)中化学键需吸收946 kJ能量,断开1 mol O2(g)中化学键需吸收498 kJ能量。下列说法正确的是( )
A.N2(g)+O2(g)===2NO(g)ΔH=-180 kJ·mol-1
B.NO(g)===N2(g)+O2(g) ΔH=90 kJ·mol-1
C.断开1 mol NO(g)中化学键需吸收632 kJ能量
D.形成1 mol NO(g)中化学键可释放90 kJ能量
答案:C
熟记反应热ΔH的基本计算公式
ΔH=生成物的总能量-反应物的总能量。
ΔH=反应物的总键能之和-生成物的总键能之和。
热化学方程式
1.热化学方程式的概念
表示参加化学反应的物质的物质的量和反应热的关系的化学方程式。
2.热化学方程式的意义
表明了化学反应中的物质变化和能量变化,如2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1表示25 ℃、101 kPa时,2__mol氢气和1__mol氧气反应生成2__mol 液态水时放出 571.6__kJ的热量。
3.热化学方程式的书写
(1)注明反应条件
反应热与测定条件(温度、压强等)有关。绝大多数反应是在25 ℃、101 kPa下进行的,可不注明。
(2)注明物质状态
物质所处的状态不同,ΔH值不同。常用s、l、g、aq分别表示固体、液体、气体、溶液。
(3)注意符号单位
ΔH应包括符号[放热反应为“-”,吸热反应为“+”(可省略)]、数字和单位(kJ/mol)。
(4)注意热化学方程式的化学计量数
热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,可以是整数,也可以是分数,且化学计量数必须与ΔH相对应,如果化学计量数加倍,则ΔH也要加倍。
(5)与普通化学方程式的区别
一般不标注“↑”“↓”以及反应条件,如“点燃”“加热”等。
题组一热化学方程式的正误判断
1.(2020·嘉兴月考)已知1 mol CH4气体完全燃烧生成气态CO2和液态H2O,放出890.3 kJ热量,则表示该反应的热化学方程式正确的是( )
A.CH4(g)+2O2(g)===CO2(g)+2H2O(g)
ΔH=890.3 kJ·mol-1
B.CH4(g)+2O2(g)===CO2(g)+2H2O(l)
ΔH=-890.3 kJ·mol-1
C.CH4(g)+2O2(g)===CO2(g)+2H2O(l)
ΔH=890.3 kJ·mol-1
D.CH4(g)+2O2(g)===CO2(g)+2H2O(g)
ΔH=-890.3 kJ·mol-1
答案:B
2.(2020·杭州二中选考模拟)在25 ℃、101 kPa下,1 g甲醇[CH3OH(l)]燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是( )
A.CH3OH(l)+O2(g)===CO2(g)+2H2O(l)
ΔH =725.8 kJ·mol-1
B.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)
ΔH=-1 452 kJ·mol-1
C.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)
ΔH =-725.8 kJ·mol-1
D.2CH3OH+3O2===2CO2+4H2O
ΔH =-1 452 kJ·mol-1
解析:选B。因甲醇燃烧为放热反应,ΔH<0,故A项错误;热化学方程式中必须标明各物质的状态,故D项错误;1 mol甲醇的质量为32 g,由1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,可得1 mol甲醇燃烧生成CO2和液态水时放热22.68 kJ×32≈725.8 kJ。故只有B项正确。
判断热化学方程式正误可用的“五看”法
(1)看方程式是否配平;
(2)看各物质的聚集状态是否正确;
(3)看ΔH变化的“+”“-”是否正确(“+”号可省略);
(4)看反应热的单位是否为kJ·mol-1;
(5)看反应热的数值与化学计量数是否相对应。
题组二依据能量图像书写热化学方程式
3.(2016·浙江10月选考,T19)根据能量变化示意图,下列热化学方程式正确的是( )
A.N2(g)+3H2(g)===2NH3(g)
ΔH=-(b-a) kJ·mol-1
B.N2(g)+3H2(g)===2NH3(g)
ΔH=-(a-b) kJ·mol-1
C.2NH3(l)===N2(g)+3H2(g)
ΔH=2(a+b-c) kJ·mol-1
D.2NH3(l)===N2(g)+3H2(g)
ΔH=2(b+c-a) kJ·mol-1
答案:D
4.氧化亚铜是一种重要的工业原料。已知1 g C(s)燃烧生成一氧化碳放出9.2 kJ的热量,氧化亚铜与氧气反应的能量变化如图所示。下列有关判断正确的是( )
A.碳[C(s)]的标准燃烧热为-110.4 kJ·mol-1
B.氧化亚铜与氧气的反应为吸热反应
C.氧化亚铜与氧气反应的活化能为292 kJ·mol-1
D.足量炭粉与CuO反应生成Cu2O的热化学方程式为
C(s)+2CuO(s)===Cu2O(s)+CO(g) ΔH=35.6 kJ·mol-1
解析:选D。标准燃烧热指在101 kPa下,1 mol物质完全燃烧的反应热,而该题中C(s)燃烧的生成物为CO,故通过ΔH=-9.2 kJ·g-1×12 g·mol-1=-110.4 kJ·mol-1计算所得的结果不是碳[C(s)]的标准燃烧热,A项错误。由题给图像可知,反应物的总能量高于生成物的总能量,该反应放热,B项错误。由题给图像可知,氧化亚铜与氧气反应的活化能为348 kJ·mol-1,C项错误。根据题给信息可得热化学方程式:2C(s)+O2(g)===2CO(g) ΔH1=-220.8 kJ·mol-1①;根据题给图像可得热化学方程式:2Cu2O(s)+O2(g) ===4CuO(s) ΔH2=-292 kJ·mol-1②;足量炭粉与氧化铜反应的热化学方程式为C(s)+2CuO(s) ===Cu2O(s)+CO(g) ΔH③;根据盖斯定律,由×(①-②)可得③,则ΔH=(ΔH1-ΔH2)=35.6 kJ·mol-1,D项正确。
标准燃烧热、中和热和能源
1.标准燃烧热
(1)概念:在101 kPa下,1__mol物质完全燃烧生成稳定的氧化物时所放出的热量,叫作该物质的标准燃烧热。标准燃烧热的单位一般用kJ·mol-1表示。
标准燃烧热的限定词有恒压(101 kPa时)、可燃物的物质的量(1 mol)、完全燃烧、稳定的氧化物等,其中的“完全燃烧”指物质中下列元素完全转变成对应的氧化物:C→CO2(g),H→H2O(l),S→SO2(g)等。
(2)表示的意义:如C的标准燃烧热为393.5 kJ·mol-1,表示在101 kPa时,1 mol C完全燃烧放出393.5 kJ的热量。
(3)书写热化学方程式:标准燃烧热是以1 mol物质完全燃烧所放出的热量来定义的,因此在书写它的热化学方程式时,应以燃烧1 mol物质为标准来配平其余物质的化学计量数。例如:C8H18(l)+O2(g)===8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1,即C8H18的标准燃烧热为5 518 kJ·mol-1。
2.热值的概念
1__g物质完全燃烧所放出的热量叫作该物质的热值。
3.中和热测定
(1)概念:在稀溶液中,强酸跟强碱发生中和反应生成1__mol__液态H2O时的反应热叫中和热。
(2)注意几个限定词:①稀溶液;②产物是1 mol液态H2O;③用离子方程式可表示为OH-(aq)+H+(aq)===H2O(l) ΔH=-57.3 kJ·mol-1。
(3)中和热的测定
①测定原理
ΔH=
c=4.18 J·g-1·℃-1=4.18×10-3 kJ·g-1·℃-1;n为生成H2O的物质的量。
②装置如图(在横线上填出仪器的名称)
4.合理利用化石燃料,提高燃料燃烧效率的方法
(1)化石燃料主要包括煤、石油、天然气。
(2)可燃物燃烧的条件是与O2接触、温度达到其着火点。
(3)充分燃烧的必要条件是O2要充足,与O2的接触面积要大。
(4)不充分燃烧则产热少,浪费资源,污染环境。
(5)调整和优化能源结构,降低燃煤在能源结构中的比率,节约油气资源,加强科技投入,加快开发水电、核电和新能源等就显得尤为重要和迫切。
(6)最有希望的新能源是太阳能、风能、氢能和燃料电池等。这些新能源的特点是资源丰富,且有些可以再生,对环境没有污染或污染少。
题组一标准燃烧热
1.一些烷烃的标准燃烧热如下表:
化合物
标准燃烧热/
(kJ·mol-1)
化合物
标准燃烧热/
(kJ·mol-1)
甲烷
890.3
正丁烷
2 878.0
乙烷
1 560.8
异丁烷
2 869.6
丙烷
2 221.5
2甲基丁烷
3 531.3
下列表达正确的是( )
A.乙烷燃烧的热化学方程式为2C2H6(g)+7O2(g)===4CO2(g)+6H2O(g) ΔH=-1 560.8 kJ·mol-1
B.稳定性:正丁烷>异丁烷
C.正戊烷的标准燃烧热大于 3 531.3 kJ·mol-1
D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多
解析:选C。乙烷的标准燃烧热为1 560.8 kJ·mol-1,指1 mol C2H6(g)完全燃烧生成CO2(g)和H2O(l)放出 1 560.8 kJ的热量,乙烷燃烧的热化学方程式为C2H6(g)+O2(g)===2CO2(g)+3H2O(l) ΔH=-1 560.8 kJ·mol-1,A项错误;正丁烷和异丁烷互为同分异构体,1 mol正丁烷和异丁烷完全燃烧都生成4 mol CO2(g)和5 mol H2O(l),正丁烷的标准燃烧热>异丁烷的标准燃烧热,则正丁烷具有的能量>异丁烷具有的能量,根据能量越低越稳定可知,稳定性:正丁烷异丁烷的标准燃烧热可知,互为同分异构体的化合物支链多的标准燃烧热小,则正戊烷的标准燃烧热>2甲基丁烷的标准燃烧热,即正戊烷的标准燃烧热大于 3 531.3 kJ·mol-1,C项正确;随着碳原子数的增多,烷烃含碳质量分数逐渐增大,1 g CH4、C2H6、C3H8完全燃烧放出的热量依次为55.64 kJ( kJ≈55.64 kJ)、52.03 kJ( kJ≈52.03 kJ)、50.49 kJ( kJ≈50.49 kJ),可见相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越少,D项错误。
题组二中和热测定误差分析和数据处理
2.中和热是在稀溶液中,强酸、强碱发生中和反应生成1 mol 水时放出的热量,中和热为57.3 kJ/mol。下列热化学方程式中正确的是( )
A.HNO3(aq)+KOH(aq)===H2O(l)+KNO3(aq) ΔH>-57.3 kJ/mol
B.HNO3(aq)+NH3·H2O(aq)===H2O(l)+NH4NO3(aq) ΔH<-57.3 kJ/mol
C.CH3COOH(aq)+KOH(aq)===H2O(l)+CH3COOK(aq) ΔH<-57.3 kJ/mol
D.CH3COOH(aq)+NH3·H2O(aq)===H2O(l)+CH3COONH4(aq) ΔH>-57.3 kJ/mol
解析:选D。 A中HNO3为强酸,KOH为强碱,ΔH=-57.3 kJ/mol;B中NH3·H2O为弱碱,ΔH>-57.3 kJ/mol;C中CH3COOH为弱酸,ΔH>-57.3 kJ/mol;D中是弱酸与弱碱反应,ΔH>-57.3 kJ/mol。
3.利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。回答下列问题:
(1)使盐酸与NaOH溶液混合均匀的正确操作是______。
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(2)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为____________。
(3)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
实验
序号
起始温度t1/℃
终止温度t2/℃
盐酸
氢氧化钠溶液
混合溶液
1
20.0
20.1
23.2
2
20.2
20.4
23.4
3
20.5
20.6
23.6
依据该学生的实验数据计算,该实验测得的中和热ΔH=________________(结果保留一位小数)。
解析:(1)使盐酸与NaOH溶液混合均匀的正确操作:用套在温度计上的环形玻璃搅拌棒上下轻轻地搅动。
(2)稀氢氧化钠溶液和稀氢氧化钙溶液中溶质都完全电离,它们的中和热相同,稀氨水中的溶质是弱电解质,它与盐酸的反应中一水合氨的电离要吸收热量,故反应热的数值要小一些(注意中和热与ΔH的关系)。
(3)取三次实验的平均值代入公式计算即可。
答案:(1)D (2)ΔH1=ΔH2




