

所属成套资源:2021版浙江高考选考化学一轮复习教师用书精品教案
2021版浙江高考选考化学一轮复习教师用书:专题72 第二单元 化学反应的方向和限度
展开
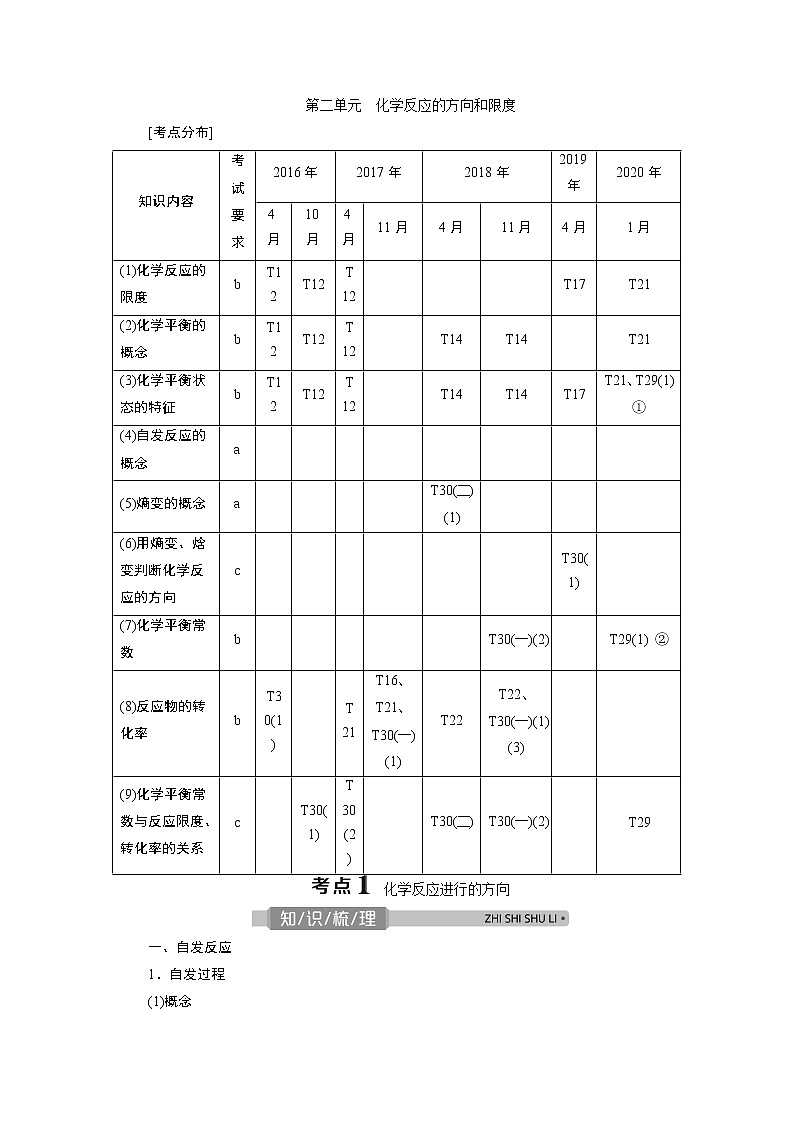
第二单元 化学反应的方向和限度
[考点分布]
知识内容
考试
要求
2016年
2017年
2018年
2019年
2020年
4月
10月
4月
11月
4月
11月
4月
1月
(1)化学反应的限度
b
T12
T12
T12
T17
T21
(2)化学平衡的概念
b
T12
T12
T12
T14
T14
T21
(3)化学平衡状态的特征
b
T12
T12
T12
T14
T14
T17
T21、T29(1) ①
(4)自发反应的概念
a
(5)熵变的概念
a
T30(二)(1)
(6)用熵变、焓变判断化学反应的方向
c
T30(1)
(7)化学平衡常数
b
T30(一)(2)
T29(1) ②
(8)反应物的转化率
b
T30(1)
T21
T16、T21、
T30(一)(1)
T22
T22、T30(一)(1)(3)
(9)化学平衡常数与反应限度、转化率的关系
c
T30(1)
T30(2)
T30(二)
T30(一)(2)
T29
化学反应进行的方向
一、自发反应
1.自发过程
(1)概念
在一定条件下,不需要借助外力作用就能自动进行的过程。
(2)特点
①体系趋向于从高能状态转变为低能状态(体系对外部做功或释放热量)。
②在密闭条件下,体系有从有序转变为无序的倾向性(无序体系更加稳定)。
2.自发反应
在一定条件下,无需外界帮助就能自发进行的反应称为自发反应。
二、熵、熵变
1.熵的概念
熵是衡量一个体系混乱度的物理量。用符号S表示。
同一条件下,不同物质有不同的熵值,同一物质在不同状态下熵值也不同,一般规律是S(g)>S(l)>S(s)。
2.熵变的概念
熵变是反应前后体系熵的变化,用ΔS表示,化学反应的ΔS越大,越有利于反应自发进行。
三、用熵变、焓变判断化学反应的方向
1.熵变与反应方向
研究表明,对于化学反应而言,决定化学反应能否自发进行的一个因素是体系的混乱度。大多数自发反应有趋向于体系混乱度增大的倾向。
2.焓变与反应方向
研究表明,对于化学反应而言,绝大多数放热反应都能自发进行,且反应放出的热量越多,体系能量降低得也越多,反应越完全。可见,反应的焓变是制约化学反应能否自发进行的另一个因素。
3.综合判断反应方向的依据
(1)ΔH-TΔS0,反应不能自发进行。
题组化学反应方向的判断
1.实验证明,多数能自发进行的反应都是放热反应。对此说法的理解正确的是( )
A.所有的放热反应都是自发进行的
B.所有的自发反应都是放热的
C.焓变是影响反应是否具有自发性的一种重要因素
D.焓变是决定反应是否具有自发性的唯一判据
答案:C
2.(2020·金华高二质检)下列过程属于熵增加的是( )
A.一定条件下,水由气态变成液态
B.高温高压条件下使石墨转变成金刚石
C.4NO2(g)+O2(g)===2N2O5 (g)
D.固态碘升华
答案:D
3.(2020·宁波月考)下列说法错误的是( )
A.2NO(g)+2CO(g)===N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH>0
B.反应NH3(g)+HCl(g)===NH4Cl(s)在室温下可自发进行,则该反应的ΔH0,ΔS>0
D.常温下,反应C(s)+CO2(g)===2CO(g)不能自发进行,则该反应的ΔH>0
解析:选A。A项,该反应是熵减的反应,常温下能自发进行说明ΔH0;D项,该反应ΔS>0,常温下不能自发进行,则有ΔH-TΔS>0,故ΔH>0。
4.[2019·浙江4月选考,T30(1)改编]水是“生命之基质”,是“永远值得探究的物质”。关于反应H2(g)+O2(g)===H2O(l),下列说法不正确的是( )
A.焓变ΔH<0,熵变ΔS<0
B.可以把反应设计成原电池,实现能量的转化
C.一定条件下,若观察不到水的生成,说明该条件下反应不能自发进行
D.选用合适的催化剂,有可能使反应在常温常压下以较快的速率进行
解析:选C。该反应显然为放热反应,所以焓变ΔH<0,该反应气体分子数减小,所以熵变ΔS<0,A项正确;该反应属于自发的氧化还原反应,所以可以设计成原电池,实现能量的转化,B项正确;反应能自发进行的判断依据是ΔH-TΔS0)。下列说法不正确的是( )
A.0.1 mol X和0.2 mol Y充分反应生成Z的物质的量一定小于0.3 mol
B.达到化学平衡状态时,X、Y、Z的浓度不再发生变化
C.达到化学平衡状态时,反应放出的总热量可达a kJ
D.升高反应温度,逆反应速率增大、正反应速率减小
解析:选D。升高反应温度,正、逆反应速率均增大。
2.(2018·浙江11月选考,T14)已知X(g)+Y(g)2W(g)+M(g) ΔH=a kJ·mol-1(a>0)。一定温度下,在体积恒定的密闭容器中,加入1 mol X(g)与1 mol Y(g)。下列说法正确的是( )
A.充分反应后,放出热量为a kJ
B.当反应达到平衡状态时,X与W的物质的量浓度之比一定为1∶2
C.当X的物质的量分数不再改变,表明该反应已达到平衡
D.若增大Y的浓度,正反应速率增大,逆反应速率减小
解析:选C。A项,反应X(g)+Y(g)2W(g)+M(g)属于可逆反应,且为吸热反应,则1 mol X(g) 与1 mol Y (g)充分反应后不可能完全转化,吸收的热量小于a kJ,故A错误;B项,当反应达到平衡状态时,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变,但X与W的物质的量浓度之比不一定为1∶2,故B错误;C项,当X的物质的量分数不再改变,说明正反应速率和逆反应速率相等,表明该反应已达到平衡,故C正确;D项,若增大Y的浓度,正、逆反应速率均增大,故D错误。
3.一定温度下,在体积恒定的密闭容器中发生反应:N2(g)+3H2(g)2NH3(g)。反应过程中的部分数据如下表所示:
c/(mol·L-1)
t/min
c(N2)
c(H2)
c(NH3)
0
1.0
3.0
0
3
0.25
6
2.4
9
0.8
反应刚好达到平衡状态时( )
A.t=6 min
B.c(NH3)=0.4 mol·L-1
C.容器内的气体分子数n(N2)∶n(H2)∶n(NH3)=1∶3∶2
D.H2的正反应速率等于N2的逆反应速率
解析:选B。根据反应方程式,可将表格补充如下:
c/(mol·L-1)
t/min
c(N2)
c(H2)
c(NH3)
0
1.0
3.0
0
3
0.875
2.625
0.25
6
0.8
2.4
0.4
9
0.8
2.4
0.4
由表格可知,6 min时已达平衡,但不能确定是否6 min刚好平衡,A项错误;由表格数据可知,B项正确;达到平衡时,n(N2)∶n(H2)∶n(NH3)=c(N2)∶c(H2)∶c(NH3)=0.8 mol·L-1∶2.4 mol·L-1∶0.4 mol·L-1=2∶6∶1,C项错误;达到平衡时,H2的正反应速率等于N2的逆反应速率的3倍,D项错误。
极端假设法确定各物质浓度范围
可逆反应各物质浓度范围可根据极端假设法判断,假设反应正向或逆向进行到底,求出各物质浓度的最大值和最小值,从而确定它们的浓度范围。
例如:可逆反应X2(g)+Y2(g)2Z(g),各物质的起始浓度分别为c(X2)=0.1 mol·L-1,c(Y2)=0.3 mol·L-1,c(Z)=0.2 mol·L-1。
假设反应正向进行到底:X2(g)+Y2(g)2Z(g)
起始浓度(mol·L-1) 0.1 0.3 0.2
改变浓度(mol·L-1) 0.1 0.1 0.2
终态浓度(mol·L-1) 0 0.2 0.4
假设反应逆向进行到底:X2(g)+Y2(g)2Z(g)
起始浓度(mol·L-1) 0.1 0.3 0.2
改变浓度(mol·L-1) 0.1 0.1 0.2
终态浓度(mol·L-1) 0.2 0.4 0
平衡体系中各物质的浓度范围为X2∈(0,0.2),Y2∈(0.2,0.4),Z∈(0,0.4)。
题组二化学平衡状态的判断
4.(2018·浙江4月选考,T14)反应N2(g)+3H2(g)2NH3(g) ΔHH2O>CO2
D.反应②中,升高温度,K值增大
解析:选C。NO(g)N2(g)+O2(g)的平衡常数为K===[]-=(1×10-30) -=1×1015,A项错误;常温下H2和O2很难反应生成 H2O,B项错误;常温下,NO、H2O、CO2三种物质分解放出O2的K分别为1×1030、5×10-82、4×10-92,倾向顺序为NO>H2O>CO2,C项正确;反应②为放热反应,升高温度,平衡向逆反应方向移动,K值减小,D项错误。
3.碘单质难溶于水却易溶于KI溶液。碘水中加入KI溶液发生反应:I2(aq)+I-(aq)I(aq),该反应的平衡常数与温度的关系如图,下列说法不正确的是( )
A.上述正反应为放热反应
B.上述体系中加入苯,平衡不移动
C.可运用该反应原理除去硫粉中少量的碘单质
D.实验室配制碘水时,为增大碘单质的溶解度可加入适量KI溶液
解析:选B。由图中可看出,随着温度的升高,平衡常数减小,故升高温度,平衡逆向移动,正反应为放热反应,A项正确;加入苯后能将溶液的碘单质萃取,降低了溶液中c(I2),平衡逆向移动,B项错误;硫粉中的碘单质在加入KI后,碘单质生成KI3而除去,C项正确;配制碘水时,加入KI溶液,使得平衡正向移动,增大碘单质的溶解度,D项正确。
(1)关于H2O的浓度问题
①稀水溶液中进行的反应,虽然H2O参与反应,但是H2O只作为溶剂,不能代入平衡常数表达式。
如NH4Cl+H2ONH3·H2O+HCl的平衡常数表达式为K=。
②H2O的状态不是液态而是气态时,则需要代入平衡常数表达式。
(2)代入平衡常数表达式的是平衡浓度,而不是任意时刻的浓度,更不能将物质的量代入。
(3)同一化学反应,可以用不同的化学方程式表示,每个化学方程式都有自己的平衡常数表达式及相应的平衡常数。因此,要注意使用与化学方程式相对应的平衡常数。
4.已知反应①CO(g)+CuO(s)CO2(g)+Cu(s)和反应②H2(g)+CuO(s)Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A.反应①的平衡常数K1=
B.反应③的平衡常数K=
C.对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值
D.对于反应③,恒温恒容下,增大压强,平衡常数增大
解析:选B。在书写平衡常数表达式时,纯固体不能表示在平衡常数表达式中,A错误;由于反应③=反应①-反应②,因此平衡常数K=,B正确;反应③中,温度升高,H2浓度减小,则平衡左移,即逆反应为吸热反应,正反应为放热反应,因此ΔH0,ΔS0,即任何温度下反应都不能自发进行;对于B项,ΔH





