

所属成套资源:2021版新高考选考化学一轮复习精品教案
2021版江苏新高考选考化学(苏教版)一轮复习教师用书:专题32第二单元 金属材料
展开
第二单元 金属材料
学习任务1 金属材料与金属矿物的开发利用
一、合金
1.概念:两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。
2.性能:合金具有不同于各成分金属的物理化学性能或机械性能。
(1)熔点:一般比它的各成分金属都低;
(2)硬度和强度:一般比它的各成分金属都大。
二、常见金属材料
1.重要的黑色金属材料——钢
钢是用量最大、用途最广的合金。
钢
2.几种有色金属材料
三、金属矿物的开发利用
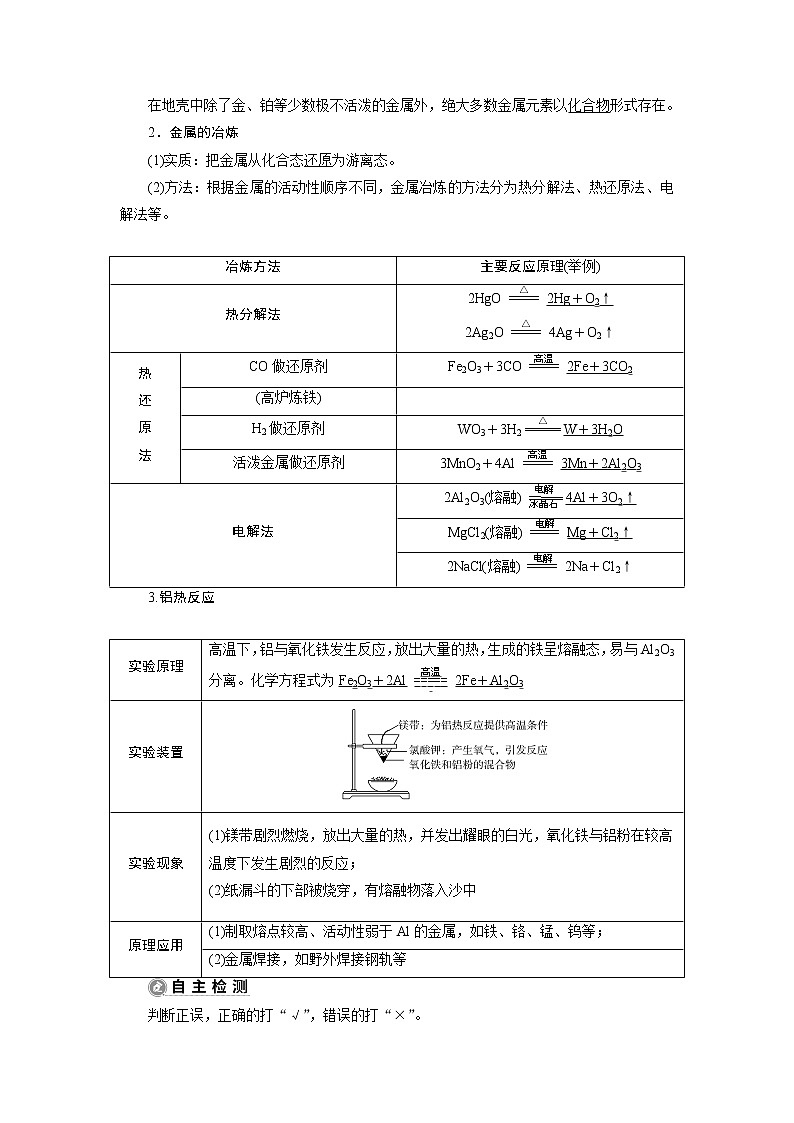
1.金属在自然界中的存在
在地壳中除了金、铂等少数极不活泼的金属外,绝大多数金属元素以化合物形式存在。
2.金属的冶炼
(1)实质:把金属从化合态还原为游离态。
(2)方法:根据金属的活动性顺序不同,金属冶炼的方法分为热分解法、热还原法、电解法等。
冶炼方法
主要反应原理(举例)
热分解法
2HgO2Hg+O2↑
2Ag2O4Ag+O2↑
热
还
原
法
CO做还原剂
Fe2O3+3CO2Fe+3CO2
(高炉炼铁)
H2做还原剂
WO3+3H2W+3H2O
活泼金属做还原剂
3MnO2+4Al3Mn+2Al2O3
电解法
2Al2O3(熔融)4Al+3O2↑
MgCl2(熔融)Mg+Cl2↑
2NaCl(熔融)2Na+Cl2↑
3.铝热反应
实验原理
高温下,铝与氧化铁发生反应,放出大量的热,生成的铁呈熔融态,易与Al2O3分离。化学方程式为Fe2O3+2Al2Fe+Al2O3
实验装置
实验现象
(1)镁带剧烈燃烧,放出大量的热,并发出耀眼的白光,氧化铁与铝粉在较高温度下发生剧烈的反应;
(2)纸漏斗的下部被烧穿,有熔融物落入沙中
原理应用
(1)制取熔点较高、活动性弱于Al的金属,如铁、铬、锰、钨等;
(2)金属焊接,如野外焊接钢轨等
判断正误,正确的打“√”,错误的打“×”。
(1)(2019·高考全国卷Ⅲ)铝合金大量用于高铁建设。( )
(2)金属元素的单质在常温下均为固体。( )
(3)金属元素在不同化合物中化合价均相同。( )
(4)合金材料中不可能含有非金属元素。( )
(5)港珠澳大桥的建设使用了大量钢材,钢材是合金。( )
(6)铁是人类在生产、生活中最早使用的金属。( )
(7)合金中的金属元素都是以化合态形式存在。( )
(8)合金的硬度一般大于其成分金属,而熔点一般低于其成分金属。( )
(9)金属氧化物与铝粉的混合物都是铝热剂。( )
(10)用金属钠在高温下还原TiCl4可制取金属钛。( )
(11)人类历史上使用铝的时间比铁晚,原因是铝的冶炼成本高。( )
(12)电解氯化镁溶液制取金属镁。( )
答案:(1)√ (2)× (3)× (4)× (5)√ (6)× (7)× (8)√ (9)× (10)√ (11)× (12)×
提升一 金属材料与合金
1.下列生活用品中主要由黑色金属材料制造的是( )
A.塑钢门窗 B.不锈钢刀
C.纯铜导线 D.18K金首饰
解析:选B。冶金工业上习惯把铁、铬、锰以及它们的合金(主要指合金钢及钢铁)叫作黑色金属材料。塑钢门窗是以聚氯乙烯树脂为主要原料制造的,A项错误;不锈钢刀为铁的合金,主要由黑色金属材料制造而成,B项正确;纯铜导线为铜单质,铜属于有色金属,C项错误;18K 金首饰为金的合金,属于有色金属材料,D项错误。
2.C919大型飞机的制造采用了大量新材料铝锂合金。下列关于铝锂合金的说法不正确的是( )
A.铝锂合金是铝与锂形成的混合物
B.铝锂合金的硬度比锂大
C.铝锂合金的熔点比铝低
D.铝锂合金耐酸碱腐蚀
解析:选D。铝锂合金中的铝既能与酸反应,又能与碱反应,锂能与酸反应,故铝锂合金不耐酸碱腐蚀。
提升二 金属的冶炼
3.(2020·九江质检)下列说法正确的是( )
A.工业上通过电解氯化钠溶液制备金属钠和氯气
B.钢铁厂用热还原法冶炼铁
C.工业上电解熔融状态的Al2O3制备Al不涉及氧化还原反应
D.MgCl2(aq)Mg(OH)2MgOMg
解析:选B。电解NaCl溶液生成NaOH、H2和Cl2,得不到单质钠,A错误;电解熔融Al2O3发生的是氧化还原反应,C错误;工业上冶炼镁是电解熔融MgCl2而不是MgO,D错误。
4.金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的应用。完成下列填空:
(1)镓(Ga)与铝同主族。写出镓的氯化物与氨水反应的化学方程式:________________________________________________________________________。
(2)用铝和金属氧化物反应制备金属单质是工业上较常用的方法。例如:
2Al+4BaO3Ba↑+BaO·Al2O3
常温下Al的金属性比Ba的金属性________(填“强”或“弱”)。利用上述方法可制取Ba的主要原因是____________________________________________________________。
a.高温时Al的活泼性大于Ba
b.高温有利于BaO分解
c.高温时BaO·Al2O3比Al2O3稳定
d.Ba的沸点比Al的低
解析:(1)由AlCl3与NH3·H2O的反应可推出化学方程式。(2)依据元素周期律可知,Al的金属性弱于Mg,Mg的金属性弱于Ba,所以Al的金属性弱于Ba。应从化学平衡移动的观点分析此反应发生的原因。
答案:(1)GaCl3+3NH3·H2O===Ga(OH)3↓+3NH4Cl
(2)弱 d
有些很活泼的金属也可以用还原法来冶炼,如Na+KClK↑+NaCl、2RbCl+MgMgCl2+2Rb↑等,主要运用了化学平衡移动原理,利用K、Rb沸点低,汽化离开反应体系,使化学反应得以向正反应方向进行。
提升三 铝热反应及其应用
5.(教材改编题)铝热反应的本质是利用铝的还原性,将难熔金属从其氧化物中置换出来,关于铝热反应回答下列问题:
(1)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有________。
A.KCl B.KClO3
C.MnO2 D.Mg
(2)用等物质的量的MgO和Fe2O3组成的混合物在一定条件下与Al粉进行铝热反应。
①引发铝热反应的操作是____________________________________________________
________________________________________________________________________。
②产物中单质是________(写名称)。
(3)取少量(1)中铝热反应所得的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,________(填“能”或“不能”)说明固体混合物中无Fe2O3,理由是
________________________________________________________________________
________________________________________________________________________(用离子方程式说明)。
解析:(1)做铝热反应的实验时,需要KClO3做助燃剂,且用镁条引燃。(2)①在混合物上加少量KClO3固体并插上Mg条,点燃Mg条后放出热量,使KClO3固体分解放出O2,进一步加剧Mg的燃烧,可在短时间内使混合物温度迅速升高,引发反应。②MgO不能与铝发生铝热反应,所以产物中单质为Fe。(3)反应后固体混合物中若有Fe2O3,因发生反应:Fe2O3+6H+===2Fe3++3H2O、Fe+2Fe3+===3Fe2+,Fe3+转化为Fe2+,加KSCN溶液不会变红。
答案:(1)BD
(2)①加少量KClO3,插上镁条并将其点燃 ②铁
(3)不能 Fe2O3+6H+===2Fe3++3H2O、Fe+2Fe3+===3Fe2+
学习任务2 铝的性质与应用
一、铝的结构和存在形式
铝位于元素周期表第3周期ⅢA族,原子结构示意图为。铝元素在地壳中含量丰富,仅次于硅。自然界中的铝全部以化合态存在。
二、铝的物理性质及用途
物理
性质
状态
色泽
密度
熔点
沸点
硬度
导电、导热性
延展性
固态
银白色
2.7 g·cm-3
660.4℃
2 467℃
较软
很好
良好
用途
纯铝用作导线,铝合金用于制备汽车、飞机、生活用品等
三、铝的化学性质
④2Al+2OH-+2H2O===2AlO+3H2↑(用离子方程式表示);
⑤2Al+Fe2O3Al2O3+2Fe(铝热反应)。
四、从铝土矿中提取铝
图中步骤①~④的反应原理:
①Al2O3+2NaOH===2NaAlO2+H2O(用化学方程式表示);
②NaAlO2+CO2+2H2O===Al(OH)3↓+NaHCO3;
③2Al(OH)3Al2O3+3H2O;
④2Al2O34Al+3O2↑。
1.(教材改编题)日常生活中有一些铝制炊具,它质轻且坚固耐用,其中的原因是( )
A.铝很不活泼,不易与其他物质反应
B.铝虽然很活泼,但是在高温下才能反应
C.铝制品表面有一层致密的氧化物薄膜,起保护作用
D.铝制品表面镀有一层铜,可以保护铝
解析:选C。铝尽管很活泼,但由于表面能形成致密的氧化物薄膜,故可用于制作铝制炊具。
2.判断正误,正确的打“√”,错误的打“×”。
(1)铝与Fe2O3发生铝热反应后固体物质增重。( )
(2)足量铝分别与含1 mol HCl、1 mol NaOH的溶液反应,产生相同量的氢气。( )
(3)工业上用电解熔融Al2O3的方法冶炼铝。( )
解析:(1)固体质量不变;(2)铝与HCl、NaOH分别发生反应:2Al+6HCl===2AlCl3+3H2↑、2Al+2NaOH+2H2O===2NaAlO2+3H2↑,所以产生氢气的物质的量之比为1∶3。
答案:(1)× (2)× (3)√
(1)Mg、Al在常温下均易在其表面形成致密的氧化膜。
(2)常温下,能用铝制容器盛放浓硫酸、浓硝酸的原因是二者能使铝发生“钝化”,而不是铝与浓硫酸、浓硝酸不反应。
(3)铝与稀硝酸反应时生成的气体是NO而不是H2。
(4)用铝箔包裹的钠与H2O反应时既考虑Na与H2O的反应,又考虑Al与NaOH溶液的反应。
(5)铝热剂(发生铝热反应)
铝热剂是铝与金属氧化物的混合物,铝热反应本质上是金属之间的置换反应,所以要遵循金属活动性顺序。例如:CuO与Al能发生铝热反应,而Al与MgO的混合物不能发生铝热反应。
提升一 铝的性质与应用
1.下列关于铝的叙述中正确的是( )
A.铝还原性强且亲氧性强,所以可通过铝热反应冶炼高熔点金属
B.铝在空气中极易锈蚀,所以铝制品的使用时间很短
C.铝能耐稀硫酸腐蚀,所以运送稀硫酸可用铝制槽车
D.铝的导电性比铜、银更强,所以常用以制造电线、电缆
解析:选A。铝在空气中形成致密的氧化膜,保护内层铝不被氧化,B错;铝能被稀硫酸腐蚀,C错;铝的导电性不如铜、银,D错。
2.某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并放出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知:Al、Al2O3、Fe、Fe2O3的熔、沸点数据如下:
物质
Al
Al2O3
Fe
Fe2O3
熔点/℃
660
2 054
1 535
1 462
沸点/℃
2 467
2 980
2 750
—
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理:________(填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是__________,反应的离子方程式为_________________________________________。
(3)实验室溶解该熔融物,下列试剂中最好的是________(填序号)。
A.浓硫酸 B.稀硫酸
C.稀硝酸 D.氢氧化钠溶液
解析:(1)这种解释是合理的,它体现了铝热反应的特点之一——放热较多,并且结合了表格中提供的熔点数据。
(2)若证明所得块状熔融物中含有金属铝,只要加入NaOH溶液即可,因为金属铝与NaOH溶液反应放出氢气,而铁不与NaOH溶液反应,相应的离子方程式为2Al+2OH-+2H2O===2AlO+3H2↑。
(3)铁铝熔融物在一定条件下能与浓硫酸或稀硝酸反应,但会产生有毒气体,而且消耗酸的量多;熔融物中铁不能与氢氧化钠溶液反应。铁和铝均与稀硫酸反应且产物无污染。
答案:(1)合理 (2)NaOH溶液 2Al+2OH-+2H2O===2AlO+3H2↑ (3)B
提升二 铝与酸、碱反应的定量关系
3.足量下列物质与相同质量的铝反应,放出氢气且消耗溶质物质的量最少的是( )
A.氢氧化钠溶液 B.稀硫酸
C.盐酸 D.稀硝酸
解析:选A。NaOH溶液、稀硫酸、盐酸与金属铝反应时,存在关系:2Al~2NaOH,2Al~3H2SO4,2Al~6HCl,因此等物质的量的Al与上述物质反应时,消耗NaOH的物质的量最少。Al与稀硝酸反应,生成硝酸铝、NO和H2O,得不到H2。
4.根据铝的特殊性质回答下列问题:
(1)等质量的两份铝分别与足量的盐酸、氢氧化钠溶液反应,所得H2的体积之比是________。
(2)足量的两份铝分别投入等体积、一定物质的量浓度的HCl、NaOH溶液中,二者产生的H2相等,则HCl和NaOH的物质的量浓度之比是________。
(3)甲、乙两烧杯中各盛有100 mL 3 mol·L-1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲)∶V(乙)=1∶2,则加入铝粉的质量为________。
A.5.4 g B.3.6 g
C.2.7 g D.1.8 g
解析:(1)根据化学方程式:2Al+6HCl===2AlCl3+3H2↑、2Al+2NaOH+2H2O===2NaAlO2+3H2↑得Al与H2的关系式均为2Al~3H2,故只要参加反应的Al的量相等,所得H2的量必相等。
(2)因为铝足量且产生的H2相等,根据关系式n(HCl)∶n(NaOH)=3∶1,又因为两溶液体积相等,故物质的量浓度之比c(HCl)∶c(NaOH)=n(HCl)∶n(NaOH)=3∶1。
(3)其反应原理分别为2Al+6HCl===2AlCl3+3H2↑,2Al+2NaOH+2H2O===2NaAlO2+3H2↑。可见当参加反应的HCl和NaOH的物质的量一样多时,产生H2的体积比是1∶3,而题设条件体积比为1∶2,说明此题投入的铝粉对盐酸来说是过量的,而对于NaOH来说是不足的。
2Al+6HCl===2AlCl3+3H2↑
6 mol 3 mol
0.3 mol 0.15 mol
Al与HCl反应生成的H2为0.15 mol,
则Al与NaOH反应生成的H2为0.15 mol×2=0.3 mol。
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
2×27 g 3 mol
5.4 g 0.3 mol
即投入的铝粉为5.4 g。
答案:(1)1∶1 (2)3∶1 (3)A
铝与酸、碱反应的定量关系
铝分别与盐酸、氢氧化钠溶液反应的原理:2Al+6HCl===2AlCl3+3H2↑,2Al+2NaOH+2H2O===2NaAlO2+3H2↑。
从化学方程式可以看出Al与酸、碱反应时生成H2的实质都是AlAl3+,所以无论与酸还是与碱反应,Al与H2的关系都是2Al~3H2。
若遇到铝与一定量的酸和碱反应的问题时可参考以下思路解决。
(1)等量的铝分别与足量盐酸和足量氢氧化钠溶液反应,产生H2的体积比为=。
(2)足量铝分别与等物质的量的盐酸和氢氧化钠溶液反应,产生H2的体积比为=。
(3)一定量的铝分别与一定量的盐酸和氢氧化钠溶液反应,若产生H2的体积比为






