

还剩20页未读,
继续阅读
所属成套资源:2019高考苏教专用化学一轮精选教师用书()
成套系列资料,整套一键下载
2019版高考化学一轮精选教师用书苏教专用:专题32第二单元 铁、铜的获取及应用
展开
第二单元 铁、铜的获取及应用
铁及其重要化合物的性质
[知识梳理]
一、单质铁
1.物理性质
铁具有金属的共性,具有能被磁体吸引的特性。
2.化学性质
(1)与非金属单质的反应
(2)与水蒸气的反应
3Fe+4H2O(g)Fe3O4+4H2
(3)与酸、盐的反应
钝化
二、铁的冶炼
1.铁元素的存在
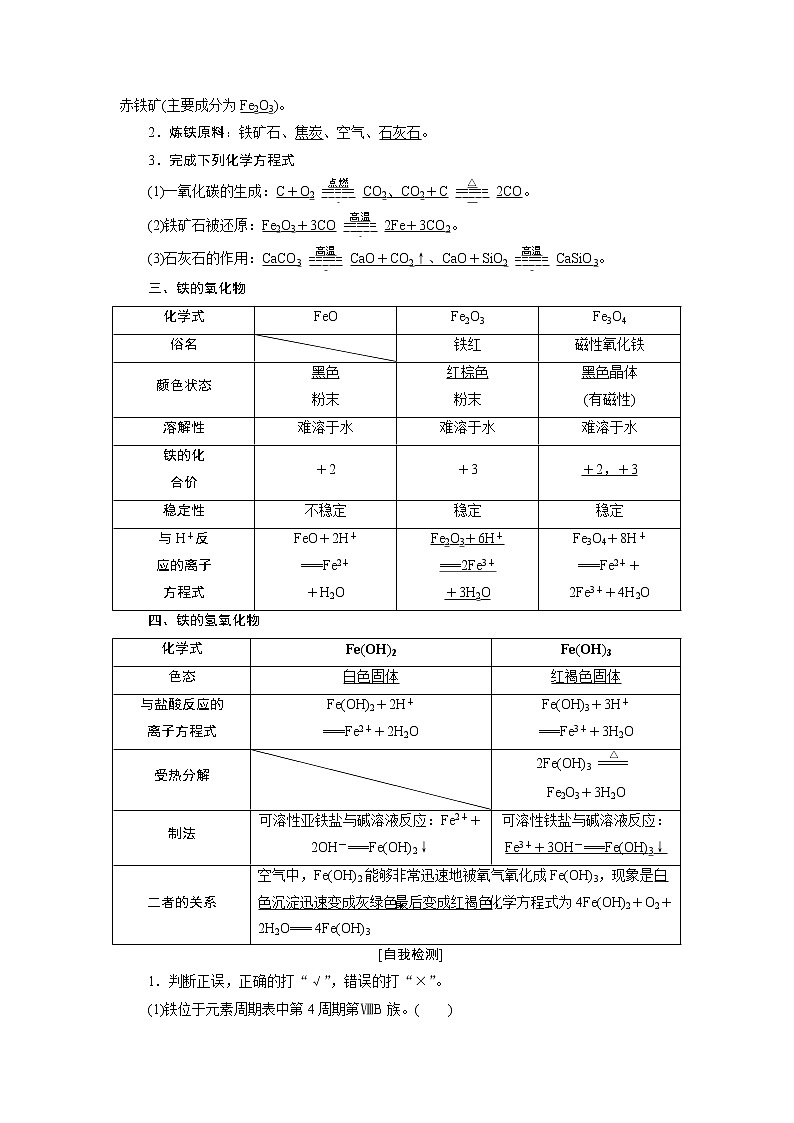
铁元素在自然界主要以化合态的形式存在,常见的铁矿有磁铁矿(主要成分为Fe3O4)、赤铁矿(主要成分为Fe2O3)。
2.炼铁原料:铁矿石、焦炭、空气、石灰石。
3.完成下列化学方程式
(1)一氧化碳的生成:C+O2CO2、CO2+C2CO。
(2)铁矿石被还原:Fe2O3+3CO2Fe+3CO2。
(3)石灰石的作用:CaCO3CaO+CO2↑、CaO+SiO2CaSiO3。
三、铁的氧化物
化学式
FeO
Fe2O3
Fe3O4
俗名
铁红
磁性氧化铁
颜色状态
黑色
粉末
红棕色
粉末
黑色晶体
(有磁性)
溶解性
难溶于水
难溶于水
难溶于水
铁的化
合价
+2
+3
+2,+3
稳定性
不稳定
稳定
稳定
与H+反
应的离子
方程式
FeO+2H+
===Fe2+
+H2O
Fe2O3+6H+
===2Fe3+
+3H2O
Fe3O4+8H+
===Fe2++
2Fe3++4H2O
四、铁的氢氧化物
化学式
Fe(OH)2
Fe(OH)3
色态
白色固体
红褐色固体
与盐酸反应的
离子方程式
Fe(OH)2+2H+
===Fe2++2H2O
Fe(OH)3+3H+
===Fe3++3H2O
受热分解
2Fe(OH)3
Fe2O3+3H2O
制法
可溶性亚铁盐与碱溶液反应:Fe2++2OH-===Fe(OH)2↓
可溶性铁盐与碱溶液反应:Fe3++3OH-===Fe(OH)3↓
二者的关系
空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,现象是白色沉淀迅速变成灰绿色,最后变成红褐色,化学方程式为4Fe(OH)2+O2+2H2O=== 4Fe(OH)3
[自我检测]
1.判断正误,正确的打“√”,错误的打“×”。
(1)铁位于元素周期表中第4周期第ⅧB族。( )
(2)用铁制容器可以运输浓硝酸和浓硫酸。( )
(3)将一定量的铁、铜的混合物加入到100 mL 0.1 mol·L-1的FeCl3溶液中,充分反应后,溶液中有固体剩余,则剩余的固体中一定含有铜,可能含有铁。( )
(4)Fe分别与氯气和盐酸反应所得氯化物相同。( )
(5)氢氧化铁与HI溶液仅发生中和反应。( )
答案:(1)× (2)√ (3)√ (4)× (5)×
2.将下列物质的颜色和用途或性质用短线连接起来。
A.具有较强的还原性
(1)Fe2O3 a.红褐色 B.易被氧化成灰绿色,
(2)Fe(OH)2 b.红棕色 最终变成红褐色
(3)Fe(OH)3 c.白色 C.制作红色油漆、涂料
(4)Fe2+ d.棕黄色 D.受热分解成红棕色粉末
(5)Fe3+ e.浅绿色 E.具有较强的氧化性
答案:(1)-b-C (2)-c-B (3)-a-D (4)-e-A
(5)-d-E
Fe3O4中2个Fe为+3价,1个Fe为+2价,可表示为FeO·Fe2O3,平均价态为+价。在发生氧化还原反应时,对应价态的铁参与相关反应,如Fe3O4与HNO3反应时只有+2价铁被氧化。
(2015·高考全国卷Ⅰ改编,10,6分)下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项
实验
现象
结论
A
将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液
有气体生成,溶液呈血红色
稀硝酸将Fe氧化为Fe3+
B
将铜粉加入1.0 mol·L-1 Fe2(SO4)3溶液中
溶液变蓝、有黑色固体出现
金属铁比铜活泼
C
向FeCl3、CuCl2的混合溶液中加入铁粉,充分反应
溶液中有固体存在
溶液中一定含有Cu2+
D
相同质量、相同表面积的纯铁和生铁分别与相同浓度的盐酸反应
生铁的反应速率比纯铁快
原电池反应能加快化学反应速率
[解析] A.稀硝酸与过量铁粉发生的反应分两步进行,先发生反应:Fe+4HNO3(稀)===Fe(NO3)3+NO↑+2H2O,过量的铁粉再与Fe(NO3)3发生反应:Fe+2Fe(NO3)3===3Fe(NO3)2,充分反应后滴加KSCN溶液,溶液不会变为血红色,实验现象错误,故A不正确。B.铜粉与Fe2(SO4)3溶液发生反应:Cu+Fe2(SO4)3===CuSO4+2FeSO4,实验现象为溶液变蓝色,但是没有黑色固体出现,该实验能说明Fe3+的氧化性比Cu2+强,不能说明金属铁比铜活泼,因为铁没有置换出铜单质,故B不正确。C.Fe3+的氧化性比Cu2+的氧化性强,Fe先与Fe3+反应生成Fe2+,再与Cu2+反应生成单质Cu。固体一定含Cu,可能含Fe;溶液中一定含Fe2+,可能含Cu2+,故C不正确。D.纯铁和稀盐酸不能构成原电池,生铁中铁、碳、盐酸构成原电池,能加快反应速率,所以生铁反应速率比纯铁快,故D正确。
[答案] D
下列物质反应后一定有+3价铁生成的是________。
①过量的Fe与Cl2加热时发生反应 ②Fe与过量稀H2SO4反应后,再向其中加KNO3 ③Fe与过量的S加热时发生反应 ④Fe(NO3)2溶液中加少量盐酸 ⑤Fe和Fe2O3的混合物溶于盐酸中
解析:Fe与Cl2反应只生成FeCl3;FeFe2+Fe3+;Fe与S反应只生成FeS;Fe2+Fe3+;Fe2O3溶于盐酸生成Fe3+,当混合物中Fe不足时,溶液中仍有Fe3+,当Fe足量时,溶液中无Fe3+。
答案:①②④
分析铁的化合物时的“两分清”
1.价态要分清
(1)要注意单质铁被不同氧化剂氧化时,产物不同。
(2)要注意不同价态的化合物所表现的不同的化学性质,如Fe3+以氧化性为主,Fe2+以还原性为主。
2.颜色要分清
铁的化合物“五颜六色”,一定要记牢:Fe2+溶液为浅绿色,Fe3+溶液为棕黄色,Fe(SCN)3溶液为血红色,Fe(OH)3胶体为红褐色,Fe(OH)2沉淀在空气中的颜色变化为白色→灰绿色→红褐色,Fe(OH)3沉淀为红褐色固体,Fe2O3为红棕色,Fe3O4、FeO、FeS均为黑色。
题组一 铁及其化合物的性质
1.下列叙述正确的是( )
A.Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应
B.足量的Fe在Cl2中燃烧生成FeCl2和FeCl3
C.Fe和Fe2O3等物质的量混合物溶于稀盐酸时无气体放出
D.Fe2O3FeCl3(aq)无水FeCl3,在给定的条件下能实现转化
解析:选C。HNO3具有强氧化性,与Fe发生氧化还原反应,产生的气体为NO,A项错;铁与Cl2反应无论量的多少产物都是FeCl3,B项错;C项中Fe2O3溶解产生Fe3+恰好将铁单质氧化,因而不能置换出H2,正确;FeCl3溶液加热时易水解,D项错。
2.铁屑溶于过量稀硫酸,过滤后向滤液中加入过量氨水,有白色沉淀生成,过滤,在空气中加热沉淀至质量不再发生变化为止,得到红棕色残渣,上述沉淀和残渣分别是( )
A.Fe(OH)3 Fe2O3 B.Fe(OH)2 Fe2O3
C.Fe(OH)2 Fe(OH)3 D.Fe(OH)2 Fe3O4
解析:选B。铁与稀硫酸反应生成FeSO4,再与过量氨水反应生成白色沉淀Fe(OH)2,在空气中加热Fe(OH)2,铁元素被氧化为+3价,最后所得红棕色残渣为Fe2O3。
题组二 有关铁及其化合物的实验探究
3.下列关于FeCl3进行的实验,预测正确的是( )
选项
实验
预测
A
蒸发FeCl3溶液
得到FeCl3固体
B
在FeCl3、CuCl2混合液中,加入少量Fe粉
一定有H2产生且有Cu析出
C
用FeCl3固体溶于水配制饱和溶液
会有Fe(OH)3沉淀产生
D
在FeCl3溶液中加入KHCO3溶液
有CO2产生,但无
Fe(OH)3沉淀生成
解析:选C。蒸发FeCl3溶液可促进Fe3+水解,由于HCl易挥发,最后得到Fe(OH)3,A错;混合液中加入Fe粉时,不会有H2产生且Fe应先和Fe3+反应,再与Cu2+反应,B错;FeCl3易水解生成Fe(OH)3沉淀,C对;Fe3+与HCO发生水解相互促进的反应,有CO2和Fe(OH)3沉淀生成,D错。
4.用下列方法可制得白色的Fe(OH)2沉淀:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入__________。
(2)除去蒸馏水中溶解的O2常采用________的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是__________________________。
(4)下列各图示中,能较长时间观察到Fe(OH)2白色沉淀的是________。
解析:(1)Fe2+易水解,要加入稀硫酸防止其水解;Fe2+易被空气中的O2氧化,要加Fe粉防止Fe2+被氧化。(2)气体的溶解度随温度升高而降低,所以煮沸后的水中溶解的O2较少。(4)因为Fe(OH)2在空气中很容易被氧化为红褐色的Fe(OH)3,即发生4Fe(OH)2+O2+2H2O===4Fe(OH)3。因此要较长时间看到Fe(OH)2白色沉淀,就要排除装置中的氧气或空气。①、②原理相同,都是先用氢气将装置中的空气排尽,并使生成的Fe(OH)2处在氢气的保护中;③的原理为铁作阳极产生Fe2+,与电解水产生的OH-结合生成 Fe(OH)2,且液面用汽油保护,能防止空气进入;⑤中液面加苯阻止了空气进入;④由于带入空气中的氧气,能迅速将Fe(OH)2氧化,因而不能较长时间观察到白色沉淀。
答案:(1)稀硫酸、铁屑
(2)煮沸
(3)避免生成的Fe(OH)2沉淀接触O2
(4)①②③⑤
制备Fe(OH)2的关键与方法
由于Fe(OH)2具有很强的还原性,易被氧化为Fe(OH)3,在实验室中制备Fe(OH)2,并使Fe(OH)2长时间保持白色沉淀状态,成为物质制备实验探究的热点。
制备原理:Fe2++2OH-===Fe(OH)2↓。
(1)成功关键
①溶液中不含Fe3+和O2等氧化性物质;
②制备过程中,保证生成的Fe(OH)2在密闭的隔绝空气的体系中。
(2)制备Fe(OH)2时常采用的方法
①采用新制备的纯亚铁盐溶液(Fe2+易被空气中的氧气氧化成Fe3+);
②将溶解亚铁盐的蒸馏水煮沸(除去溶解的氧气);
③将碱直接加到亚铁盐溶液的底部[使生成的Fe(OH)2与空气隔离];
④在亚铁盐溶液的液面上加隔氧剂(如加入苯等密度比水小而又不溶于水的有机溶剂)。
Fe2+和Fe3+的性质及其检验方法
[知识梳理]
1.Fe2+、Fe3+的性质及相互转化
(1)Fe2+的氧化性和还原性
Fe2+处于铁的中间价态,既有氧化性,又有还原性。在中学阶段接触Fe2+的氧化还原反应中其主要表现还原性,如Fe2+遇Br2、Cl2、H2O2、NO(H+)等均表现还原性。
(2)Fe3+的氧化性
Fe3+处于铁的高价态,表现较强的氧化性,如它能氧化Fe、Cu、HI、H2S等。
(3)Fe2+与Fe3+的相互转化
用离子方程式表示下列转化:
Fe2+Fe3+
①2Fe2++Cl2===2Fe3++2Cl-;
②3Fe2++4H++NO===3Fe3++2H2O+NO↑;
③2Fe3++Fe===3Fe2+;
④Cu+2Fe3+===Cu2++2Fe2+。
2.Fe2+、Fe3+的检验
(1)Fe2+的检验
①取出少量被检验的溶液,滴加KSCN溶液,无现象,再通入Cl2,若变成血红色溶液,说明有Fe2+存在(验证时不能先通氯气)。
反应方程式:2Fe2++Cl2===2Fe3++2Cl-,Fe3++3SCN-===Fe(SCN)3(血红色)。
②取出少量被检验的溶液,加入NaOH溶液,产生白色絮状沉淀,白色絮状沉淀迅速变成灰绿色,最终变为红褐色,证明有Fe2+存在。
反应方程式:Fe2++2OH-===Fe(OH)2↓(白色沉淀),
4Fe(OH)2+O2+2H2O===4Fe(OH)3(红褐色沉淀)。
(2)Fe3+的检验
①取出少量被检验的溶液,加入KSCN溶液,溶液呈血红色,证明有Fe3+存在。
反应方程式:Fe3++3SCN-===Fe(SCN)3(血红色)。
②取出少量被检验的溶液,加入NaOH溶液,产生红褐色沉淀,证明有Fe3+存在。
反应方程式:Fe3++3OH-===Fe(OH)3↓(红褐色沉淀)。
[自我检测]
1.为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,其中实验方案设计错误的是________。
解析:③CuSO4与FeCl3不反应;④生成AgCl白色沉淀,与Fe3+无关。
答案:③④
2.如何除去括号中的杂质:
(1)Fe2+(Fe3+):________________;
(2)FeCl3(FeCl2):________________;
(3)FeCl2(CuCl2):________________;
(4)Fe(Al):________________;
(5)Fe2O3(Al2O3、SiO2):________________。
答案:(1)加过量铁粉,过滤 (2)加氯水(或H2O2)
(3)加过量铁粉,过滤 (4)加过量强碱溶液,过滤
(5)加过量强碱溶液,过滤
检验Fe2+和Fe3+时的注意事项
(1)检验Fe2+时不能先加氯水后加KSCN溶液,也不能将加KSCN后的混合溶液加入到足量的新制氯水中(新制氯水可以氧化SCN-)。
(2)当溶液浓度较稀时,利用观察法或加NaOH溶液的方法都不宜检验Fe2+和Fe3+的存在。
(3)Fe3+、Fe2+、Cl-同时存在时不能用酸性KMnO4溶液检验Fe2+(Cl-能还原酸性KMnO4,有干扰)。
(4)检验Fe2+、Fe3+的其他方法
①检验Fe2+最好、最灵敏的试剂是铁氰化钾K3[Fe(CN)6]:3Fe2++2[Fe(CN)6]3-===Fe3[Fe(CN)6]2↓(蓝色)。
②检验Fe3+也可用苯酚(C6H5OH),在FeCl3溶液中滴加苯酚,溶液显紫色。
(2016·高考全国卷Ⅱ,28,15分)某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol/L的溶液。在FeCl2溶液中需加入少量铁屑,其目的是_______________________________。
(2)甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为______________________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是________________________。
(4)丙组同学取10 mL 0.1 mol/L KI溶液,加入6 mL 0.1 mol/L FeCl3溶液混合。分别取2 mL此溶液于3支试管中进行如下实验:
①第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是________(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有________(填离子符号),由此可以证明该氧化还原反应为________________。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为______________________________________________;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是_________;生成沉淀的原因是______________________ (用平衡移动原理解释)。
[解析] (1)Fe2+具有还原性,FeCl2溶液易被氧化而变质,配制FeCl2溶液时加入少量铁屑,目的是防止Fe2+被氧化。(2)溶液变红,说明有Fe3+生成,则FeCl2溶液与氯水反应生成FeCl3,离子方程式为2Fe2++Cl2===2Fe3++2Cl-。(3)甲组实验中,FeCl2易被空气中的O2氧化,会生成FeCl3,因此实验不够严谨。加入煤油,煤油的密度比水小,可以起到隔绝空气的作用,从而排除氧气对实验的影响。(4)实验②中K3[Fe(CN)6]溶液的作用是检验Fe2+。根据实验①,CCl4层显紫色,说明有I2生成,根据实验②,生成蓝色沉淀,说明有Fe2+生成,根据实验③,溶液变红,说明有Fe3+剩余,I-过量的情况下,溶液中仍含有Fe3+,由此说明该反应为可逆反应。(5)溶液变为棕黄色,说明生成了Fe3+,离子方程式为2Fe2++H2O2+2H+===2Fe3++2H2O。溶液中有气泡出现,说明H2O2在Fe3+的催化作用下发生了分解反应,生成了O2。随后生成红褐色沉淀,则沉淀为Fe(OH)3,H2O2分解放出热量,Fe3+的水解平衡Fe3++3H2OFe(OH)3+3H+向正反应方向不断进行,因此得到Fe(OH)3沉淀。
[答案] (1)防止Fe2+被氧化
(2)2Fe2++Cl2===2Fe3++2Cl-
(3)隔绝空气(排除氧气对实验的影响)
(4)Fe2+ Fe3+ 可逆反应
(5)2Fe2++H2O2+2H+===2Fe3++2H2O Fe3+催化H2O2分解产生O2 H2O2分解反应放热,促进Fe3+的水解平衡正向移动
(2015·高考上海卷)检验用硫酸亚铁制得的硫酸铁中是否含有硫酸亚铁,可使用的试剂是( )
A.NaOH B.KMnO4
C.KSCN D.
解析:选B。A.若加入NaOH,硫酸亚铁发生反应产生的白色Fe(OH)2会被硫酸铁发生反应产生的红褐色的Fe(OH)3遮挡,不容易观察到,因此不能检验,错误。B.KMnO4有氧化性,硫酸亚铁有还原性,会发生氧化还原反应,使KMnO4的紫色褪去,而硫酸铁不能与KMnO4发生反应,因此可以作为检验试剂,正确。C.KSCN与硫酸铁会发生反应,使溶液变血红色,而硫酸亚铁不能反应,因此无论硫酸亚铁是否存在,溶液都变血红色,因此无法检验,错误。D.苯酚与硫酸铁溶液发生显色反应,使溶液变为紫色,而与硫酸亚铁不能发生反应,无论硫酸亚铁是否存在,溶液都变紫色,所以不能作为检验试剂,错误。
题组一 Fe2+、Fe3+的性质及相互转化
1.在含有Fe3+、Fe2+、Al3+、NH的稀溶液中加入足量Na2O2固体,充分作用后,再加入过量稀盐酸,完全反应,则离子数目没有变化的是( )
A.Fe3+、Al3+ B.Al3+
C.Fe2+、NH D.Fe3+
解析:选B。2Na2O2+2H2O===4NaOH+O2↑,Fe2+转变为Fe3+,Fe3+转变为Fe(OH)3沉淀析出,Al3+转变为AlO,NH转变为NH3气体,NH减少。没有过滤,再加入过量稀盐酸,Fe(OH)3沉淀转变为Fe3+,所以Fe2+减少,Fe3+增多,AlO再转变为Al3+,几乎不变。
2.下列除杂的操作不正确的是( )
A.MgCl2溶液中混有少量FeCl3:加入足量MgO充分反应后过滤
B.FeCl2溶液中混有少量FeCl3:加入过量铁粉充分反应后过滤
C.CuCl2溶液中混有少量FeCl3:加入NaOH溶液充分反应后过滤
D.CuCl2溶液中混有少量FeCl2:先加入H2O2将Fe2+氧化成Fe3+,再加入CuO充分反应后过滤
解析:选C。FeCl3溶液中存在水解平衡:FeCl3+3H2OFe(OH)3+3HCl,加入MgO与H+反应,上述平衡右移,使Fe3+转化成Fe(OH)3而除去,A正确;加入过量铁粉,FeCl3与Fe反应生成FeCl2而达到除杂的目的,B正确;先用H2O2将Fe2+氧化成Fe3+,再利用FeCl3的水解,加入CuO与H+反应,将Fe3+转化成Fe(OH)3而除去,D正确;C项中加入NaOH溶液,Cu2+、Fe3+均转化成氢氧化物沉淀,不符合除杂要求。
题组二 Fe2+、Fe3+的检验
3.下列离子的检验方法合理的是( )
A.向某溶液中滴入KSCN溶液,溶液呈血红色,说明原溶液中不含Fe2+
B.向某溶液中通入Cl2,然后再加入KSCN溶液,溶液变血红色,说明原溶液中含有Fe2+
C.向某溶液中加入NaOH溶液,得红褐色沉淀,说明原溶液中含有Fe3+
D.向某溶液中加入NaOH溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明该溶液中只含有Fe2+,不含有Mg2+
解析:选C。A.原溶液呈血红色,说明含Fe3+,无法判断是否含有Fe2+;B.原溶液 呈血红色,说明反应后溶液中含Fe3+,但Cl2有氧化性,无法判断原溶液中是含有Fe2+还是含有Fe3+;C.原溶液红褐色沉淀,说明原溶液中含有Fe3+;D.原溶液白色沉淀―→红褐色沉淀,说明原溶液中含有Fe2+,但由于红褐色的掩盖,无法说明是否含有Mg2+。
4.工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:
(1)气体A中的大气污染物可选用下列试剂中的________吸收。
a.浓H2SO4 b.稀HNO3
c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈血红色,说明溶液中存在________(填离子符号),检验溶液中还存在Fe2+的方法是______________________ (注明试剂、现象)。
解析:(1)冰铜(mCu2S·nFeS)加入石英砂并通入空气焙烧生成泡铜(Cu2O、Cu)、熔渣和SO2气体(A)。SO2是一种酸性氧化物,可用NaOH溶液或氨水吸收。(2)溶液中滴加KSCN溶液呈血红色,说明含有Fe3+。可利用Fe2+的还原性来检验溶液中是否存在Fe2+,加入酸性KMnO4溶液,酸性KMnO4溶液褪色,说明还存在Fe2+。
答案:(1)cd (2)Fe3+ 另取少量溶液,滴加酸性KMnO4溶液,酸性KMnO4溶液褪色,说明还存在Fe2+
1.含Fe3+、Fe2+的混合溶液中Fe3+、Fe2+的检验
(1)Fe3+的检验
溶液变血红色,说明含有Fe3+
试纸变蓝色,说明含有Fe3+
(2)Fe2+的检验
KMnO4溶液紫红色褪去,说明含有Fe2+
溴水褪色,说明含有Fe2+
2.Fe2+、Fe3+性质的应用
(1)判断离子共存
①Fe3+与I-、S2-、SO因发生氧化还原反应而不能大量共存。
②Fe2+与ClO-、MnO、NO(H+)等离子因发生氧化还原反应而不能大量共存。
(2)盐溶液的配制与保存
①Fe2+的盐溶液:加少量铁粉,防止Fe2+被氧化;加少量相应的酸,抑制Fe2+水解。
②Fe3+的盐溶液:加少量相应的酸抑制Fe3+水解。
铜及其化合物的性质
[知识梳理]
1.单质铜
(1)物理性质:紫红色固体,具有良好的延展性、导热性和导电性。
(2)化学性质
写出图中有关反应的化学方程式或离子方程式:
①2Cu+O2+CO2+H2O===Cu2(OH)2CO3(绿色固体)。
②2Cu+SCu2S。
③与氧化性酸反应
a.与浓硫酸共热的化学方程式:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O;
b.与稀硝酸反应的离子方程式:3Cu+8H++2NO===3Cu2++2NO↑+4H2O。
④与盐溶液反应(写离子方程式)
a.与硝酸银溶液:Cu+2Ag+===2Ag+Cu2+;
b.与FeCl3溶液:Cu+2Fe3+===2Fe2++Cu2+。
2.氧化铜和氧化亚铜
名称
氧化铜
氧化亚铜
颜色
黑色
砖红色
与酸反
应(H+)
CuO+2H+===
Cu2++H2O
Cu2O+2H+===
Cu2++Cu+H2O
与H2反应
CuO+H2
Cu+H2O
Cu2O+H2
2Cu+H2O
转化关系
4CuO2Cu2O+O2↑
3.氢氧化铜
(1)物理性质:蓝色不溶于水的固体。
(2)化学性质及应用
4.CuSO4·5H2O
CuSO4·5H2O为蓝色晶体,俗称蓝矾、胆矾。无水CuSO4为白色粉末,遇水变蓝色(生成CuSO4·5H2O),可作为检验水的依据。
[自我检测]
1.波尔多液是一种农业上应用广泛的杀菌剂,它是由硫酸铜、生石灰和水按一定比例配成的天蓝色胶状悬浊液,思考下列问题:
(1)波尔多液能否用铁桶盛放?为什么?
(2)波尔多液能杀菌的原因是什么?
答案:(1)不能。原因是铁能置换波尔多液中的Cu2+,降低杀菌能力。
(2)CuSO4是重金属盐,能使蛋白质变性。
2.把铜及其化合物的化学式与其颜色连接起来。
答案:
(1)通常利用反应:2Cu+O22CuO除去混合气体中的少量O2或用于测定混合气体中O2的含量。
(2)无水CuSO4常用作水的检验剂;由于其吸水效率低,一般不用作干燥剂。
(3)铜可在O2和H+共存环境中逐渐溶解,如2Cu+O2+2H2SO4===2CuSO4+2H2O。
(4)溶液中的Cu2+常为蓝色(浓CuCl2溶液为蓝绿色,稀CuCl2溶液为蓝色),可作为Cu2+的判定依据,如CuSO4溶液呈蓝色。
(5)Cu2+与碱反应生成蓝色沉淀Cu(OH)2,这是鉴定Cu2+的原理之一。
为了比较铁和铜的金属活动性强弱,某化学研究小组的同学设计了如下方案,并将实验结果记录如下:
方案
现象或产物
①将铁片置于CuSO4溶液中
铁片上有亮红色物质析出
②将铁丝和铜丝分别在氯气中燃烧
产物分别为FeCl3和CuCl2
③将铁片和铜片分别放入热的浓硫酸中
产物分别为Fe2(SO4)3和CuSO4
④将铁片和铜片分别放入稀硫酸中
铁片上有气泡逸出,铜片上没有气泡逸出
⑤将铁片和铜片同时插入盛有稀硫酸的烧杯中,并用导线连接
铁片逐渐溶解,铜片上有气泡逸出
能根据上述现象或产物证明铁的金属活动性比铜强的方案一共有( )
A.2种 B.3种
C.4种 D.5种
[解析] ①铁能置换出铜,可证明铁比铜活泼;④铁能置换出稀硫酸中的氢,而铜不能,可证明铁比铜活泼;⑤铁、铜、稀硫酸形成原电池,铁作负极,铜作正极,可证明铁比铜活泼,共有3种方案符合题意,选项B正确。
[答案] B
(1)已知2FeCl3+Cu===2FeCl2+CuCl2,上述反应能否证明铁比铜活泼?
(2)向FeCl3、CuCl2、FeCl2混合液中插入锌棒,金属阳离子先后发生反应的顺序怎样?
答案:(1)不能。只证明氧化性:Fe3+>Cu2+,还原性:Cu>Fe2+。
(2)先后发生反应的顺序为Fe3+、Cu2+、Fe2+。
题组一 铜及其化合物的性质
1.现有下列五个转化,其中不能通过一步反应实现的是( )
①SiO2―→Na2SiO3
②CuSO4―→CuCl2
③SiO2―→H2SiO3
④CuO―→Cu(OH)2
⑤Na2O2―→Na2SO4
A.①② B.③④
C.②③④ D.②③④⑤
解析:选B。①SiO2+2NaOH===Na2SiO3+H2O;②CuSO4+BaCl2===BaSO4↓+CuCl2;③SiO2不溶于水,不能一步生成H2SiO3;④CuO不溶于水,不能一步生成Cu(OH)2;⑤Na2O2+SO2===Na2SO4。
2.下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是( )
选项
陈述Ⅰ
陈述Ⅱ
判断
A
铜绿的主要成分是碱式碳酸铜
可用稀盐酸除铜器表面的铜绿
Ⅰ对;Ⅱ对;无
B
铜表面易形成致密的氧化膜
铜容器可以盛放浓硫酸
Ⅰ对;Ⅱ对;有
C
向硫酸铜溶液通入氨气,有深蓝色沉淀产生,过滤后灼烧滤渣,最后变成黑色固体
把铜丝放在酒精灯火焰上灼烧,铜丝表面变黑
Ⅰ对;Ⅱ对;有
D
蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化
硫酸铜溶液可用作游泳池的消毒剂
Ⅰ错;Ⅱ对;无
解析:选D。稀盐酸可以与Cu2(OH)2CO3反应,而不能与Cu反应,所以可用稀盐酸除铜器表面的铜绿Cu2(OH)2CO3,Ⅰ、Ⅱ有因果关系,A错误;铜表面不能形成致密的氧化膜,铜与浓硫酸在一定温度下能发生反应,所以不能用铜制容器盛装浓硫酸,B错误;硫酸铜与氨水生成Cu(OH)2,Cu(OH)2受热分解生成黑色CuO,Ⅰ、Ⅱ均正确,但没有因果关系,C错误;蓝色硫酸铜晶体受热转化为白色硫酸铜粉末有新物质生成,属于化学变化,CuSO4可用作消毒剂,但与前者没有因果关系,D正确。
题组二 铜及其化合物的制备
3.孔雀石的主要成分为Cu2(OH)2CO3。某同学设计的从孔雀石中冶炼铜的方案如下(假设孔雀石中杂质不溶于水和稀硫酸):
(1)反应①能观察到的现象是_____________________,
有关反应的化学方程式为_______________________________。
(2)反应②加入的金属可能是________,有关反应的离子方程式为___________________。
(3)操作a可能的方法是________,欲除掉的杂质为________________________;要从操作a所得到的溶液中得到溶质的晶体,需要进行的操作是________________________。
解析:(1)孔雀石中加入稀硫酸可看到孔雀石逐渐溶解,溶液由无色变为蓝色,且有气泡产生;反应的化学方程式为Cu2(OH)2CO3+2H2SO4===2CuSO4+CO2↑+3H2O。(2)~(3)经过滤除去难溶于水和稀硫酸的杂质,则滤液中主要含有CuSO4,加入的金属粉末能将Cu2+从溶液中置换出来即可,故金属可能是Fe或Zn等;要从滤液中得到CuSO4晶体,需进行加热浓缩、冷却结晶等操作。
答案:(1)固体逐渐消失,溶液由无色变为蓝色,有气泡产生
Cu2(OH)2CO3+2H2SO4===2CuSO4+CO2↑+3H2O
(2)铁粉 Fe+Cu2+===Fe2++Cu(答案合理即可)
(3)过滤 难溶于水和稀硫酸的杂质 加热浓缩、冷却结晶
4.某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应精制CuO,其设计的实验过程为
(1)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,灼烧后含有少量铜的可能原因是________。
A.灼烧过程中部分氧化铜被还原
B.灼烧不充分铜未被完全氧化
C.氧化铜在加热过程中分解生成铜
D.该条件下铜无法被氧气氧化
(2)由粗制氧化铜通过两种途径制取纯净CuO,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是________________________________________________________________________
________________________________________________________________________。
(3)有同学指出,由CuSO4溶液到生成CuO少了一个环节,即应先生成Cu(OH)2沉淀,过滤洗涤后再加热分解Cu(OH)2得CuO。以下说法不可能成为减少该环节的理由的是________。
A.CuO比Cu(OH)2颗粒粗大,更易于过滤从溶液中分离
B.Cu(OH)2分解温度较低,加热其浊液即可使其分解
C.干态下分解Cu(OH)2,温度难以控制,可能因温度过高导致CuO进一步分解生成Cu2O
D.过滤分离出的CuO不需洗涤就已非常纯净
答案:(1)AB (2)耗酸少,无污染性气体SO2产生 (3)D
铜的冶炼“三方法”
(1)湿法炼铜:Fe+CuSO4===FeSO4+Cu。
(2)高温炼铜:工业上用高温冶炼黄铜矿的方法获得铜(粗铜):
2CuFeS2+4O2Cu2S+3SO2+2FeO(炉渣)
2Cu2S+3O22Cu2O+2SO2
2Cu2O+Cu2S6Cu+SO2↑
粗铜中铜的含量为99.5%~99.7%,主要含有Ag、Zn、Fe、Au等杂质,粗铜通过电解精炼可得到纯度达99.95%~99.98%的铜。
电解精炼铜的原理是用粗铜作阳极,失电子变为Cu2+,用纯铜棒作阴极即可得到精铜。
(3)生物炼铜:“吃岩石的细菌”能耐受铜盐的毒性,并能利用空气中的氧气氧化硫化铜矿石,然后把不溶性的硫化铜转化为可溶性的硫酸铜。
生物炼铜的优点:①成本低;②污染小;③反应条件简单;④含量(品位)很低的矿石也可以被利用。
[课后达标检测]
一、选择题
1.唐代中药学著作《新修本草》中,有关于“青矾”的记录为“本来绿色,新出窟未见风者,正如琉璃……烧之赤色”。据此推测,“青矾”的主要成分为( )
A.CuSO4·5H2O
B.FeSO4·7H2O
C.KAl(SO4)2·12H2O
D.Fe2(SO4)3·9H2O
解析:选B。 “青矾”的描述为“本来绿色,新出窟未见风者,正如琉璃…烧之赤色”,青矾是绿色,经煅烧后,分解成粒度非常细而活性又很强的Fe2O3超细粉末,为红色。A中CuSO4·5H2O为蓝色晶体;B中FeSO4·7H2O是绿色晶体;C中KAl(SO4)2·12H2O是无色晶体;D中Fe2(SO4)3·9H2O为黄色晶体,所以判断“青矾”的主要成分为FeSO4·7H2O。
2.下列关于铁及其化合物的说法中正确的是( )
A.氯化亚铁溶液保存时加少量盐酸,是为了防止其被氧化
B.将氯化铁溶液直接蒸干可得到无水氯化铁
C.通入氯气可除去硫酸铁中少量硫酸亚铁杂质
D.用磁铁吸引可分离铁粉和铜粉
解析:选D。A项加少量盐酸是为了抑制亚铁离子水解,错误;B项应该在HCl气流中蒸干,错误;C项通入氯气会引入新杂质Cl-,错误。
3.下列物质不能通过化合反应直接制得的是( )
A.FeCl2 B.NaHSO3
C.Cu(OH)2 D.Fe(OH)3
解析:选C。C项,氧化铜和水不能反应。D项,4Fe(OH)2+O2+2H2O===4Fe(OH)3。
4.(2018·沧州高三模拟)铁片投入下列溶液后,铁片质量减少,但无气体产生的是( )
A.冷浓HNO3 B.Cu(NO3)2溶液
C.稀硫酸 D.Fe(NO3)3溶液
解析:选D。Fe在冷浓硝酸中钝化,铁片质量增加;Fe和Cu(NO3)2反应,在Fe片上附有Cu,铁片质量增加;Fe和稀H2SO4反应有H2产生;Fe与Fe(NO3)3反应无气体放出,生成Fe(NO3)2,铁片质量减少。
5.在实验室里用铁屑、氧化铜、稀硫酸为原料制备铜,有下列两种途径:
(1)FeH2Cu;
(2)CuOCuSO4Cu。
若用这两种方法制得的铜质量相等,则下列有关说法符合实际情况的是( )
A.消耗氧化铜的质量不同
B.消耗铁的质量相同
C.消耗硫酸的质量相同
D.生成硫酸亚铁的质量不同
解析:选D。途径(1)中用H2还原CuO时,实验前需先通H2排出装置中的空气,实验结束时要继续通H2至试管冷却,故利用途径(1)制取1 mol Cu,消耗的H2大于 1 mol,即Fe和H2SO4的消耗量均为(1)>(2),生成FeSO4的质量(1)>(2),但两种途径中消耗CuO的质量相等。
6.下列各组物质中,X是主体物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的一组是( )
选项
A
B
C
D
X
FeCl2溶液
FeCl3溶液
Fe
FeSO4溶液
Y
FeCl3
CuCl2
Al
Fe2(SO4)3
Z
Cl2
Fe
NaOH溶液
Cu
解析:选C。Cl2与FeCl2反应,A错误;Fe与FeCl3、CuCl2均反应,B错误;D项有新的杂质CuSO4生成,D错误。
7.(2018·河北三市联考)化学美无处不在,如图是物质间发生化学反应的颜色变化,其中物质a、b、c、d对应的物质正确的是( )
选项
物质a
物质b
物质c
物质d
A
Cu2(OH)2CO3
Ba(OH)2
Fe(OH)3
酚酞试液
B
CuO
NaAlO2
Fe2O3
紫色石蕊试液
C
Cu2O
BaCl2
Fe2O3和Cu
酚酞试液
D
Cu(OH)2
Ba(NO3)2
Fe(OH)2
紫色石蕊试液
解析:选D。稀硫酸与Fe(OH)3、Fe2O3反应得到的Fe2(SO4)3溶液呈棕黄色,稀硫酸遇酚酞试液显无色,A、B、C项均错误;稀硫酸与Cu(OH)2反应得到的CuSO4溶液呈蓝色,稀硫酸与Ba(NO3)2反应得到的BaSO4是白色沉淀,稀硫酸与Fe(OH)2反应得到的FeSO4溶液呈浅绿色,稀硫酸遇紫色石蕊试液变红,D项正确。
8.将1.12 g铁粉加入25 mL 2 mol·L-1氯化铁溶液中,充分反应后,其结果是( )
A.铁有剩余,溶液呈浅绿色,Cl-浓度基本不变
B.向溶液中滴入无色KSCN溶液,显血红色
C.Fe2+和Fe3+的物质的量之比为5∶1
D.氧化产物与还原产物的物质的量之比为2∶5
解析:选B。n(Fe)==0.02 mol,n(Fe3+)=0.025 L×2 mol·L-1=0.05 mol,由反应:Fe+2Fe3+===3Fe2+可知Fe3+过量,加入KSCN显血红色,溶液中n(Fe2+)=3n(Fe)=0.06 mol,溶液中剩余n(Fe3+)=0.05 mol-2n(Fe)=0.01 mol,即Fe2+和Fe3+的物质的量之比为6∶1;氧化产物与还原产物的物质的量之比为1∶2。
9.通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是( )
选项
操作与现象
解释
A
向淀粉KI溶液中加入FeCl3溶液,溶液变蓝
Fe3+能与淀粉发生显色反应
B
把生铁放置于潮湿的空气中,铁表面有一层红棕色的斑点
铁在潮湿的空气中易生成Fe(OH)3
C
向稀硝酸中加入少量铁粉,有气泡产生
说明Fe置换出硝酸中的氢,生成了氢气
D
新制Fe(OH)2露置于空气中一段时间,白色物质变成了红褐色
说明Fe(OH)2易被O2氧化成Fe(OH)3
解析:选D。A项中Fe3+将I-氧化为I2,碘遇淀粉变蓝;B项中红棕色斑点是Fe2O3;C项中铁与稀硝酸反应产生的气体为NO。
10.下列说法中正确的个数为( )
①氢气通过灼热的CuO粉末反应后固体物质增重
②用CuCl2溶液做导电实验,灯泡发光是因为CuCl2Cu2++2Cl-
③Cu溶于稀HNO3的离子方程式:3Cu+8H++2NO===3Cu2++2NO↑+4H2O
④常温下,Cu既能与FeCl3溶液反应又能与浓硝酸反应
A.1 B.2
C.3 D.4
解析:选B。①中,CuO(s)―→Cu(s),固体物质质量减少,错误;②中,用CuCl2溶液做导电实验,实质是电解CuCl2溶液,其电解化学方程式为CuCl2Cu+Cl2↑,错误;③④正确。
11.在Fe(NO3)3和Cu(NO3)2的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示,则原混合溶液中Fe(NO3)3与Cu(NO3)2的物质的量浓度之比为( )
A.3∶1 B.1∶2
C.2∶1 D.1∶1
解析:选C。由离子方程式:2Fe3++Fe===3Fe2+、Fe+Cu2+===Fe2++Cu,结合图像可知,c(Fe2+)的大小范围在 0~3 mol·L-1变化快,3 mol·L-1是拐点,此前发生2Fe3++Fe===3Fe2+,在3~4 mol·L-1范围内变化时发生Fe+Cu2+===Fe2++Cu,两阶段消耗Fe的量相同。由化学方程式2Fe3++Fe===3Fe2+可得,n(Fe3+)=2n(Fe),由化学方程式Fe+Cu2+===Fe2++Cu可得,n(Cu2+)=n(Fe),故原溶液中c(Fe3+)∶c(Cu2+)=2∶1。
二、非选择题
12.根据下列转化关系,回答有关问题。
(1)浅绿色溶液D主要成分的化学式为________,试剂1是________。
(2)下列物质不能作为试剂2的是________(填序号)。
a.Cl2 b.新制氯水
c.浓硫酸 d.S
e.硝酸
(3)固体A溶于稀盐酸的化学方程式为____________________________________。
(4)溶液C到溶液F红色加深的原因是__________________。
(5)某同学在实验时向E中加入了过量的一种固体物质,发现棕黄色褪去,现对褪色原因进行探究。提出你的假设:____________________;为了对你所提出的假设进行验证,你设计的实验方案是___________________________________________________
________________________________________________________________________
________________________________________________________________________。
解析:从框图可知,Fe和稀盐酸反应生成FeCl2溶液,为浅绿色,即D的主要成分为FeCl2,加入试剂2后变为棕黄色溶液,联想最终变成深红色溶液F(硫氰化铁溶液),可以推断溶液E的主要成分为Fe3+,试剂2为强氧化剂,S不符合条件。Fe与H2O(g)反应生成固体Fe3O4,Fe3O4与盐酸反应的化学方程式为Fe3O4+8HCl===2FeCl3+FeCl2+4H2O,所以溶液B为FeCl3和FeCl2的混合溶液,加入试剂1(KSCN溶液)后,Fe3+变成Fe(SCN)3,加入试剂2(强氧化剂),Fe2+被氧化为Fe3+,并进一步转化为Fe(SCN)3,所以溶液红色加深。
答案:(1)FeCl2 KSCN溶液
(2)d (3)Fe3O4+8HCl===2FeCl3+FeCl2+4H2O
(4)溶液中的Fe2+被氧化剂氧化成Fe3+,使Fe3+浓度增大,从而生成更多的硫氰化铁使红色加深
(5)加入还原剂将Fe3+还原 用胶头滴管取少量棕黄色褪去后的溶液于试管中,滴加少量KSCN溶液,再加入几滴氯水。如果溶液开始不出现血红色,加氯水后出现血红色,则说明假设正确;若溶液不变血红色,则假设不正确
13.(2017·高考江苏卷)碱式氯化铜是重要的无机杀菌剂。碱式氯化铜有多种制备方法:
(1)方法1: 45~50 ℃时,向CuCl悬浊液中持续通入空气得到Cu2 (OH)2 Cl2·3H2O, 该反应的化学方程式为__________________________________。
(2)方法2: 先制得CuCl2,再与石灰乳反应生成碱式氯化铜。Cu与稀盐酸在持续通入空气的条件下反应生成CuCl2,Fe3+对该反应有催化作用,其催化原理如图所示。 M′的化学式为________________。
解析:(1)在H2O存在的条件下,CuCl能被空气中的O2氧化生成Cu2(OH)2Cl2·3H2O,根据得失电子守恒配平反应的化学方程式。
(2)由题图知,O2氧化M′生成M,根据题意“Fe3+对该反应有催化作用”,则M′为Fe2+。
答案:(1)4CuCl+O2+8H2O2Cu2(OH)2Cl2·3H2O
(2)Fe2+
14.Fe3O4是重要的化学试剂,铁粉在氧气中燃烧是制取它最为常见和快捷的方法。图1是制取四氧化三铁的系列装置,A装置用于制取二氧化碳气体,并要求气流稳定,流速可控。
请回答下列问题:
(1)图2中仪器a的名称是________。
(2)根据题目要求,在图2中最好选择________(填序号)作为A装置。
(3)对图2中装置①进行气密性检查的方法是______________________________________
____________________,向分液漏斗中加足量水,过一会,水不再下滴,说明装置①的气密性良好。
(4)在B装置中发生的主要反应的化学方程式是______________________。
(5)当产生的气体与事先预热的铁粉接触时,在硬质玻璃管中将观察到的明显现象是________________________________________________________________________。
(6)反应一段时间后,若将硬质玻璃管中的固体粉末用盐酸溶解,取少许溶液于试管中,加入淀粉KI溶液,没有蓝色出现,推测固体粉末中除Fe3O4外,一定有________________________________________________________________________。
(7)若铁粉被完全消耗,某同学为确定生成物中有+2价铁,取少量生成物于试管中,加入适量的稀硫酸溶解。
①写出溶解过程发生反应的离子方程式:_______________________________________
________________________________________________________________________。
②写出确定+2价铁所用试剂名称、操作步骤、实验现象和结论:__________
________________________________________________________________________。
解析:(1)图2中仪器a为长颈漏斗。(2)图2中三个装置只有③可以达到气流稳定、流速可控的目的。(3)检查装置①的气密性时需用止水夹夹住橡胶管,确保装置中密封住一定体积的气体。(4)B装置中Na2O2与CO2反应生成Na2CO3和O2。(5)在硬质玻璃管中铁粉与O2剧烈反应,并有火星产生。(6)加入淀粉KI溶液没有出现蓝色,说明溶液中没有Fe3+,即生成物中除了有Fe3O4外,还有铁粉剩余,Fe3O4溶于盐酸生成的Fe3+被Fe还原为Fe2+。(7)①Fe3O4溶于稀硫酸生成Fe3+和Fe2+,其离子方程式为Fe3O4+8H+===2Fe3++Fe2++4H2O。②检验溶液中含有Fe2+,可用K3[Fe(CN)6]溶液或酸性高锰酸钾溶液。
答案:(1)长颈漏斗 (2)③ (3)用止水夹夹紧橡胶管
(4)2Na2O2+2CO2===2Na2CO3+O2
(5)铁粉剧烈燃烧,火星四射 (6)铁粉 (7)①Fe3O4+8H+===2Fe3++Fe2++4H2O ②用小试管取少量溶液,向其中逐滴加入K3[Fe(CN)6]溶液,若出现蓝色沉淀,说明有+2价铁存在(或用小试管取少量酸性高锰酸钾溶液,滴入几滴题述溶液,若紫红色变浅,说明有+2价铁存在)
铁及其重要化合物的性质
[知识梳理]
一、单质铁
1.物理性质
铁具有金属的共性,具有能被磁体吸引的特性。
2.化学性质
(1)与非金属单质的反应
(2)与水蒸气的反应
3Fe+4H2O(g)Fe3O4+4H2
(3)与酸、盐的反应
钝化
二、铁的冶炼
1.铁元素的存在
铁元素在自然界主要以化合态的形式存在,常见的铁矿有磁铁矿(主要成分为Fe3O4)、赤铁矿(主要成分为Fe2O3)。
2.炼铁原料:铁矿石、焦炭、空气、石灰石。
3.完成下列化学方程式
(1)一氧化碳的生成:C+O2CO2、CO2+C2CO。
(2)铁矿石被还原:Fe2O3+3CO2Fe+3CO2。
(3)石灰石的作用:CaCO3CaO+CO2↑、CaO+SiO2CaSiO3。
三、铁的氧化物
化学式
FeO
Fe2O3
Fe3O4
俗名
铁红
磁性氧化铁
颜色状态
黑色
粉末
红棕色
粉末
黑色晶体
(有磁性)
溶解性
难溶于水
难溶于水
难溶于水
铁的化
合价
+2
+3
+2,+3
稳定性
不稳定
稳定
稳定
与H+反
应的离子
方程式
FeO+2H+
===Fe2+
+H2O
Fe2O3+6H+
===2Fe3+
+3H2O
Fe3O4+8H+
===Fe2++
2Fe3++4H2O
四、铁的氢氧化物
化学式
Fe(OH)2
Fe(OH)3
色态
白色固体
红褐色固体
与盐酸反应的
离子方程式
Fe(OH)2+2H+
===Fe2++2H2O
Fe(OH)3+3H+
===Fe3++3H2O
受热分解
2Fe(OH)3
Fe2O3+3H2O
制法
可溶性亚铁盐与碱溶液反应:Fe2++2OH-===Fe(OH)2↓
可溶性铁盐与碱溶液反应:Fe3++3OH-===Fe(OH)3↓
二者的关系
空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,现象是白色沉淀迅速变成灰绿色,最后变成红褐色,化学方程式为4Fe(OH)2+O2+2H2O=== 4Fe(OH)3
[自我检测]
1.判断正误,正确的打“√”,错误的打“×”。
(1)铁位于元素周期表中第4周期第ⅧB族。( )
(2)用铁制容器可以运输浓硝酸和浓硫酸。( )
(3)将一定量的铁、铜的混合物加入到100 mL 0.1 mol·L-1的FeCl3溶液中,充分反应后,溶液中有固体剩余,则剩余的固体中一定含有铜,可能含有铁。( )
(4)Fe分别与氯气和盐酸反应所得氯化物相同。( )
(5)氢氧化铁与HI溶液仅发生中和反应。( )
答案:(1)× (2)√ (3)√ (4)× (5)×
2.将下列物质的颜色和用途或性质用短线连接起来。
A.具有较强的还原性
(1)Fe2O3 a.红褐色 B.易被氧化成灰绿色,
(2)Fe(OH)2 b.红棕色 最终变成红褐色
(3)Fe(OH)3 c.白色 C.制作红色油漆、涂料
(4)Fe2+ d.棕黄色 D.受热分解成红棕色粉末
(5)Fe3+ e.浅绿色 E.具有较强的氧化性
答案:(1)-b-C (2)-c-B (3)-a-D (4)-e-A
(5)-d-E
Fe3O4中2个Fe为+3价,1个Fe为+2价,可表示为FeO·Fe2O3,平均价态为+价。在发生氧化还原反应时,对应价态的铁参与相关反应,如Fe3O4与HNO3反应时只有+2价铁被氧化。
(2015·高考全国卷Ⅰ改编,10,6分)下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项
实验
现象
结论
A
将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液
有气体生成,溶液呈血红色
稀硝酸将Fe氧化为Fe3+
B
将铜粉加入1.0 mol·L-1 Fe2(SO4)3溶液中
溶液变蓝、有黑色固体出现
金属铁比铜活泼
C
向FeCl3、CuCl2的混合溶液中加入铁粉,充分反应
溶液中有固体存在
溶液中一定含有Cu2+
D
相同质量、相同表面积的纯铁和生铁分别与相同浓度的盐酸反应
生铁的反应速率比纯铁快
原电池反应能加快化学反应速率
[解析] A.稀硝酸与过量铁粉发生的反应分两步进行,先发生反应:Fe+4HNO3(稀)===Fe(NO3)3+NO↑+2H2O,过量的铁粉再与Fe(NO3)3发生反应:Fe+2Fe(NO3)3===3Fe(NO3)2,充分反应后滴加KSCN溶液,溶液不会变为血红色,实验现象错误,故A不正确。B.铜粉与Fe2(SO4)3溶液发生反应:Cu+Fe2(SO4)3===CuSO4+2FeSO4,实验现象为溶液变蓝色,但是没有黑色固体出现,该实验能说明Fe3+的氧化性比Cu2+强,不能说明金属铁比铜活泼,因为铁没有置换出铜单质,故B不正确。C.Fe3+的氧化性比Cu2+的氧化性强,Fe先与Fe3+反应生成Fe2+,再与Cu2+反应生成单质Cu。固体一定含Cu,可能含Fe;溶液中一定含Fe2+,可能含Cu2+,故C不正确。D.纯铁和稀盐酸不能构成原电池,生铁中铁、碳、盐酸构成原电池,能加快反应速率,所以生铁反应速率比纯铁快,故D正确。
[答案] D
下列物质反应后一定有+3价铁生成的是________。
①过量的Fe与Cl2加热时发生反应 ②Fe与过量稀H2SO4反应后,再向其中加KNO3 ③Fe与过量的S加热时发生反应 ④Fe(NO3)2溶液中加少量盐酸 ⑤Fe和Fe2O3的混合物溶于盐酸中
解析:Fe与Cl2反应只生成FeCl3;FeFe2+Fe3+;Fe与S反应只生成FeS;Fe2+Fe3+;Fe2O3溶于盐酸生成Fe3+,当混合物中Fe不足时,溶液中仍有Fe3+,当Fe足量时,溶液中无Fe3+。
答案:①②④
分析铁的化合物时的“两分清”
1.价态要分清
(1)要注意单质铁被不同氧化剂氧化时,产物不同。
(2)要注意不同价态的化合物所表现的不同的化学性质,如Fe3+以氧化性为主,Fe2+以还原性为主。
2.颜色要分清
铁的化合物“五颜六色”,一定要记牢:Fe2+溶液为浅绿色,Fe3+溶液为棕黄色,Fe(SCN)3溶液为血红色,Fe(OH)3胶体为红褐色,Fe(OH)2沉淀在空气中的颜色变化为白色→灰绿色→红褐色,Fe(OH)3沉淀为红褐色固体,Fe2O3为红棕色,Fe3O4、FeO、FeS均为黑色。
题组一 铁及其化合物的性质
1.下列叙述正确的是( )
A.Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应
B.足量的Fe在Cl2中燃烧生成FeCl2和FeCl3
C.Fe和Fe2O3等物质的量混合物溶于稀盐酸时无气体放出
D.Fe2O3FeCl3(aq)无水FeCl3,在给定的条件下能实现转化
解析:选C。HNO3具有强氧化性,与Fe发生氧化还原反应,产生的气体为NO,A项错;铁与Cl2反应无论量的多少产物都是FeCl3,B项错;C项中Fe2O3溶解产生Fe3+恰好将铁单质氧化,因而不能置换出H2,正确;FeCl3溶液加热时易水解,D项错。
2.铁屑溶于过量稀硫酸,过滤后向滤液中加入过量氨水,有白色沉淀生成,过滤,在空气中加热沉淀至质量不再发生变化为止,得到红棕色残渣,上述沉淀和残渣分别是( )
A.Fe(OH)3 Fe2O3 B.Fe(OH)2 Fe2O3
C.Fe(OH)2 Fe(OH)3 D.Fe(OH)2 Fe3O4
解析:选B。铁与稀硫酸反应生成FeSO4,再与过量氨水反应生成白色沉淀Fe(OH)2,在空气中加热Fe(OH)2,铁元素被氧化为+3价,最后所得红棕色残渣为Fe2O3。
题组二 有关铁及其化合物的实验探究
3.下列关于FeCl3进行的实验,预测正确的是( )
选项
实验
预测
A
蒸发FeCl3溶液
得到FeCl3固体
B
在FeCl3、CuCl2混合液中,加入少量Fe粉
一定有H2产生且有Cu析出
C
用FeCl3固体溶于水配制饱和溶液
会有Fe(OH)3沉淀产生
D
在FeCl3溶液中加入KHCO3溶液
有CO2产生,但无
Fe(OH)3沉淀生成
解析:选C。蒸发FeCl3溶液可促进Fe3+水解,由于HCl易挥发,最后得到Fe(OH)3,A错;混合液中加入Fe粉时,不会有H2产生且Fe应先和Fe3+反应,再与Cu2+反应,B错;FeCl3易水解生成Fe(OH)3沉淀,C对;Fe3+与HCO发生水解相互促进的反应,有CO2和Fe(OH)3沉淀生成,D错。
4.用下列方法可制得白色的Fe(OH)2沉淀:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入__________。
(2)除去蒸馏水中溶解的O2常采用________的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是__________________________。
(4)下列各图示中,能较长时间观察到Fe(OH)2白色沉淀的是________。
解析:(1)Fe2+易水解,要加入稀硫酸防止其水解;Fe2+易被空气中的O2氧化,要加Fe粉防止Fe2+被氧化。(2)气体的溶解度随温度升高而降低,所以煮沸后的水中溶解的O2较少。(4)因为Fe(OH)2在空气中很容易被氧化为红褐色的Fe(OH)3,即发生4Fe(OH)2+O2+2H2O===4Fe(OH)3。因此要较长时间看到Fe(OH)2白色沉淀,就要排除装置中的氧气或空气。①、②原理相同,都是先用氢气将装置中的空气排尽,并使生成的Fe(OH)2处在氢气的保护中;③的原理为铁作阳极产生Fe2+,与电解水产生的OH-结合生成 Fe(OH)2,且液面用汽油保护,能防止空气进入;⑤中液面加苯阻止了空气进入;④由于带入空气中的氧气,能迅速将Fe(OH)2氧化,因而不能较长时间观察到白色沉淀。
答案:(1)稀硫酸、铁屑
(2)煮沸
(3)避免生成的Fe(OH)2沉淀接触O2
(4)①②③⑤
制备Fe(OH)2的关键与方法
由于Fe(OH)2具有很强的还原性,易被氧化为Fe(OH)3,在实验室中制备Fe(OH)2,并使Fe(OH)2长时间保持白色沉淀状态,成为物质制备实验探究的热点。
制备原理:Fe2++2OH-===Fe(OH)2↓。
(1)成功关键
①溶液中不含Fe3+和O2等氧化性物质;
②制备过程中,保证生成的Fe(OH)2在密闭的隔绝空气的体系中。
(2)制备Fe(OH)2时常采用的方法
①采用新制备的纯亚铁盐溶液(Fe2+易被空气中的氧气氧化成Fe3+);
②将溶解亚铁盐的蒸馏水煮沸(除去溶解的氧气);
③将碱直接加到亚铁盐溶液的底部[使生成的Fe(OH)2与空气隔离];
④在亚铁盐溶液的液面上加隔氧剂(如加入苯等密度比水小而又不溶于水的有机溶剂)。
Fe2+和Fe3+的性质及其检验方法
[知识梳理]
1.Fe2+、Fe3+的性质及相互转化
(1)Fe2+的氧化性和还原性
Fe2+处于铁的中间价态,既有氧化性,又有还原性。在中学阶段接触Fe2+的氧化还原反应中其主要表现还原性,如Fe2+遇Br2、Cl2、H2O2、NO(H+)等均表现还原性。
(2)Fe3+的氧化性
Fe3+处于铁的高价态,表现较强的氧化性,如它能氧化Fe、Cu、HI、H2S等。
(3)Fe2+与Fe3+的相互转化
用离子方程式表示下列转化:
Fe2+Fe3+
①2Fe2++Cl2===2Fe3++2Cl-;
②3Fe2++4H++NO===3Fe3++2H2O+NO↑;
③2Fe3++Fe===3Fe2+;
④Cu+2Fe3+===Cu2++2Fe2+。
2.Fe2+、Fe3+的检验
(1)Fe2+的检验
①取出少量被检验的溶液,滴加KSCN溶液,无现象,再通入Cl2,若变成血红色溶液,说明有Fe2+存在(验证时不能先通氯气)。
反应方程式:2Fe2++Cl2===2Fe3++2Cl-,Fe3++3SCN-===Fe(SCN)3(血红色)。
②取出少量被检验的溶液,加入NaOH溶液,产生白色絮状沉淀,白色絮状沉淀迅速变成灰绿色,最终变为红褐色,证明有Fe2+存在。
反应方程式:Fe2++2OH-===Fe(OH)2↓(白色沉淀),
4Fe(OH)2+O2+2H2O===4Fe(OH)3(红褐色沉淀)。
(2)Fe3+的检验
①取出少量被检验的溶液,加入KSCN溶液,溶液呈血红色,证明有Fe3+存在。
反应方程式:Fe3++3SCN-===Fe(SCN)3(血红色)。
②取出少量被检验的溶液,加入NaOH溶液,产生红褐色沉淀,证明有Fe3+存在。
反应方程式:Fe3++3OH-===Fe(OH)3↓(红褐色沉淀)。
[自我检测]
1.为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,其中实验方案设计错误的是________。
解析:③CuSO4与FeCl3不反应;④生成AgCl白色沉淀,与Fe3+无关。
答案:③④
2.如何除去括号中的杂质:
(1)Fe2+(Fe3+):________________;
(2)FeCl3(FeCl2):________________;
(3)FeCl2(CuCl2):________________;
(4)Fe(Al):________________;
(5)Fe2O3(Al2O3、SiO2):________________。
答案:(1)加过量铁粉,过滤 (2)加氯水(或H2O2)
(3)加过量铁粉,过滤 (4)加过量强碱溶液,过滤
(5)加过量强碱溶液,过滤
检验Fe2+和Fe3+时的注意事项
(1)检验Fe2+时不能先加氯水后加KSCN溶液,也不能将加KSCN后的混合溶液加入到足量的新制氯水中(新制氯水可以氧化SCN-)。
(2)当溶液浓度较稀时,利用观察法或加NaOH溶液的方法都不宜检验Fe2+和Fe3+的存在。
(3)Fe3+、Fe2+、Cl-同时存在时不能用酸性KMnO4溶液检验Fe2+(Cl-能还原酸性KMnO4,有干扰)。
(4)检验Fe2+、Fe3+的其他方法
①检验Fe2+最好、最灵敏的试剂是铁氰化钾K3[Fe(CN)6]:3Fe2++2[Fe(CN)6]3-===Fe3[Fe(CN)6]2↓(蓝色)。
②检验Fe3+也可用苯酚(C6H5OH),在FeCl3溶液中滴加苯酚,溶液显紫色。
(2016·高考全国卷Ⅱ,28,15分)某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol/L的溶液。在FeCl2溶液中需加入少量铁屑,其目的是_______________________________。
(2)甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为______________________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是________________________。
(4)丙组同学取10 mL 0.1 mol/L KI溶液,加入6 mL 0.1 mol/L FeCl3溶液混合。分别取2 mL此溶液于3支试管中进行如下实验:
①第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是________(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有________(填离子符号),由此可以证明该氧化还原反应为________________。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为______________________________________________;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是_________;生成沉淀的原因是______________________ (用平衡移动原理解释)。
[解析] (1)Fe2+具有还原性,FeCl2溶液易被氧化而变质,配制FeCl2溶液时加入少量铁屑,目的是防止Fe2+被氧化。(2)溶液变红,说明有Fe3+生成,则FeCl2溶液与氯水反应生成FeCl3,离子方程式为2Fe2++Cl2===2Fe3++2Cl-。(3)甲组实验中,FeCl2易被空气中的O2氧化,会生成FeCl3,因此实验不够严谨。加入煤油,煤油的密度比水小,可以起到隔绝空气的作用,从而排除氧气对实验的影响。(4)实验②中K3[Fe(CN)6]溶液的作用是检验Fe2+。根据实验①,CCl4层显紫色,说明有I2生成,根据实验②,生成蓝色沉淀,说明有Fe2+生成,根据实验③,溶液变红,说明有Fe3+剩余,I-过量的情况下,溶液中仍含有Fe3+,由此说明该反应为可逆反应。(5)溶液变为棕黄色,说明生成了Fe3+,离子方程式为2Fe2++H2O2+2H+===2Fe3++2H2O。溶液中有气泡出现,说明H2O2在Fe3+的催化作用下发生了分解反应,生成了O2。随后生成红褐色沉淀,则沉淀为Fe(OH)3,H2O2分解放出热量,Fe3+的水解平衡Fe3++3H2OFe(OH)3+3H+向正反应方向不断进行,因此得到Fe(OH)3沉淀。
[答案] (1)防止Fe2+被氧化
(2)2Fe2++Cl2===2Fe3++2Cl-
(3)隔绝空气(排除氧气对实验的影响)
(4)Fe2+ Fe3+ 可逆反应
(5)2Fe2++H2O2+2H+===2Fe3++2H2O Fe3+催化H2O2分解产生O2 H2O2分解反应放热,促进Fe3+的水解平衡正向移动
(2015·高考上海卷)检验用硫酸亚铁制得的硫酸铁中是否含有硫酸亚铁,可使用的试剂是( )
A.NaOH B.KMnO4
C.KSCN D.
解析:选B。A.若加入NaOH,硫酸亚铁发生反应产生的白色Fe(OH)2会被硫酸铁发生反应产生的红褐色的Fe(OH)3遮挡,不容易观察到,因此不能检验,错误。B.KMnO4有氧化性,硫酸亚铁有还原性,会发生氧化还原反应,使KMnO4的紫色褪去,而硫酸铁不能与KMnO4发生反应,因此可以作为检验试剂,正确。C.KSCN与硫酸铁会发生反应,使溶液变血红色,而硫酸亚铁不能反应,因此无论硫酸亚铁是否存在,溶液都变血红色,因此无法检验,错误。D.苯酚与硫酸铁溶液发生显色反应,使溶液变为紫色,而与硫酸亚铁不能发生反应,无论硫酸亚铁是否存在,溶液都变紫色,所以不能作为检验试剂,错误。
题组一 Fe2+、Fe3+的性质及相互转化
1.在含有Fe3+、Fe2+、Al3+、NH的稀溶液中加入足量Na2O2固体,充分作用后,再加入过量稀盐酸,完全反应,则离子数目没有变化的是( )
A.Fe3+、Al3+ B.Al3+
C.Fe2+、NH D.Fe3+
解析:选B。2Na2O2+2H2O===4NaOH+O2↑,Fe2+转变为Fe3+,Fe3+转变为Fe(OH)3沉淀析出,Al3+转变为AlO,NH转变为NH3气体,NH减少。没有过滤,再加入过量稀盐酸,Fe(OH)3沉淀转变为Fe3+,所以Fe2+减少,Fe3+增多,AlO再转变为Al3+,几乎不变。
2.下列除杂的操作不正确的是( )
A.MgCl2溶液中混有少量FeCl3:加入足量MgO充分反应后过滤
B.FeCl2溶液中混有少量FeCl3:加入过量铁粉充分反应后过滤
C.CuCl2溶液中混有少量FeCl3:加入NaOH溶液充分反应后过滤
D.CuCl2溶液中混有少量FeCl2:先加入H2O2将Fe2+氧化成Fe3+,再加入CuO充分反应后过滤
解析:选C。FeCl3溶液中存在水解平衡:FeCl3+3H2OFe(OH)3+3HCl,加入MgO与H+反应,上述平衡右移,使Fe3+转化成Fe(OH)3而除去,A正确;加入过量铁粉,FeCl3与Fe反应生成FeCl2而达到除杂的目的,B正确;先用H2O2将Fe2+氧化成Fe3+,再利用FeCl3的水解,加入CuO与H+反应,将Fe3+转化成Fe(OH)3而除去,D正确;C项中加入NaOH溶液,Cu2+、Fe3+均转化成氢氧化物沉淀,不符合除杂要求。
题组二 Fe2+、Fe3+的检验
3.下列离子的检验方法合理的是( )
A.向某溶液中滴入KSCN溶液,溶液呈血红色,说明原溶液中不含Fe2+
B.向某溶液中通入Cl2,然后再加入KSCN溶液,溶液变血红色,说明原溶液中含有Fe2+
C.向某溶液中加入NaOH溶液,得红褐色沉淀,说明原溶液中含有Fe3+
D.向某溶液中加入NaOH溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明该溶液中只含有Fe2+,不含有Mg2+
解析:选C。A.原溶液呈血红色,说明含Fe3+,无法判断是否含有Fe2+;B.原溶液 呈血红色,说明反应后溶液中含Fe3+,但Cl2有氧化性,无法判断原溶液中是含有Fe2+还是含有Fe3+;C.原溶液红褐色沉淀,说明原溶液中含有Fe3+;D.原溶液白色沉淀―→红褐色沉淀,说明原溶液中含有Fe2+,但由于红褐色的掩盖,无法说明是否含有Mg2+。
4.工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:
(1)气体A中的大气污染物可选用下列试剂中的________吸收。
a.浓H2SO4 b.稀HNO3
c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈血红色,说明溶液中存在________(填离子符号),检验溶液中还存在Fe2+的方法是______________________ (注明试剂、现象)。
解析:(1)冰铜(mCu2S·nFeS)加入石英砂并通入空气焙烧生成泡铜(Cu2O、Cu)、熔渣和SO2气体(A)。SO2是一种酸性氧化物,可用NaOH溶液或氨水吸收。(2)溶液中滴加KSCN溶液呈血红色,说明含有Fe3+。可利用Fe2+的还原性来检验溶液中是否存在Fe2+,加入酸性KMnO4溶液,酸性KMnO4溶液褪色,说明还存在Fe2+。
答案:(1)cd (2)Fe3+ 另取少量溶液,滴加酸性KMnO4溶液,酸性KMnO4溶液褪色,说明还存在Fe2+
1.含Fe3+、Fe2+的混合溶液中Fe3+、Fe2+的检验
(1)Fe3+的检验
溶液变血红色,说明含有Fe3+
试纸变蓝色,说明含有Fe3+
(2)Fe2+的检验
KMnO4溶液紫红色褪去,说明含有Fe2+
溴水褪色,说明含有Fe2+
2.Fe2+、Fe3+性质的应用
(1)判断离子共存
①Fe3+与I-、S2-、SO因发生氧化还原反应而不能大量共存。
②Fe2+与ClO-、MnO、NO(H+)等离子因发生氧化还原反应而不能大量共存。
(2)盐溶液的配制与保存
①Fe2+的盐溶液:加少量铁粉,防止Fe2+被氧化;加少量相应的酸,抑制Fe2+水解。
②Fe3+的盐溶液:加少量相应的酸抑制Fe3+水解。
铜及其化合物的性质
[知识梳理]
1.单质铜
(1)物理性质:紫红色固体,具有良好的延展性、导热性和导电性。
(2)化学性质
写出图中有关反应的化学方程式或离子方程式:
①2Cu+O2+CO2+H2O===Cu2(OH)2CO3(绿色固体)。
②2Cu+SCu2S。
③与氧化性酸反应
a.与浓硫酸共热的化学方程式:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O;
b.与稀硝酸反应的离子方程式:3Cu+8H++2NO===3Cu2++2NO↑+4H2O。
④与盐溶液反应(写离子方程式)
a.与硝酸银溶液:Cu+2Ag+===2Ag+Cu2+;
b.与FeCl3溶液:Cu+2Fe3+===2Fe2++Cu2+。
2.氧化铜和氧化亚铜
名称
氧化铜
氧化亚铜
颜色
黑色
砖红色
与酸反
应(H+)
CuO+2H+===
Cu2++H2O
Cu2O+2H+===
Cu2++Cu+H2O
与H2反应
CuO+H2
Cu+H2O
Cu2O+H2
2Cu+H2O
转化关系
4CuO2Cu2O+O2↑
3.氢氧化铜
(1)物理性质:蓝色不溶于水的固体。
(2)化学性质及应用
4.CuSO4·5H2O
CuSO4·5H2O为蓝色晶体,俗称蓝矾、胆矾。无水CuSO4为白色粉末,遇水变蓝色(生成CuSO4·5H2O),可作为检验水的依据。
[自我检测]
1.波尔多液是一种农业上应用广泛的杀菌剂,它是由硫酸铜、生石灰和水按一定比例配成的天蓝色胶状悬浊液,思考下列问题:
(1)波尔多液能否用铁桶盛放?为什么?
(2)波尔多液能杀菌的原因是什么?
答案:(1)不能。原因是铁能置换波尔多液中的Cu2+,降低杀菌能力。
(2)CuSO4是重金属盐,能使蛋白质变性。
2.把铜及其化合物的化学式与其颜色连接起来。
答案:
(1)通常利用反应:2Cu+O22CuO除去混合气体中的少量O2或用于测定混合气体中O2的含量。
(2)无水CuSO4常用作水的检验剂;由于其吸水效率低,一般不用作干燥剂。
(3)铜可在O2和H+共存环境中逐渐溶解,如2Cu+O2+2H2SO4===2CuSO4+2H2O。
(4)溶液中的Cu2+常为蓝色(浓CuCl2溶液为蓝绿色,稀CuCl2溶液为蓝色),可作为Cu2+的判定依据,如CuSO4溶液呈蓝色。
(5)Cu2+与碱反应生成蓝色沉淀Cu(OH)2,这是鉴定Cu2+的原理之一。
为了比较铁和铜的金属活动性强弱,某化学研究小组的同学设计了如下方案,并将实验结果记录如下:
方案
现象或产物
①将铁片置于CuSO4溶液中
铁片上有亮红色物质析出
②将铁丝和铜丝分别在氯气中燃烧
产物分别为FeCl3和CuCl2
③将铁片和铜片分别放入热的浓硫酸中
产物分别为Fe2(SO4)3和CuSO4
④将铁片和铜片分别放入稀硫酸中
铁片上有气泡逸出,铜片上没有气泡逸出
⑤将铁片和铜片同时插入盛有稀硫酸的烧杯中,并用导线连接
铁片逐渐溶解,铜片上有气泡逸出
能根据上述现象或产物证明铁的金属活动性比铜强的方案一共有( )
A.2种 B.3种
C.4种 D.5种
[解析] ①铁能置换出铜,可证明铁比铜活泼;④铁能置换出稀硫酸中的氢,而铜不能,可证明铁比铜活泼;⑤铁、铜、稀硫酸形成原电池,铁作负极,铜作正极,可证明铁比铜活泼,共有3种方案符合题意,选项B正确。
[答案] B
(1)已知2FeCl3+Cu===2FeCl2+CuCl2,上述反应能否证明铁比铜活泼?
(2)向FeCl3、CuCl2、FeCl2混合液中插入锌棒,金属阳离子先后发生反应的顺序怎样?
答案:(1)不能。只证明氧化性:Fe3+>Cu2+,还原性:Cu>Fe2+。
(2)先后发生反应的顺序为Fe3+、Cu2+、Fe2+。
题组一 铜及其化合物的性质
1.现有下列五个转化,其中不能通过一步反应实现的是( )
①SiO2―→Na2SiO3
②CuSO4―→CuCl2
③SiO2―→H2SiO3
④CuO―→Cu(OH)2
⑤Na2O2―→Na2SO4
A.①② B.③④
C.②③④ D.②③④⑤
解析:选B。①SiO2+2NaOH===Na2SiO3+H2O;②CuSO4+BaCl2===BaSO4↓+CuCl2;③SiO2不溶于水,不能一步生成H2SiO3;④CuO不溶于水,不能一步生成Cu(OH)2;⑤Na2O2+SO2===Na2SO4。
2.下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是( )
选项
陈述Ⅰ
陈述Ⅱ
判断
A
铜绿的主要成分是碱式碳酸铜
可用稀盐酸除铜器表面的铜绿
Ⅰ对;Ⅱ对;无
B
铜表面易形成致密的氧化膜
铜容器可以盛放浓硫酸
Ⅰ对;Ⅱ对;有
C
向硫酸铜溶液通入氨气,有深蓝色沉淀产生,过滤后灼烧滤渣,最后变成黑色固体
把铜丝放在酒精灯火焰上灼烧,铜丝表面变黑
Ⅰ对;Ⅱ对;有
D
蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化
硫酸铜溶液可用作游泳池的消毒剂
Ⅰ错;Ⅱ对;无
解析:选D。稀盐酸可以与Cu2(OH)2CO3反应,而不能与Cu反应,所以可用稀盐酸除铜器表面的铜绿Cu2(OH)2CO3,Ⅰ、Ⅱ有因果关系,A错误;铜表面不能形成致密的氧化膜,铜与浓硫酸在一定温度下能发生反应,所以不能用铜制容器盛装浓硫酸,B错误;硫酸铜与氨水生成Cu(OH)2,Cu(OH)2受热分解生成黑色CuO,Ⅰ、Ⅱ均正确,但没有因果关系,C错误;蓝色硫酸铜晶体受热转化为白色硫酸铜粉末有新物质生成,属于化学变化,CuSO4可用作消毒剂,但与前者没有因果关系,D正确。
题组二 铜及其化合物的制备
3.孔雀石的主要成分为Cu2(OH)2CO3。某同学设计的从孔雀石中冶炼铜的方案如下(假设孔雀石中杂质不溶于水和稀硫酸):
(1)反应①能观察到的现象是_____________________,
有关反应的化学方程式为_______________________________。
(2)反应②加入的金属可能是________,有关反应的离子方程式为___________________。
(3)操作a可能的方法是________,欲除掉的杂质为________________________;要从操作a所得到的溶液中得到溶质的晶体,需要进行的操作是________________________。
解析:(1)孔雀石中加入稀硫酸可看到孔雀石逐渐溶解,溶液由无色变为蓝色,且有气泡产生;反应的化学方程式为Cu2(OH)2CO3+2H2SO4===2CuSO4+CO2↑+3H2O。(2)~(3)经过滤除去难溶于水和稀硫酸的杂质,则滤液中主要含有CuSO4,加入的金属粉末能将Cu2+从溶液中置换出来即可,故金属可能是Fe或Zn等;要从滤液中得到CuSO4晶体,需进行加热浓缩、冷却结晶等操作。
答案:(1)固体逐渐消失,溶液由无色变为蓝色,有气泡产生
Cu2(OH)2CO3+2H2SO4===2CuSO4+CO2↑+3H2O
(2)铁粉 Fe+Cu2+===Fe2++Cu(答案合理即可)
(3)过滤 难溶于水和稀硫酸的杂质 加热浓缩、冷却结晶
4.某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应精制CuO,其设计的实验过程为
(1)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,灼烧后含有少量铜的可能原因是________。
A.灼烧过程中部分氧化铜被还原
B.灼烧不充分铜未被完全氧化
C.氧化铜在加热过程中分解生成铜
D.该条件下铜无法被氧气氧化
(2)由粗制氧化铜通过两种途径制取纯净CuO,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是________________________________________________________________________
________________________________________________________________________。
(3)有同学指出,由CuSO4溶液到生成CuO少了一个环节,即应先生成Cu(OH)2沉淀,过滤洗涤后再加热分解Cu(OH)2得CuO。以下说法不可能成为减少该环节的理由的是________。
A.CuO比Cu(OH)2颗粒粗大,更易于过滤从溶液中分离
B.Cu(OH)2分解温度较低,加热其浊液即可使其分解
C.干态下分解Cu(OH)2,温度难以控制,可能因温度过高导致CuO进一步分解生成Cu2O
D.过滤分离出的CuO不需洗涤就已非常纯净
答案:(1)AB (2)耗酸少,无污染性气体SO2产生 (3)D
铜的冶炼“三方法”
(1)湿法炼铜:Fe+CuSO4===FeSO4+Cu。
(2)高温炼铜:工业上用高温冶炼黄铜矿的方法获得铜(粗铜):
2CuFeS2+4O2Cu2S+3SO2+2FeO(炉渣)
2Cu2S+3O22Cu2O+2SO2
2Cu2O+Cu2S6Cu+SO2↑
粗铜中铜的含量为99.5%~99.7%,主要含有Ag、Zn、Fe、Au等杂质,粗铜通过电解精炼可得到纯度达99.95%~99.98%的铜。
电解精炼铜的原理是用粗铜作阳极,失电子变为Cu2+,用纯铜棒作阴极即可得到精铜。
(3)生物炼铜:“吃岩石的细菌”能耐受铜盐的毒性,并能利用空气中的氧气氧化硫化铜矿石,然后把不溶性的硫化铜转化为可溶性的硫酸铜。
生物炼铜的优点:①成本低;②污染小;③反应条件简单;④含量(品位)很低的矿石也可以被利用。
[课后达标检测]
一、选择题
1.唐代中药学著作《新修本草》中,有关于“青矾”的记录为“本来绿色,新出窟未见风者,正如琉璃……烧之赤色”。据此推测,“青矾”的主要成分为( )
A.CuSO4·5H2O
B.FeSO4·7H2O
C.KAl(SO4)2·12H2O
D.Fe2(SO4)3·9H2O
解析:选B。 “青矾”的描述为“本来绿色,新出窟未见风者,正如琉璃…烧之赤色”,青矾是绿色,经煅烧后,分解成粒度非常细而活性又很强的Fe2O3超细粉末,为红色。A中CuSO4·5H2O为蓝色晶体;B中FeSO4·7H2O是绿色晶体;C中KAl(SO4)2·12H2O是无色晶体;D中Fe2(SO4)3·9H2O为黄色晶体,所以判断“青矾”的主要成分为FeSO4·7H2O。
2.下列关于铁及其化合物的说法中正确的是( )
A.氯化亚铁溶液保存时加少量盐酸,是为了防止其被氧化
B.将氯化铁溶液直接蒸干可得到无水氯化铁
C.通入氯气可除去硫酸铁中少量硫酸亚铁杂质
D.用磁铁吸引可分离铁粉和铜粉
解析:选D。A项加少量盐酸是为了抑制亚铁离子水解,错误;B项应该在HCl气流中蒸干,错误;C项通入氯气会引入新杂质Cl-,错误。
3.下列物质不能通过化合反应直接制得的是( )
A.FeCl2 B.NaHSO3
C.Cu(OH)2 D.Fe(OH)3
解析:选C。C项,氧化铜和水不能反应。D项,4Fe(OH)2+O2+2H2O===4Fe(OH)3。
4.(2018·沧州高三模拟)铁片投入下列溶液后,铁片质量减少,但无气体产生的是( )
A.冷浓HNO3 B.Cu(NO3)2溶液
C.稀硫酸 D.Fe(NO3)3溶液
解析:选D。Fe在冷浓硝酸中钝化,铁片质量增加;Fe和Cu(NO3)2反应,在Fe片上附有Cu,铁片质量增加;Fe和稀H2SO4反应有H2产生;Fe与Fe(NO3)3反应无气体放出,生成Fe(NO3)2,铁片质量减少。
5.在实验室里用铁屑、氧化铜、稀硫酸为原料制备铜,有下列两种途径:
(1)FeH2Cu;
(2)CuOCuSO4Cu。
若用这两种方法制得的铜质量相等,则下列有关说法符合实际情况的是( )
A.消耗氧化铜的质量不同
B.消耗铁的质量相同
C.消耗硫酸的质量相同
D.生成硫酸亚铁的质量不同
解析:选D。途径(1)中用H2还原CuO时,实验前需先通H2排出装置中的空气,实验结束时要继续通H2至试管冷却,故利用途径(1)制取1 mol Cu,消耗的H2大于 1 mol,即Fe和H2SO4的消耗量均为(1)>(2),生成FeSO4的质量(1)>(2),但两种途径中消耗CuO的质量相等。
6.下列各组物质中,X是主体物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的一组是( )
选项
A
B
C
D
X
FeCl2溶液
FeCl3溶液
Fe
FeSO4溶液
Y
FeCl3
CuCl2
Al
Fe2(SO4)3
Z
Cl2
Fe
NaOH溶液
Cu
解析:选C。Cl2与FeCl2反应,A错误;Fe与FeCl3、CuCl2均反应,B错误;D项有新的杂质CuSO4生成,D错误。
7.(2018·河北三市联考)化学美无处不在,如图是物质间发生化学反应的颜色变化,其中物质a、b、c、d对应的物质正确的是( )
选项
物质a
物质b
物质c
物质d
A
Cu2(OH)2CO3
Ba(OH)2
Fe(OH)3
酚酞试液
B
CuO
NaAlO2
Fe2O3
紫色石蕊试液
C
Cu2O
BaCl2
Fe2O3和Cu
酚酞试液
D
Cu(OH)2
Ba(NO3)2
Fe(OH)2
紫色石蕊试液
解析:选D。稀硫酸与Fe(OH)3、Fe2O3反应得到的Fe2(SO4)3溶液呈棕黄色,稀硫酸遇酚酞试液显无色,A、B、C项均错误;稀硫酸与Cu(OH)2反应得到的CuSO4溶液呈蓝色,稀硫酸与Ba(NO3)2反应得到的BaSO4是白色沉淀,稀硫酸与Fe(OH)2反应得到的FeSO4溶液呈浅绿色,稀硫酸遇紫色石蕊试液变红,D项正确。
8.将1.12 g铁粉加入25 mL 2 mol·L-1氯化铁溶液中,充分反应后,其结果是( )
A.铁有剩余,溶液呈浅绿色,Cl-浓度基本不变
B.向溶液中滴入无色KSCN溶液,显血红色
C.Fe2+和Fe3+的物质的量之比为5∶1
D.氧化产物与还原产物的物质的量之比为2∶5
解析:选B。n(Fe)==0.02 mol,n(Fe3+)=0.025 L×2 mol·L-1=0.05 mol,由反应:Fe+2Fe3+===3Fe2+可知Fe3+过量,加入KSCN显血红色,溶液中n(Fe2+)=3n(Fe)=0.06 mol,溶液中剩余n(Fe3+)=0.05 mol-2n(Fe)=0.01 mol,即Fe2+和Fe3+的物质的量之比为6∶1;氧化产物与还原产物的物质的量之比为1∶2。
9.通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是( )
选项
操作与现象
解释
A
向淀粉KI溶液中加入FeCl3溶液,溶液变蓝
Fe3+能与淀粉发生显色反应
B
把生铁放置于潮湿的空气中,铁表面有一层红棕色的斑点
铁在潮湿的空气中易生成Fe(OH)3
C
向稀硝酸中加入少量铁粉,有气泡产生
说明Fe置换出硝酸中的氢,生成了氢气
D
新制Fe(OH)2露置于空气中一段时间,白色物质变成了红褐色
说明Fe(OH)2易被O2氧化成Fe(OH)3
解析:选D。A项中Fe3+将I-氧化为I2,碘遇淀粉变蓝;B项中红棕色斑点是Fe2O3;C项中铁与稀硝酸反应产生的气体为NO。
10.下列说法中正确的个数为( )
①氢气通过灼热的CuO粉末反应后固体物质增重
②用CuCl2溶液做导电实验,灯泡发光是因为CuCl2Cu2++2Cl-
③Cu溶于稀HNO3的离子方程式:3Cu+8H++2NO===3Cu2++2NO↑+4H2O
④常温下,Cu既能与FeCl3溶液反应又能与浓硝酸反应
A.1 B.2
C.3 D.4
解析:选B。①中,CuO(s)―→Cu(s),固体物质质量减少,错误;②中,用CuCl2溶液做导电实验,实质是电解CuCl2溶液,其电解化学方程式为CuCl2Cu+Cl2↑,错误;③④正确。
11.在Fe(NO3)3和Cu(NO3)2的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示,则原混合溶液中Fe(NO3)3与Cu(NO3)2的物质的量浓度之比为( )
A.3∶1 B.1∶2
C.2∶1 D.1∶1
解析:选C。由离子方程式:2Fe3++Fe===3Fe2+、Fe+Cu2+===Fe2++Cu,结合图像可知,c(Fe2+)的大小范围在 0~3 mol·L-1变化快,3 mol·L-1是拐点,此前发生2Fe3++Fe===3Fe2+,在3~4 mol·L-1范围内变化时发生Fe+Cu2+===Fe2++Cu,两阶段消耗Fe的量相同。由化学方程式2Fe3++Fe===3Fe2+可得,n(Fe3+)=2n(Fe),由化学方程式Fe+Cu2+===Fe2++Cu可得,n(Cu2+)=n(Fe),故原溶液中c(Fe3+)∶c(Cu2+)=2∶1。
二、非选择题
12.根据下列转化关系,回答有关问题。
(1)浅绿色溶液D主要成分的化学式为________,试剂1是________。
(2)下列物质不能作为试剂2的是________(填序号)。
a.Cl2 b.新制氯水
c.浓硫酸 d.S
e.硝酸
(3)固体A溶于稀盐酸的化学方程式为____________________________________。
(4)溶液C到溶液F红色加深的原因是__________________。
(5)某同学在实验时向E中加入了过量的一种固体物质,发现棕黄色褪去,现对褪色原因进行探究。提出你的假设:____________________;为了对你所提出的假设进行验证,你设计的实验方案是___________________________________________________
________________________________________________________________________
________________________________________________________________________。
解析:从框图可知,Fe和稀盐酸反应生成FeCl2溶液,为浅绿色,即D的主要成分为FeCl2,加入试剂2后变为棕黄色溶液,联想最终变成深红色溶液F(硫氰化铁溶液),可以推断溶液E的主要成分为Fe3+,试剂2为强氧化剂,S不符合条件。Fe与H2O(g)反应生成固体Fe3O4,Fe3O4与盐酸反应的化学方程式为Fe3O4+8HCl===2FeCl3+FeCl2+4H2O,所以溶液B为FeCl3和FeCl2的混合溶液,加入试剂1(KSCN溶液)后,Fe3+变成Fe(SCN)3,加入试剂2(强氧化剂),Fe2+被氧化为Fe3+,并进一步转化为Fe(SCN)3,所以溶液红色加深。
答案:(1)FeCl2 KSCN溶液
(2)d (3)Fe3O4+8HCl===2FeCl3+FeCl2+4H2O
(4)溶液中的Fe2+被氧化剂氧化成Fe3+,使Fe3+浓度增大,从而生成更多的硫氰化铁使红色加深
(5)加入还原剂将Fe3+还原 用胶头滴管取少量棕黄色褪去后的溶液于试管中,滴加少量KSCN溶液,再加入几滴氯水。如果溶液开始不出现血红色,加氯水后出现血红色,则说明假设正确;若溶液不变血红色,则假设不正确
13.(2017·高考江苏卷)碱式氯化铜是重要的无机杀菌剂。碱式氯化铜有多种制备方法:
(1)方法1: 45~50 ℃时,向CuCl悬浊液中持续通入空气得到Cu2 (OH)2 Cl2·3H2O, 该反应的化学方程式为__________________________________。
(2)方法2: 先制得CuCl2,再与石灰乳反应生成碱式氯化铜。Cu与稀盐酸在持续通入空气的条件下反应生成CuCl2,Fe3+对该反应有催化作用,其催化原理如图所示。 M′的化学式为________________。
解析:(1)在H2O存在的条件下,CuCl能被空气中的O2氧化生成Cu2(OH)2Cl2·3H2O,根据得失电子守恒配平反应的化学方程式。
(2)由题图知,O2氧化M′生成M,根据题意“Fe3+对该反应有催化作用”,则M′为Fe2+。
答案:(1)4CuCl+O2+8H2O2Cu2(OH)2Cl2·3H2O
(2)Fe2+
14.Fe3O4是重要的化学试剂,铁粉在氧气中燃烧是制取它最为常见和快捷的方法。图1是制取四氧化三铁的系列装置,A装置用于制取二氧化碳气体,并要求气流稳定,流速可控。
请回答下列问题:
(1)图2中仪器a的名称是________。
(2)根据题目要求,在图2中最好选择________(填序号)作为A装置。
(3)对图2中装置①进行气密性检查的方法是______________________________________
____________________,向分液漏斗中加足量水,过一会,水不再下滴,说明装置①的气密性良好。
(4)在B装置中发生的主要反应的化学方程式是______________________。
(5)当产生的气体与事先预热的铁粉接触时,在硬质玻璃管中将观察到的明显现象是________________________________________________________________________。
(6)反应一段时间后,若将硬质玻璃管中的固体粉末用盐酸溶解,取少许溶液于试管中,加入淀粉KI溶液,没有蓝色出现,推测固体粉末中除Fe3O4外,一定有________________________________________________________________________。
(7)若铁粉被完全消耗,某同学为确定生成物中有+2价铁,取少量生成物于试管中,加入适量的稀硫酸溶解。
①写出溶解过程发生反应的离子方程式:_______________________________________
________________________________________________________________________。
②写出确定+2价铁所用试剂名称、操作步骤、实验现象和结论:__________
________________________________________________________________________。
解析:(1)图2中仪器a为长颈漏斗。(2)图2中三个装置只有③可以达到气流稳定、流速可控的目的。(3)检查装置①的气密性时需用止水夹夹住橡胶管,确保装置中密封住一定体积的气体。(4)B装置中Na2O2与CO2反应生成Na2CO3和O2。(5)在硬质玻璃管中铁粉与O2剧烈反应,并有火星产生。(6)加入淀粉KI溶液没有出现蓝色,说明溶液中没有Fe3+,即生成物中除了有Fe3O4外,还有铁粉剩余,Fe3O4溶于盐酸生成的Fe3+被Fe还原为Fe2+。(7)①Fe3O4溶于稀硫酸生成Fe3+和Fe2+,其离子方程式为Fe3O4+8H+===2Fe3++Fe2++4H2O。②检验溶液中含有Fe2+,可用K3[Fe(CN)6]溶液或酸性高锰酸钾溶液。
答案:(1)长颈漏斗 (2)③ (3)用止水夹夹紧橡胶管
(4)2Na2O2+2CO2===2Na2CO3+O2
(5)铁粉剧烈燃烧,火星四射 (6)铁粉 (7)①Fe3O4+8H+===2Fe3++Fe2++4H2O ②用小试管取少量溶液,向其中逐滴加入K3[Fe(CN)6]溶液,若出现蓝色沉淀,说明有+2价铁存在(或用小试管取少量酸性高锰酸钾溶液,滴入几滴题述溶液,若紫红色变浅,说明有+2价铁存在)
相关资料
更多








