

高中化学人教版 (2019)选择性必修1第一节 反应热第1课时综合训练题
展开一.选择题(共12小题)
1.下列说法中正确的是( )
①为加快KClO3的分解速率加入MnO2
②物质发生化学反应时都伴随着能量变化,伴随能量变化的物质变化也一定是化学变化
③燃烧时,液体燃料以雾状喷出可以提高燃料的燃烧效率
④因为3O2═2O3是吸热反应,所以臭氧比氧气的化学性质更活泼
⑤需要加热的化学反应一定是吸热反应,不需要加热就能进行的反应一定是放热反应
⑥为防止污染,在面粉厂、纺纱厂等场所要严禁烟火
A.①③④B.①⑤⑥C.②④⑥D.①②③④⑥
2.已知一定条件下化学反应A2(g)+B2(g)═2AB(g)的能量变化曲线如图所示,该条件下下列叙述中正确的是( )
A.每生成2ml A﹣B键时吸收bkJ热量
B.由A2(g)与B2(g)生成1ml AB(g)时吸收kJ的能量
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1ml A﹣A和1ml B﹣B键时放出akJ能量
3.下列反应中,生成物所储存的化学能比反应物所储存的化学能多的是( )
A.2Na2O2+2H2O═4NaOH+O2↑
B.NaOH+HCl═NaCl+H2O
C.CH4+2O2CO2+2H2O
D.Ba(OH)2•8H2O+2NH4Cl═BaCl2+2NH3↑+10H2O
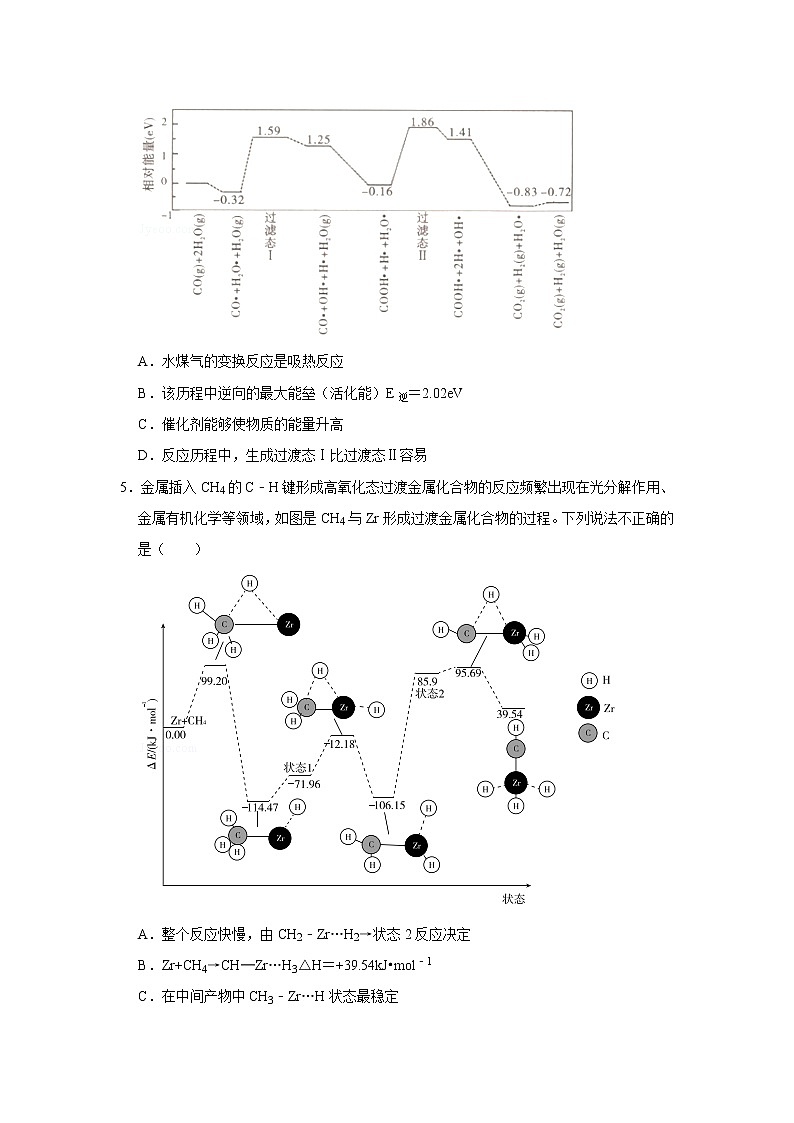
4.我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示(吸附在金催化剂表面上的物种用•标注)。下列说法正确的是( )
A.水煤气的变换反应是吸热反应
B.该历程中逆向的最大能垒(活化能)E逆=2.02eV
C.催化剂能够使物质的能量升高
D.反应历程中,生成过渡态Ⅰ比过渡态Ⅱ容易
5.金属插入CH4的C﹣H键形成高氧化态过渡金属化合物的反应频繁出现在光分解作用、金属有机化学等领域,如图是CH4与Zr形成过渡金属化合物的过程。下列说法不正确的是( )
A.整个反应快慢,由CH2﹣Zr…H2→状态2反应决定
B.Zr+CH4→CH─Zr…H3△H=+39.54kJ•ml﹣1
C.在中间产物中CH3﹣Zr…H状态最稳定
D.Zr+CH4→CH─Zr…H3活化能为201.84kJ•ml﹣1
6.工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)Si(s)+4HCl(g),有关化学键的键能数据如表所示,下列说法正确的是( )
A.反应中的能量变化与物质的状态无关
B.像这样需要加热才能进行的反应都是吸热反应
C.晶体硅比SiC更稳定
D.该反应中每生成1ml Si(s)吸收的能量为236kJ
7.下列叙述中正确的是( )
A.化学反应过程中,旧化学键断裂释放能量,新化学键形成吸收能量
B.常温下,强酸、强碱之间发生反应,每生成1ml水时所释放的能量大小均相等
C.放热反应在任何条件下都能自发进行
D.同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同
8.工业合成氨反应在催化剂表面的反应历程及能量变化如图所示,下列说法正确的是( )
A.合成氨的正、逆反应的焓变相同
B.若使用催化剂,生成等量的NH3需要的时间更短
C.在该过程中,N原子和H原子形成了含有非极性键的氨气分子
D.合成氨反应中,反应物断键吸收能量大于生成物形成新键释放的能量
9.A(g)+B(g)⇌C(g)+D(g)反应过程中的能量(单位:kJ•ml﹣1)变化如图所示,下列有关该反应的说法正确的是( )
A.正反应与逆反应的活化能相等
B.图中反应的焓变为△E,是吸热反应
C.一定条件下,1ml A(g)与1ml B(g)在密闭容器中充分反应,放出的热量等于△E
D.加入催化剂后△E、E1、E2均不变
10.298K时,N2(g)+3H2(g)⇌2NH3(g)△H;反应过程中能量变化曲线如图所示(两条曲线分别表示使用或不使用催化剂)。下列叙述错误的是( )
A.加入催化剂,不能提高N2的转化率
B.a曲线是加入催化剂时的能量变化曲线
C.△H=92kJ/ml
D.是否使用催化剂,△H的数值不受影响
11.下列说法正确的是( )
A.凡经加热而发生的化学反应都是吸热反应
B.已知C(金刚石)=C(石墨)为放热反应,则金刚石比石墨稳定
C.干冰升华时,二氧化碳分子中的共价键不发生断裂
D.伴有能量变化的物质变化,都是化学变化
12.下列说法正确的是( )
A.等质量的硫蒸气和硫固体分别与氧气完全燃烧,后者放出的热量多
B.放热反应在常温下一定很容易发生
C.由C(石墨,s)=C(金刚石,s)反应吸热可知,金刚石比石墨稳定
D.酒驾是一种极不负责任的危害社会的行为,利用测酒仪可以检测酒精含量,利用的是酒精的还原性
二.填空题(共3小题)
13.(1)从能量的变化和反应的快慢等角度研究反应:2H2(g)+O2(g)═2H2O(g)。已知该反应为放热反应,如图能正确表示该反应中能量变化的是 。
从断键和成键的角度分析上述反应中能量的变化,化学键的键能如表所示。则生成1ml H2O(g)可以放出热量 kJ。
(2)下列反应中,属于放热反应的是 ,属于吸热反应的是 。
a.盐酸与烧碱溶液反应
b.Ba(OH)2•8H2O+2NH4Cl═BaCl2+10H2O+2NH3↑
c.氢气在氧气中燃烧生成水
d.高温煅烧石灰石使其分解
e.铝和盐酸反应
f.葡萄糖在人体内氧化分解
14.化学反应可视为旧键断裂和新化学键形成的过程。化学键的键能是两个原子间形成1 ml化学键时释放的能量或断开1 ml化学键所吸收的能量。
现提供以下化学键的键能:(kJ•ml﹣1)P﹣P:198 P﹣O:360 O═O:498 P═O:585。
则P4(白磷)+5O2P4O10是 反应(填“放热”或“吸热”),能量变化为 kJ.(提示:白磷是正四面体形的分子,如图,当与氧形成P4O10时,每两个磷原子之间插入一个氧原子,此外,每个磷原子又以双键结合一个氧原子)
15.(1)如图一是碳和水蒸气发生反应生成CO、H2的途径和三个状态的能量,该反应为吸热反应,比较E1、E2、E3的大小: 。
(2)已知2ml氢气燃烧生成液态水时放出572kJ的热量,反应方程式是2H2(g)+O2(g)═2H2O(l)。请回答下列问题:
①该反应的生成物能量总和 (填“大于”、“小于”或“等于”)反应物能量总和。
②若2ml氢气完全燃烧生成水蒸气,则放出的热量 (填“大于”、“小于”或“等于”)572kJ。
(3)已知拆开1mlN﹣N键、1mlN﹣H键、1mlN≡N键、1mlO=O键需要的能量分别是3akJ、2.5akJ、8akJ、4akJ,完全燃烧1ml火箭燃料肼(N2H4)生成氮气和水蒸气放出能量为5akJ,则1ml H2O(g)完全断键时共吸收 kJ的能量。
(4)已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图二所示,反应物的总键能 (填“大于”、“小于”或“等于”)生成物的总键能。
答案解析
一.选择题
1.【分析】①MnO2为反应的催化剂;
②物理变化可伴随能量变化;
③燃烧时,液体燃料以雾状喷出,可增大表面积;
④能量越高越不稳定;
⑤反应热与反应条件无关;
⑥面粉厂、纺纱厂空中含有易燃的微粒。
【解答】解:①MnO2为反应的催化剂,可加快反应的速率,故正确;
②物理变化可伴随能量变化,如水的气化、固化等,故错误;
③燃烧时,液体燃料以雾状喷出,可增大表面积,可加快反应速率,故正确;
④因为3O2═2O3是吸热反应,则臭氧能量较高,臭氧比氧气的化学性质更活泼,故正确;
⑤反应中能量变化与反应条件无关,则需要加热的反应可能为吸热或放热反应,不需要加热的反应可能为吸热或放热反应,如铝热反应应在高温下进行,但为放热反应,氢氧化钡晶体与氯化铵在常温下就可进行,但为吸热反应,故错误;
⑥面粉厂、纺纱厂空中含有易燃的微粒,明火时以爆炸,与安全有关,与污染无关,故错误;
故选:A。
2.【分析】A、反应热△H=反应物能量总和﹣生成物能量总和;
B、反应中热量的变化和物质的量成正比,据此计算;
C、吸热反应就是反应物的总能量低于生成物的总能量,反之就是放热反应;
D、旧键的断裂要吸收能量。
【解答】解:A、反应热△H=反应物能量总和﹣生成物能量总和,所以反应热△H=+(a﹣b)kJ•ml﹣1,则每生成2mlA﹣B键时吸收(a﹣b) kJ热量,故A错误;
B、反应热△H=反应物能量总和﹣生成物能量总和,所以反应热△H=+(a﹣b)kJ•ml﹣1,生成2ml AB(g)时吸收(a﹣b)kJ的能量,则生成1ml AB(g)时吸收kJ的能量,故B正确;
C、由图象可知,该反应中反应物的总能量低于生成物的总能量,故C错误;
D、因旧键的断裂吸收能量,由图可知断裂1 ml A﹣A键和1 ml B﹣B键吸收a kJ能量,故D错误;
故选:B。
3.【分析】化学反应能量守恒,生成物所贮的化学能比反应物所贮化学能要多,说明该反应为吸热反应。
【解答】解:A.2Na2O2+2H2O═4NaOH+O2↑为放热反应,故A错误;
B.NaOH+HCl═NaCl+H2O为酸碱中和反应为放热反应,故B错误;
C.CH4+2O2CO2+2H2O为燃烧反应,属于放热反应,故C错误;
D.Ba(OH)2•8H2O+2NH4Cl═BaCl2+2NH3↑+10H2O为吸热反应,生成物所贮的化学能比反应物所贮化学能要多,故D正确;
故选:D。
4.【分析】A、图象分析可知水煤气的变换反应,最后生成产物的能量低于反应物;
B、该历程中最大能垒(活化能)E正=1.86eV﹣(﹣0.16eV)=2.02eV;
C、催化剂能够降低反应的活化能,根据图象分析解答;
D、生成过程经过了过渡态1和过渡态2,据此看图分析解答。
【解答】解:A、图象分析可知水煤气的生成过程经过了过渡态1和过渡态2,最后生成产物的能量低于反应物,反应是放热反应,故A错误;
B、图象分析可知,该历程中最大能垒(活化能)E正=1.86eV﹣(﹣0.16eV)=2.02eV,E逆=1.41eV﹣(﹣0.83eV)=2.24eV,故B错误;
C、催化剂,能改变反应的活化能,不能够改变物质的能量,故C错误;
D、结合图分析判断,生成过渡态Ⅰ的能垒比过渡态Ⅱ小,故反应容易,故D正确;
故选:D。
5.【分析】A、反应速率取决于反应活化能的大小,活化能越大反应速率越小;
B、焓变△H=生成物的内能﹣反应物的内能;
C、物质具有的内能越低,物质越稳定;
D、由图可知,Zr+CH4→CH─Zr…H3活化能为95.69kJ/ml。
【解答】解:A、反应速率取决于反应活化能的大小,活化能越大的那步反应的反应速率越小,整个反应的反应速率由其决定,由图可知,CH2﹣Zr…H2→状态2反应的活化能最大,反应速率最慢,所以整个反应快慢,由CH2﹣Zr…H2→状态2反应决定,故A正确;
B、由图可知,Zr+CH4→CH─Zr…H3的△H=39.54kJ/ml﹣0.00kJ/ml═+39.54kJ/ml,故B正确;
C、由图可知,CH3﹣Zr…H状态时具有的内能最低,所以CH3﹣Zr…H状态最稳定,故C正确;
D、由图可知,Zr+CH4→CH─Zr…H3活化能为95.69kJ/ml,故D错误;
故选:D。
6.【分析】A、同一种物质的状态变化伴随有能量变化;
B、需要加热才能进行的反应可能是放热反应;
C、键能越大物质越稳定;
D、反应热=反应物的键能之和﹣生成物的键能之和,在硅晶体中每个硅原子和其它4个硅原子形成4个共价键,则每个硅原子含有2个Si﹣Si键。
【解答】解:A、同一种物质的气态→液态→固体均放出热量,所以反应中的能量变化与物质的状态有关,故A错误;
B、有些放热反应的发生条件是加热,如铝热反应是放热反应,但反应条件是高温,故B错误;
C、由表中数据可知,键能:Si﹣C>Si﹣Si,键能越大物质越稳定,所以SiC比晶体硅更稳定,故C错误;
D、每个硅原子含有2个Si﹣Si键,反应热△H=反应物的键能之和﹣生成物的键能之和=360kJ/ml×4+436kJ/ml×2﹣176kJ/ml×2﹣431kJ/ml×4=+236 kJ/ml,热化学方程式为SiCl4(g)+2H2(g)=Si(s)+4HCl(g)△H=+236 kJ/ml,即每生成1ml Si(s)吸收的能量为236kJ,故D正确;
故选:D。
7.【分析】A、断裂化学键吸收能量,形成化学键释放能量;
B、强酸与强碱在稀溶液中生成难溶性盐时会放热;
C、△H﹣T△S<0的反应能自发进行;
D、焓变△H只与化学反应有关,与反应条件无关。
【解答】解:A、化学反应过程中,旧化学键断裂吸收能量,新化学键形成释放能量,故A错误;
B、强酸与强碱在稀溶液中生成难溶性盐时放热,如氢氧化钡与硫酸的反应,则反应生成1ml水时的反应热的数值可能大于中和热的数值,故B错误;
C、△H﹣T△S<0的反应自发进行,则放热反应不一定能自发进行,还与反应的熵变和温度有关,故C错误;
D、反应条件不能改变化学反应的始态与状态,所以焓变△H与反应条件无关,即同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同,故D正确;
故选:D。
8.【分析】A.合成氨中正逆反应的焓变绝对值相同,但符号相反;
B.催化剂能增大活化分子百分数而增大化学反应速率;
C.该反应过程中形成的N﹣H都是极性键;
D.合成氨为放热反应,旧键断裂吸收能量小于新键形成放出能量。
【解答】解:A.在可逆反应中,正反应和逆反应的焓变数值相同,但符号相反,故A错误;
B,使用催化剂,化学反应速率加快,生成等量的NH3需要的时间更短,故B正确;
C.N原子和H原子吸引电子的能力不同,形成的是极性键,故C错误;
D.根据图示,合成氨反应是放热反应,因此反应物断键吸收的能量小于生成物形成键释放的能量,故D错误;
故选:B。
9.【分析】A、正反应的活化能是E1,逆反应的活化能是E2;
B、反应物能量低于生成物;
C、反应是可逆反应,不能进行完全;
D、催化剂只能够加快反应速率,减小活化能,不能改变焓变。
【解答】解:A、正反应的活化能是E1,逆反应的活化能是E2,所以正反应与逆反应的活化能不相等,故A错误;
B、从图象分析,反应物能量低于生成物,反应吸热,△H=△E>0,故B正确;
C、将1mlA(g)和1mlB (g)置于一密闭容器中充分反应后,达到化学平衡,反应物不能全部转化,吸收的热量小于△E,故C错误;
D、催化剂只能够加快反应速率,减小活化能,不能改变焓变,所以加入催化剂后,反应加快,E1、E2都减小,△E不变,故D错误;
故选:B。
10.【分析】A.催化剂不影响平衡移动;
B.催化剂可降低反应的活化能;
C.由图可知反应物的能量比生成物的能量高92kJ,合成氨为放热反应;
D.△H=反应物的键能之和﹣生成物的键能之和,与是否加催化剂无关。
【解答】解:A.加入催化剂,可以提高反应速率,但不能提高各物质的转化率,故A正确;
B.加入催化剂,可以降低活化能,使反应更容易进行,故a曲线是加入催化剂时的能量变化曲线,故B正确;
C.根据反应物的总能量高于生成物的总能量,该反应是放热反应,故△H=﹣92kJ/ml,故C错误;
D.加催化剂不改变反应的焓变,故D正确;
故选:C。
11.【分析】A、有的化学反应需在加热条件下发生,但不一定是吸热反应;
B、物质具有的内能越大越不稳定;
C、干冰升华是物理变化,破坏的是分子间作用力;
D、化学变化中常常伴有能量变化。
【解答】解:A、有的化学反应需在加热条件下发生,但不一定是吸热反应,如铝热反应条件是高温,但属于放热反应,故A错误;
B、C(金刚石)=C(石墨)为放热反应,则内能:金刚石>石墨,所以稳定性:石墨>金刚石,故B错误;
C、干冰是分子晶体,升华时破坏的是分子间作用力,二氧化碳分子中的共价键不发生变化,故C正确;
D、化学变化中常常伴有能量变化,但伴有能量变化的物质变化不一定是是化学变化,如水蒸气的液化等是物理变化,故D错误;
故选:C。
12.【分析】A.固体硫变为硫蒸气为吸热过程;
B.可燃物燃烧需要温度达到着火点;
C.能量越低越稳定;
D.反应中Cr元素被还原。
【解答】解:A.固体硫变为硫蒸气要吸热,所以硫固体燃烧时放出的热量较少,故A错误;
B.燃烧为放热反应,但可燃物燃烧需要温度达到着火点,故不是所有放热反应在常温下都容易发生,故B错误;
C.由C(石墨,s)=C(金刚石,s)反应吸热可知石墨能量比金刚石小,能量越低越稳定,故C错误;
D.测酒仪中含有氧化剂,利用酒精的还原性将其还原后颜色发生变化,涉及Cr元素、C元素的化合价的变化,从而确定是否酒驾,故D正确;
故选:D。
二.填空题
13.【分析】(1)放热反应中反应物的总能量大于生成物的总能量;断裂化学键吸收能量,形成化学键释放能量,△H=反应物中键能之和﹣生成物中键能之和;
(2)常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应、所有中和反应、绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2)、少数置换反应(如C和H2O)、某些复分解(如铵盐和强碱)和碳、一氧化碳、氢气等还原金属氧化物。以此解答该题。
【解答】解:(1)由图可知,A中反应物的总能量大于生成物的总能量,为放热反应,
断裂2mlH2中的化学键吸收2×436kJ热量,断裂1mlO2中的化学键吸收496kJ热量,共吸收2×436+496=1368kJ热量,形成4mlH﹣O键释放4×463kJ=1852kJ热量,2ml H2在氧气中燃烧生成气态水的反应热△H=反应物中键能之和﹣生成物中键能之和=1368﹣1852kJ/ml=﹣484kJ/ml,则生成1ml气态水放出的热量为242kJ,
故答案为:a;242;
(2)a.盐酸与烧碱溶液反应,为中和反应,属于放热反应,
b.Ba(OH)2•8H2O+2NH4Cl═BaCl2+10H2O+2NH3↑为吸热反应,
c.氢气在氧气中燃烧生成水,为放热反应,
d.高温煅烧石灰石使其分解,属于吸热反应,
e.铝和盐酸反应,为放热反应,
f.葡萄糖在人体内氧化分解,放出能量,属于放热反应,
故答案为:acef;bd。
14.【分析】1mlP4(白磷)含有6mlP﹣P键,5mlO2含有5mlO=O键,1mlP4O10还有12mlP﹣O键和4mlP=O键,△H=反应物键能总和﹣生成物键能总和。
【解答】解:1mlP4(白磷)含有6mlP﹣P键,5mlO2含有5mlO=O键,1mlP4O10还有12mlP﹣O键和4mlP=O键,
△H=反应物键能总和﹣生成物键能总和=(6×198+5×598)kJ/ml﹣(12×360+4×585)kJ/ml=﹣2982kJ/ml,则该反应为放热反应,能量变化为2982kJ,
故答案为:放热;2982。
15.【分析】(1)根据放热过程生成物的总能量小于反应物总能量,吸热过程生成物的总能量高于反应物总能量,结合炭和水蒸汽发生反应生成CO、H2为放热反应判断;
(2)①根据放热反应中生成物能量总和与反应物能量总和的关系;
②根据热化学方程式2H2(g)+O2(g)═2H2O(l)△H=﹣572kJ/ml进行计算以及液态水变成水蒸气需要吸热来判断;
(3)反应热△H=反应物总键能﹣生成物总键能,结合应的热化学方程式进行计算;
(4)反应热△H=反应物总键能﹣生成物总键能,若反应物总键能大于生成物总键能,则反应吸热,反之相反。
【解答】解:(1)步骤1为吸热过程,故E2>E1,步骤2是放热过程,故E2>E3,由于炭和水蒸汽发生反应生成CO、H2为吸热反应,则E3>E1,故E2>E3>E1;
故答案为:E2>E3>E1;
(2)①因放热反应中生成物能量总<与反应物能量总和,而2H2(g)+O2(g)═2H2O(l)△H=﹣572kJ/ml是放热反应,
故答案为:小于;
②据热化学方程式2H2(g)+O2(g)═2H2O(l)△H=﹣572kJ/ml,2ml氢气完全燃烧生成液态水放出热量572kJ,因液态水变成水蒸气需要吸热,所以2ml氢气完全燃烧生成水蒸气放出热量小于572kJ,
故答案为:小于;
(3)设1ml H2O(g)完全断键时共吸热为x,1ml火箭燃料肼(N2H4)生成氮气和水蒸气放出能量为5akJ,则热化学方程式为N2H4(l)+O2(g)═N2(g)+2H2O(g)△H=﹣5akJ/ml,即3akJ+2.5akJ×4+4akJ﹣(8akJ+2x)=﹣5akJ,x=7akJ,
故答案为:7a;
(4)由图可知,该反应吸热,则反应物总键能大于生成物总键能,
故答案为:大于。化学键
Si﹣Cl
H﹣H
H﹣Cl
Si﹣Si
Si﹣C
键能kJ/ml
360
436
431
176
347
化学键
H﹣H
O═O
H﹣O
键能(kJ•ml﹣1)
436
496
463
人教版 (2019)选择性必修1第一节 反应热第2课时测试题: 这是一份人教版 (2019)选择性必修1第一节 反应热第2课时测试题,共4页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
人教版 (2019)选择性必修1第一节 反应热第1课时课时练习: 这是一份人教版 (2019)选择性必修1第一节 反应热第1课时课时练习,共4页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
人教版 (2019)选择性必修1第一节 反应热优秀课堂检测: 这是一份人教版 (2019)选择性必修1第一节 反应热优秀课堂检测,共6页。试卷主要包含了下列说法不正确的是,反应A+B―→C分两步进行,解析等内容,欢迎下载使用。













