

四川省成都七中2021届高三上学期入学考试 化学(含答案)
展开
成都七中 2021 届高三上期入学考试
化学试题
满分 100 分 时间 100 分钟
本试卷分第I 卷(选择题)和第II 卷(非选择题)两部分。
可能用到的相对原子质量:H—1 C—12 N—14 O—16 S—32 Ca—40
第 I 卷 (选择题 共 60 分)
包括 20 小题,每小题 3 分,共 60 分。每小题只有一个选项符合题意。
一、单选题
1.下列物质与危险化学品标志的对应关系不正确的是
A
B
C
D
酒精
氢气
NaOH 溶液
Cu
A.A B.B C.C D.D
2.能正确表示下列反应的离子方程式是
A.向次氯酸钠溶液中通入足量 SO2 气体:ClO-+SO2+H2O=HClO+HSO3-
B.0.1 mol/L NH4Al(SO4)2 溶液与 0.2 mol/L Ba(OH)2 溶液等体积混合:
Al3++2SO42-+2Ba2++4OH-=2BaSO4+AlO2-+2H2O
C.用浓盐酸酸化的KMnO4 溶液与H2O2 反应,证明H2O2 具有还原性:
2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O
D.Fe2O3 溶于过量氢碘酸溶液中:Fe2O3+6H++2I-=2Fe2++I2+3H2O
3.设NA 表示阿伏加德罗常数的值。下列叙述正确的是( )
A.1 mol CO2 和 SO2 组成的混合物中含有的原子数为 3 NA
B.2.24 L 的 Cl2 与一定量 CH4 在光照下反应生成的 HCl 分子数为 0.1 NA
C.常温下,0.1 mol 环氧乙烷( )中含有的共价键数为 0.3 NA
D.4.2 g CaH2 与水完全反应,转移的电子数为 0.1 NA
4.短周期主族元素 W、X、Y、Z 的原子序数依次增加。K、L、M 均是由这些元素组成的二元化合物,甲、乙分别是元素 X、Y 的单质,甲是常见的固体,乙是常见的气体。
K 是无色气体,是主要的大气污染物之一。0.05 mol•L-1 丙溶液的 pH 为 1,上述物质的转化关系如图所示。下列说法正确的是( )
A丙 也可由 W、Y 组成的某种化合物与 K 直接反应制得
B.K、L、M 中沸点最高的是M
C 原子半径: WX
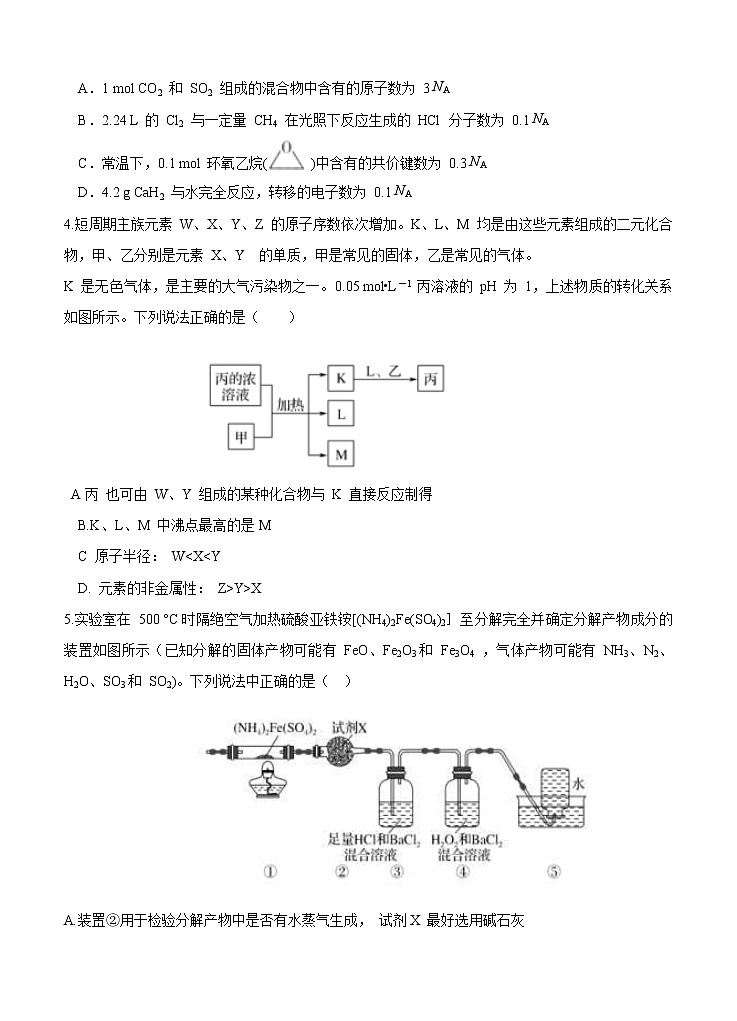
5.实验室在 500 °C时隔绝空气加热硫酸亚铁铵[(NH4)2Fe(SO4)2]至分解完全并确定分解产物成分的装置如图所示(已知分解的固体产物可能有 FeO、Fe2O3和 Fe3O4 ,气体产物可能有 NH3、N2、H2O、SO3和 SO2)。下列说法中正确的是( )
A.装置②用于检验分解产物中是否有水蒸气生成, 试剂X 最好选用碱石灰
B.装置③用于检验分解产物中是否有SO3 气体生成并除去SO3 和 NH3
C.取①中固体残留物与稀硫酸反应并滴加 KSCN 溶液, 溶液变红色, 则残留物一定为
Fe2O3
D. 装置④用于检验分解产物中是否有SO2气体生成, 装置⑤用于收集生成的 NH3 和N2
6.H2 与 ICl 的反应分①、②两步进行, 其能量曲线如图所示, 下列错误的是()
A.反应①、反应②均为放热反应
B.反应①、反应②均为氧化还原反应
C.反应①比反应②的速率慢, 与相应正反应的活化能无关
D.反应①、反应②的焓变之和为ΔH= —218 kJ•mol-1
7.下列实验中 , 所采取的分离方法与对应原理都正确的是( )
选项
目的
分离方法
原理
A
分离溶于水的碘
乙醇萃取
碘在乙醇中的溶解度较大
B
分离乙酸乙酯和乙醇
分液
乙酸乙酯和乙醇的密度不同
C
除去 KNO3 固体中混杂的NaCl
重结晶
NaCl 在水中的溶解度很大
D
除去丁醇中的乙醚
蒸馏
丁醇与乙醚的沸点相差较大
8.下列有关有机物的说法正确的是( )
A.乙烯、氯乙烯、聚乙烯均可以使酸性高锰酸钾溶液褪色
B.1 mol 苹果酸[HOOCCH(OH)CH2COOH]可与 3 mol NaHCO3 发生反应
C. 酸性条件下,C2H5CO18OC2H5 的水解产物是C2H5CO18OH 和C2H5OH
D. 乙酸和油脂都能与氢氧化钠溶液反应
9.一种芳纶纤维的拉伸强度比钢丝还高,广泛用作防护材料。其结构片段如图。下列关于该高分子的说法正确的是( )
A. 完全水解产物的单个分子中,苯环上的一氯代物有两种
B. 完全水解产物的单个分子中,含有官能团—COOH 或—NH2
C. 氢键对该高分子的性能没有影响
D. 结构简式为:
10. 我国科研人员提出了由 CO2 和 CH4 转化为高附加值产品 CH3COOH 的催化反应历程。该历程示意图如图。
下列说法不正确的是( )
A.生成 CH3COOH 总反应的原子利用率为 100%
B.CH4→CH3COOH 过程中,有 C—H 键发生断裂
C. ①→②放出能量并形成了 C—C 键
D. 该催化剂可有效提高反应物的平衡转化率
11.铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如图。若上端开口关闭,可得到强还原性的 H•(氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的•OH(羟基自由基)。下列说法错误的是( )
A. 无论是否鼓入空气,负极的电极反应式均为 Fe-2e-=Fe2+
B. 不鼓入空气时,正极的电极反应式为 H++e-=H•
C. 鼓入空气时,每生成 1 mol•OH 有 2 mol 电子发生转移
D. 处理含有草酸(H2C2O4)的污水时,上端开口应打开并鼓入空气
12.下列说法正确的是( )
A. 反应 CH4(g) + H2O(g) = CO(g) + 3H2(g)在一定条件下能自发进行,该反应一定为放热反应
B.可用牺牲阳极或外加电流的阴极保护法延缓钢铁水闸的腐蚀
C.Na2O2 与水反应产生 1 mol O2,理论上转移的电子数目约为 4×6.02×10 23
D.保持温度不变,向稀氨水中缓慢通入 CO2,溶液中 c(OH—)/c(NH3•H 2O)的值增大
13. 反应 CO(g)+2H2(g)CH3OH(g) ΔH T2,则有 K1> K2
19. 柠檬酸(用 H3R 表示)是一种高效除垢剂,现用一定浓度的柠檬酸溶液去除水垢,溶液中 H3R、H2R-、HR2-、R3-的含量随 pH 的变化曲线如图所示。下列说法中正确的是( )
A.H3R 的第二步电离常数 Ka2(H3R)的数量级为 10-4
B.pH=6 时,c(R3-)=c(HR2-)>c(H+)>c(OH-)
C.Na2HR 溶液中 HR2-的水解程度大于电离程度
D.pH=4 时,c(H+)=c(H2R-)+2c(HR2-)+c(OH-)
20. 最近我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中 CO2 和 H2S 的高效去除。示意图如图所示,其中电极分别为 ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为:
①EDTA-Fe 2+-e-===EDTA-Fe 3+
②2EDTA-Fe 3++H2S===2H++S+2EDTA-Fe 2+
该装置工作时,下列叙述错误的是( )
A. 阴极的电极反应:CO2+2H++2e-=CO+H2O
B. 协同转化总反应:CO2+H2S=CO+H2O+S
C. 石墨烯上的电势比 ZnO@石墨烯上的低
D. 若采用 Fe3+/Fe2+取代 EDTA-Fe 3+/EDTA-Fe 2+,溶液需为酸性
第Ⅱ卷(非选择题 共 40 分)
21.I.2019 年是元素周期表发表 150 周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等 9 种元素相对原子质量的新值,被采用为国际新标准。
(1)In 在周期表中的位置是_ 。
(2)In 的最高价氧化物的水化物的碱性_ Ba(OH)2 的碱性(填“>”或“”“Al3+ ( 1 分)
(6) (l分)
(7)A l3++3NH3• 3H2O= Al( OH) 3↓ +3NH4+ ( 1 分)
(8) 2Na+2H2O = 2Na++2OH- +H2 ↑(1分) 离子键和极性键 ( 2 分)
22 (10 分)
(l)TiCl4(g)+2CO(g) =TiO2(s)+2Cl2(g)+2C(s) ΔH= +45.5 kJ•mo1 -1( 2 分)
(2)> ( 1 分)
(3) ①0.008 mol•L-1·min-1 ( 1 分)
②20% ( 1 分)
③D ( 1 分)
④L2( 2 分) (1,) ( 2 分 )
23 ( 10 分)
(l )V2O5+2H+ =2VO2++H2O ( 2 分) SiO2 (l 分)
(2)0.5 ( 2 分)
(3)Fe(OH)3、 Al(OH)3 ( 2 分)
(4)K+ (l 分)
(5)2NH4VO3 V2O5+ +H2O↑ + 2NH3 ↑( 2 分)
24 (10 分)
(1) ①浓盐酸 (1 分)
②饱和食盐水 (1 分)
③稀硝酸 (1 分)
④水 (1 分)
(2) e→f→b→c→d(或 f→e→b →c→d) ( 1 分)
(3)防止水蒸气进入装置IX和装置VI (l 分)
(4)NOCl+2NaOH= NaCl+ NaNO2+H2O ( 2 分)
(5)HNO3(浓)+ 3HC1 (浓 )= NOCl↑+Cl2↑+2H2O ( 2 分)





