
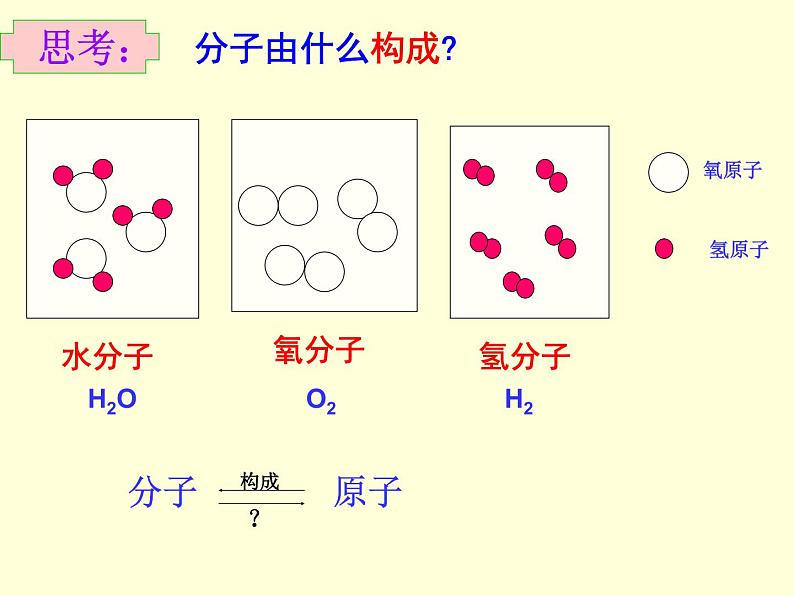

人教版九年级上册课题2 原子的结构图文课件ppt
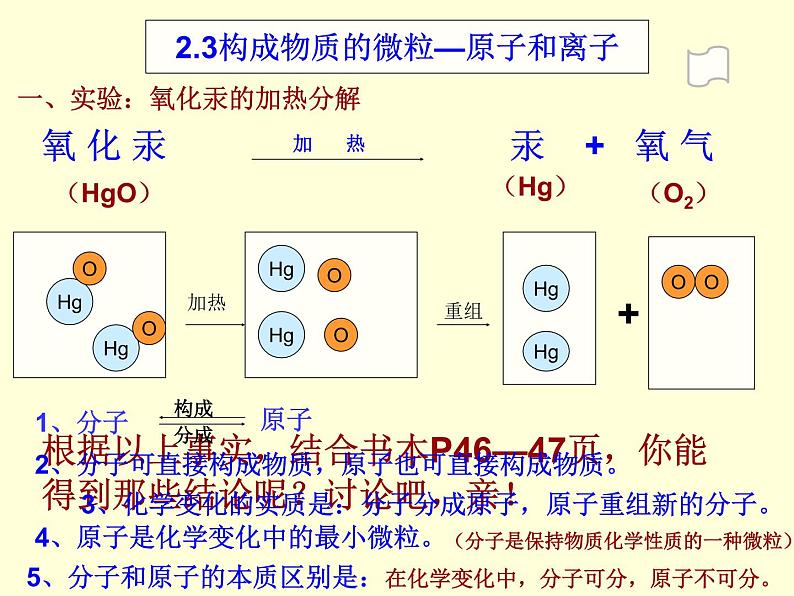
展开一、实验:氧化汞的加热分解
氧 化 汞 汞 + 氧 气
根据以上事实,结合书本P46—47页,你能得到那些结论呢?讨论吧,亲!
2、分子可直接构成物质,原子也可直接构成物质。
3、化学变化的实质是:分子分成原子,原子重组新的分子。
4、原子是化学变化中的最小微粒。
5、分子和原子的本质区别是:在化学变化中,分子可分,原子不可分。
2.3构成物质的微粒—原子和离子
(分子是保持物质化学性质的一种微粒)
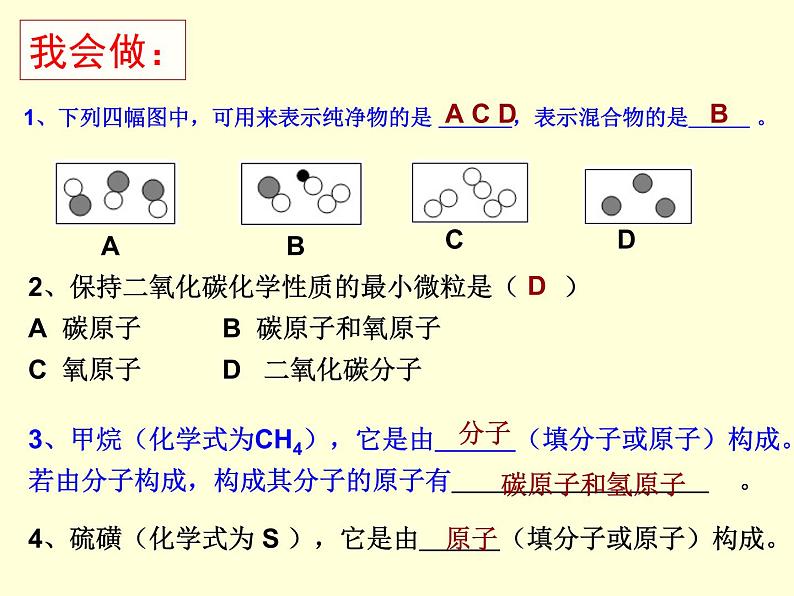
1、下列四幅图中,可用来表示纯净物的是 ,表示混合物的是 。
3、甲烷(化学式为CH4),它是由 (填分子或原子)构成。若由分子构成,构成其分子的原子有 。
4、硫磺(化学式为 S ),它是由 (填分子或原子)构成。
2、保持二氧化碳化学性质的最小微粒是( )A 碳原子 B 碳原子和氧原子C 氧原子 D 二氧化碳分子
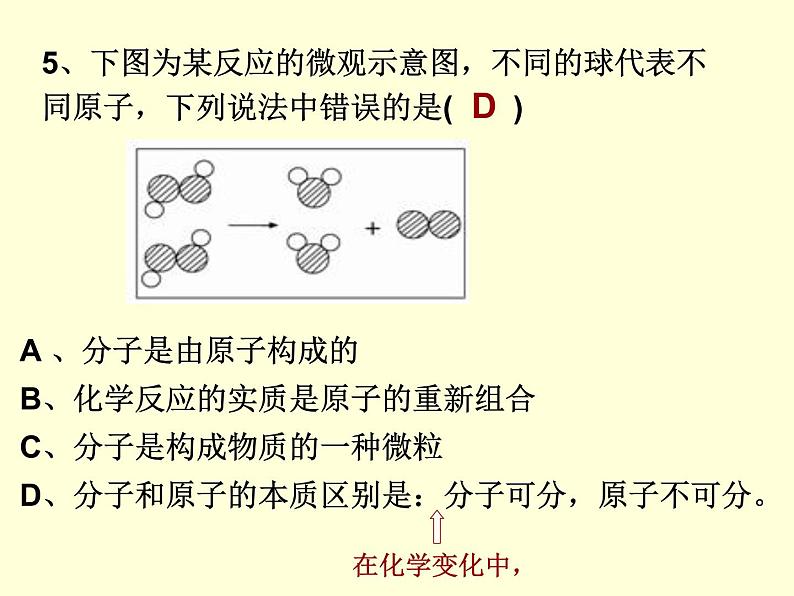
5、下图为某反应的微观示意图,不同的球代表不同原子,下列说法中错误的是( )
A 、分子是由原子构成的B、化学反应的实质是原子的重新组合C、分子是构成物质的一种微粒D、分子和原子的本质区别是:分子可分,原子不可分。
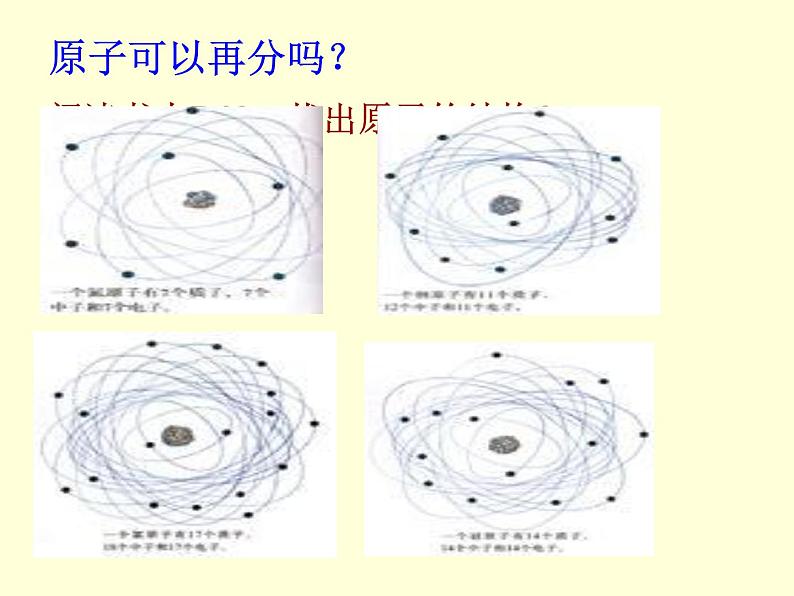
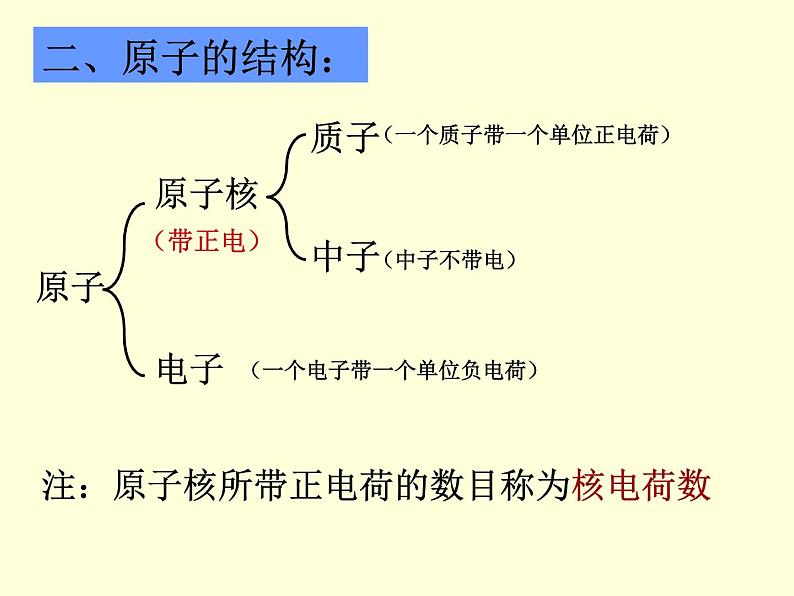
阅读书本P48,找出原子的结构?
(一个质子带一个单位正电荷)
(一个电子带一个单位负电荷)
注:原子核所带正电荷的数目称为核电荷数
【思考】电子在核外的空间里做高速的运动,它们会相互碰撞打架吗?电子在核外的排布会有什么特点?
特点:核外电子是分层运动的,这种分层运动也叫分层排布。
四、原子核外电子的排布:
1、核外电子排布特点:
(1)各层最多能容纳的电子数为2n2个;
(2)最外层不超过8个(除第一层不超过 2个);
(3)能量低的优先排满,依次再排能量 逐步升高的电子层里。
【思考】能否用一个更简明的图形来表示原子的结构及原子核外电子的排布特点呢?
排布特点2:原子里 第一层最多排2个电子, 第二层最多排8个电子, 最外层电子数最多不超过8个(只有1层的不超过2个电子)。
【思考】:下列1-18元素原子结构示意图中,有 什么特点?
【小知识】物质都有趋向于稳定状态的特点
原子也不例外,也有趋向于稳定结构的特点。那么,什么样的结构才是原子的稳定结构呢?
【稳定结构】像稀有气体元素原子这样的结构叫8电子稳定结构。若只有一个电子层,则2电子也是稳定结构(如: He)。
最外层电子数 < 4个,容易失去电子,带正电荷,称为阳离子
最外层电子数 > 4个,容易得到电子,带负电荷,称为阴离子
注:阴阳离子相互吸引形成了离子化合物,如NaCl MgO
【结论】1、元素(原子)的性质,特别是化学性质与该原子 有密切关系。2、如果 相同,两种元素的化学性质相似。
1、下列粒子的结构示意图中,表示非金属元素的原子的是 ( )
2 、下列微粒结构示意图中属于阴离子的是( )
A B C D
3、手机中使用的是锂离子电池。已知锂离子(Li+)的原子核中质子数3,中子为4,下列有关锂离子的说,正确的是 ( ) A 原子核外电子数为3 B 相对原子质量比锂原子小 C 原子的核电荷数为+1 D 原子核外电子数为2
4、铝原子的结构示意图为 ,它的核内有 个质子,核外有 个电子层,最外层电子数是 ,在化学反应中,铝原子容易 电子,形成 . (填阴离子或阳离子)
(1)3H+ (2)2Mg2+ (3)3Al3+ (4) Cl- (5) S2- (6) Na+
5、写出下列化学用语的意义
6、根据下列粒子的结构示意图,回答问题。
(1)属于稀有气体原子的是 (填序号,下同);属于阴离子的是 ,属于阳离子的是 ,属于非金属原子的是 。(2)表示同一种元素的粒子是 ;
(3)在化学反应中容易得到电子的粒子是 。
(1)Mg2+ (2)Al3+ (3) S2-
每个镁离子带两个单位正电荷
每个铝离子带三个单位正电荷
每个硫离子带两个单位负电荷
6、写出下列数字的意义
亲,你能小结出分子、原子、离子与物质之间的联系:
思考:请你通过比较各原子的质子数、中子数、核外电子数、核电荷数之间的关系,你得到了什么信息?
原子一定是由原子核和核外电子构成,2、一般来说原子都是由质子、中子、电子构成,除了氢(没有中子)
3、电子数=质子数=核电荷数=原子序数(核电荷数:原子核所带正电荷数目)
4、质子数不一定等于中子数
5、整个原子显示电中性。
1、有关原子的叙述正确的是( )A、原子都是由质子和电子构成的 B、原子中质子数不一定等于电子数C、原子中一定含有中子 D、原子是由原子核和核外电子构成的2、铟元素的核电荷数为49,中子数为66,则铟元素的核外电子数为 ( )A 115 B 49 C 66 D 146
相对原子质量的计算公式
思考:原子的质量有多大? 科学家如何衡量原子的质量? 你会计算原子的相对原子质量吗?
而原子核居于原子中心,比原子小得多,原子核的半径只有原子半径的几万分之一,如果把原子比做一个庞大的体育场,而原子核只相当于一只蚂蚁,因此,原子里有很大的空间,电子就在这个空间做高速运动。
原子很小,一个原子跟一个乒乓球体积之比,相当于乒乓球跟地球体积之比。
1、定义:国际上一致同意以一种碳原子质量 的1/12作为标准, 其他原子的质量跟它比较所得的比, 作为这种原子的相对原子质量。(用符号Ar表示)
1个碳原子的实际质量×1/12
碳原子质量的x1/12
1.674x10-27kg
1.993x10-26kgx1/12
2.657x10-26kg
2、由原子结构知识可知:在原子中原子的质量主要集中在原子核上,而电子的质量可以忽略不计。
故: 相对原子质量 = 质 子 数 + 中 子 数
找规律:相对原子质量的近似值与该原子的质子数、中子数的关系
规律:相对原子质量=质子数+中子数
原子质量和相对原子质量比较
1、原子一定是由原子核和核外电子构成,2、一般来说原子都是由质子、中子、电子构成,除了氢(没有中子)
3、电子数=质子数=核电荷数=原子序数
5、相对原子质量=质子数+中子数
人教版九年级上册第三单元 物质构成的奥秘课题2 原子的结构评课ppt课件: 这是一份人教版九年级上册第三单元 物质构成的奥秘课题2 原子的结构评课ppt课件,共22页。PPT课件主要包含了昨日点滴,原子质量的大小,我要自学,相对原子质量,追根寻源,主动学习才是快乐的,准确度,再展风采等内容,欢迎下载使用。
初中化学人教版九年级上册第三单元 物质构成的奥秘课题2 原子的结构教学演示ppt课件: 这是一份初中化学人教版九年级上册第三单元 物质构成的奥秘课题2 原子的结构教学演示ppt课件,共21页。PPT课件主要包含了三个理想,小组合作,相对分子质量,自学指导一,评价反馈,“+”,“×”,自学指导二,求相对分子质量,求元素的质量比等内容,欢迎下载使用。
人教版九年级上册第三单元 物质构成的奥秘课题2 原子的结构教课ppt课件: 这是一份人教版九年级上册第三单元 物质构成的奥秘课题2 原子的结构教课ppt课件,共19页。PPT课件主要包含了相对原子质量Ar,mc×112,Arx=,碳原子质量,绝对的,相对的,很小千克,大于1单位为一,ArO,四舍五入等内容,欢迎下载使用。













