

【化学】山东省济宁市实验中学2018-2019学年高二上学期第二次月考 试卷
展开
山东省济宁市实验中学2018-2019学年高二上学期第二次月考平均相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 Al:27 Si:28 P:31 S:32 Cl:35.5 K:39 Ca:40 Cu:64 Ag:108一、单选题(60分)1.现有四种元素的基态原子的电子排布式:①; ②;③; ④。则下列有关比较中正确的是( )A.第一电离能:④>③>②>① B.原子半径:④>③>②>①
C.电负性:④>③>②>① D.最高正化合价:④>③=②>①2.某元素的最外层电子数为2,价电子数为5,并且是同族中原子序数最小的元素,关于该元素的判断错误的是( )A.电子排布式为
B.该元素为
C.该元素为Ⅱ族元素
D.该元素位于区3.碳酸亚乙烯酯是锂离子电池低温电解液的重要添加剂,其结构如图,下列有关该物质的说法正确的是( )A.分子式为 B.分子中含6个键
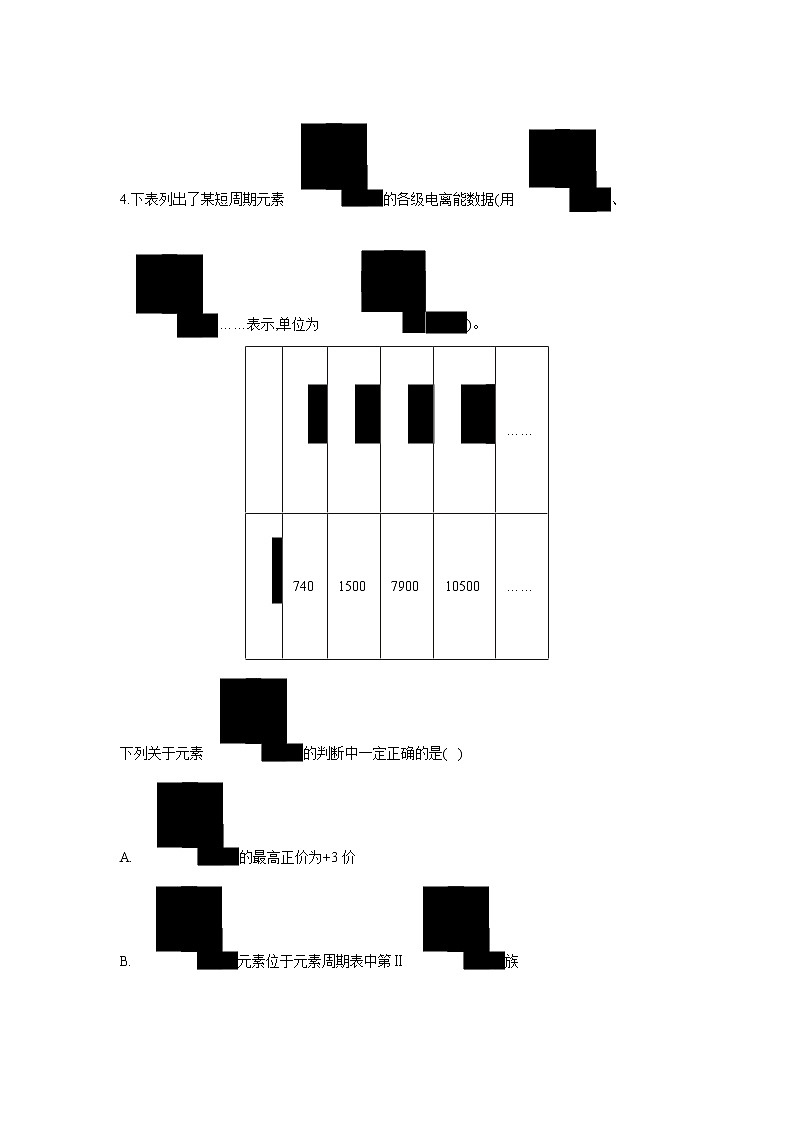
C.分子中只有极性键 D.8.6该物质完全燃烧得到6.72CO24.下表列出了某短周期元素的各级电离能数据(用、……表示,单位为)。 ……7401500790010500……下列关于元素的判断中一定正确的是( )A. 的最高正价为+3价
B. 元素位于元素周期表中第Ⅱ族
C. 元素的原子最外层共有4个电子
D. 元素基态原子的电子排布式为5.下列具有特殊性能的材料中,由主族元素和副族元素形成的化合物是( )A.半导体材料砷化镓 B.吸氢材料镧镍合金
C.透明陶瓷材料硒化锌 D.超导材料K3C606.配位化合物的数量巨大,组成和结构形形色色,丰富多彩。配合物[Cu(NH3)4](OH)2的中心离子、 配体和配位数分别为( )A.Cu2+ 、NH3、4 B.Cu+、NH3、4
C.Cu2+ 、OH-、2 D.Cu2+ 、NH3、27.下列关于同一种原子中的基态和激发态说法中,正确的是( )A.基态时的能量比激发态时高
B.激发态时比较稳定
C.由基态转化为激发态过程中吸收能量
D.电子仅在激发态跃迁到基态时才会产生原子光谱8.下列各组物质中,酸性由强到弱排列顺序错误的是( )A.HClO4 H2SO4 H3PO4 B.HClO4 HClO3 HClO2
C.HClO HBrO4 HIO4 D.H2SO4 H2SO3 H2CO39.膦(PH3)又称磷化氢,在常温下是一种无色、有大蒜臭味的有毒气体,电石气的杂质中常含有磷化氢。它的立体构型是三角锥形。则下列关于PH3的叙述正确的是( )A.PH3分子中有未成键的孤电子对
B.PH3是空间对称结构
C.PH3是一种强氧化剂
D.PH3分子中的P—H键间夹角是90° 10.电负性差值为零时,可形成( )A.配位键 B.非极性共价键
C.金属键 D.离子键11.下表所示为部分短周期元素的原子半径及主要化合价,据下表判断叙述正确的是( )元素代号ABCDEFG原子半径/nm0.1520.1600.0890.1430.1020.0990.071主要化合价+1+2+2+3+6,-2-1-1A.单质的活泼性顺序为:A>C>B>D
B.气态氢化物的热稳定性HG>HF(F元素代号的氢化物)>H2E
C.B2+,D3+,E2-,G-四种离子的核外电子排布相同
D.单质A在O2中加热生成A2O212.常温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略反应引起的体积变化),所得实验数据如下表:实验编号起始浓度/(mol·L-1)反应后溶液的pHc(HA)c(KOH)①0.10.19②x0.27下列判断不正确的是( )A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1mol·L-1
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)13.准确量取24.90mL高锰酸钾溶液,可选用的仪器是( )A.50mL量筒 B.10mL量筒
C.50mL酸式滴定管 D.50mL碱式滴定管14.已知25℃下, 溶液中各微粒的浓度存在以下关系: 下列有关结论可能成立的是( )A.25℃下,向该溶液中加入一定量的盐酸时,Ka=8×10-5
B.25℃下,向该溶液中加入一定最的盐酸时,Ka=2×10-4
C.标准状况下,醋酸中Ka=1.75×10-5
D.升高到一定温度,Ka=7.2×10-515.一定条件下,下列反应不可能自发进行的是( )A.2O3(g)3O2(g) ΔH<0
B.2CO(g)2C(s)+O2(g) ΔH>0
C.N2(g)+3H2(g)2NH3(g) ΔH<0
D.CaCO3(s)CaO(s)+CO2(g) ΔH>016.如图两个电解槽中,A、B、C、D均为石墨电极,若电解过程中共有0.02mol电子通过,下列叙述中正确的是( )A.甲烧杯中A极上最多可析出铜0.64g
B.甲烧杯中B极上电极反应式为4OH--4e-=2H2O+O2↑
C.乙烧杯中滴入酚酞溶液,D极附近先变红
D.烧杯中C极上电极反应式为4H++4e-=2H2↑17.结合下图判断下列叙述正确的是( ) Ⅰ和Ⅱ中正极均被保护 Ⅰ和Ⅱ中Cl-均向Fe电极移动
C.Ⅰ和Ⅱ中负极反应均是Fe-2e-Fe2+D.Ⅰ和Ⅱ中正极反应均是O2+4e-+2H2O4OH-18.核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知只有质子数或中子数为奇数的原子核有NMR现象。试判断下列哪组原子均可产生NMR现象( )A.18O 31P
B.19F 12C
C.元素周期表中ⅢA族所有元素的原子
D.元素周期表中第3周期元素的所有原子19.反应A+B→C(△H>0)分两步进行:
①A+B→X(△H>0);②X→C(△H>0).下列示意图中,能正确表示总反应过程中能量变化的是( ) B. C. D. 20.将5 盐酸10 稀释到200 ,再取出5 ,这5 溶液的物质的量浓度是( )A.0.05 B.0.25
C.0.1 D.0.5 二、填空题(40分)21. NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析化学、医药工业中用途广泛。请回答下列问题:(1)NH4Al(SO4)2可作净水剂,其原理是 (用必要的化学用语和相关文字说明).(2)相同条件下,0.1mol·L-1的NH4Al(SO4)2溶液中c((NH4+) (填“等于”、“大于”或“小于”)0.1mol·L-1 NH4HSO4中c((NH4+).(3)均为0.1mol·L-1的几种电解质溶液的pH随温度变化的曲线如图1所示.①其中符合0.1mol·L-1 NH4Al(SO4)2的pH随温度变化的曲线是 ,导致pH随温度变化的原因是 ;②20℃时,0.1mol·L-1的NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)= .(4)室温时,向100mL 0.1mol·L-1的NH4HSO4溶液中滴加0.1mol·L-1的NaOH溶液,溶液pH与所加NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是 点;在b点,溶液中各离子浓度由大到小的排列顺序是 .22. 已知铅蓄电池的工作原理为Pb+PbO2+2H2SO42PbSO4+2H2O。现用如图装置进行电解实验,测得当铅蓄电池中转移0.4 mol电子时,铁电极的质量减少11.2g.请回答下列问题:⑴.A是铅蓄电池的__________极,铅蓄电池的正极反应式为__________,放电过程中电解液的密度(忽略电解液的体积变化)__________(填“减小”“增大”或“不变”)。
⑵.Ag电极的电极反应式是__________,该电极的电极产物有__________g.
⑶.Cu电极的电极反应式是__________,CuSO4溶液的浓度__________(填“减小”“增大”或“不变”)。⑷.如图表示电解进行过程中某个物理量x随时间t的变化曲线,其中曲线Ⅰ表示左侧U形管中的变化.曲线Ⅱ表示右侧U形管中的变化,则x表示( )A.U形管中产生的气体的体积
B.U形管中阳极质量的减少量
C.U形管中阴极质量的增加量23.在研究原子核外电子排布与元素周期表的关系时, 人们发现价电子排布相似的元素集中在一起。据此,人们将元素周期表分为五个区,并以最后填人电子的轨道能级符号作为该区的符号,如下图所示。(1)在区中,族序数最大、原子序数最小的元素,原子的价电子的电子云形状为__________。
(2)在区中,族序数最大、原子序数最小的元素,常见离子的电子排布式为__________,其中较稳定的是__________。
(3)在区中,族序数最大、原子序数最小的元素,原子的价电子排布式为__________。
(4)在区中,第2周期VA族元素原子价电子排布图为__________。
(5)当今常用于核能开发的元素是铀和钚,它们在__________区中。24.四种常见元素的性质或结构信息如下表。试根据信息回答有关问题。元素ABCD性质结构信息原子核外有两个电子层,最外层有3个未成对的电子原子的M层有1对成对的p电子原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价有两种常见氧化物,其中有一种是冶金工业常用的还原剂(1)写出B原子的电子排布式__________
(2)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为__________,简要描述该配合物中化学键的成键情况:__________(3)“。”表示氢原子,小黑点“·”表示没有形成共价键的最外层电子,短线表示共价键。则在以上分子中,中心原子采用sp3杂化形成化学键的是__________(填序号);在②的分子中有__________个σ键和__________个π键(4)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如下图所示:在Xm-中,硼原子轨道的杂化类型有__________;配位键存在于__________原子之间(填原子的数字标号);m=__________(填数字)(5)Co(NH3)5BrSO4可形成两种钴的配合物,已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀;在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,则第一种配合物的化学式为__________,第二种配合物的化学式为_________ .
参考答案1-20 ACABC ACCAB BBCDB CACBB21 (1)Al3+水解生成的Al(OH)3具有吸附性,即Al3++3H2OAl(OH)3+3H+,Al(OH)3吸附悬浮颗粒使其沉降从而净化水
(2)小于; (3)①I;NH4Al(SO4)2水解,溶液呈酸性,升高温度,其水解程度增大,pH减小;②10-3mol·L-1
(4)a;c(Na+)>c()>c()>c(OH-)=c(H+)22. (1)负 ;PbO2+4H++SO42-+2e-PbSO4+2H2O;减小
(2)2H++2e-H2↑ ;0.4
(3)Cu-2e-Cu2+ ;不变
(4)B23.(1)球形;(2)Fe2+:1s22s22p63s23p63d6,Fe3+:1s22s22p63s23p63d5; Fe3+
(3)3d104s2
(4)
(5)f24.(1)1s22s22p63s23p4
(2)[Cu(NH3)4]SO4, 中心原子与配位体之间以配位键相结合,内界与外界之间以离子键相结合
(3)①③④; 3; 2(4)sp2、sp3, 4、5(或5、4), 2(5)[Co(NH3)5Br]SO4, [Co(SO4)(NH3)5]Br,




