

【化学】贵州省铜仁第一中学2018-2019学年高二下学期期末考试
展开贵州省铜仁第一中学2018-2019学年高二下学期期末考试
范围:选修五~物质的量~离子反应;时间:90分钟;总分:100分
注意事项:
1.答题前请在答题卡上填写好自己的姓名、班级、考号等信息
2.请将答案正确填写在答题卡上
可能用到的原子量:Na:23 Cl:35.5 C:12 O:16 Cu:64 Fe:56 S:32
N:14 K:39 H:1 Br:80
第I卷(选择题)
一、选择题(本题包括25小题,每小题2分,共50分,每题只有1个选项是正确的)
1.下列关于化石燃料的加工说法正确的是 ( )
A.石油裂化主要得到乙烯
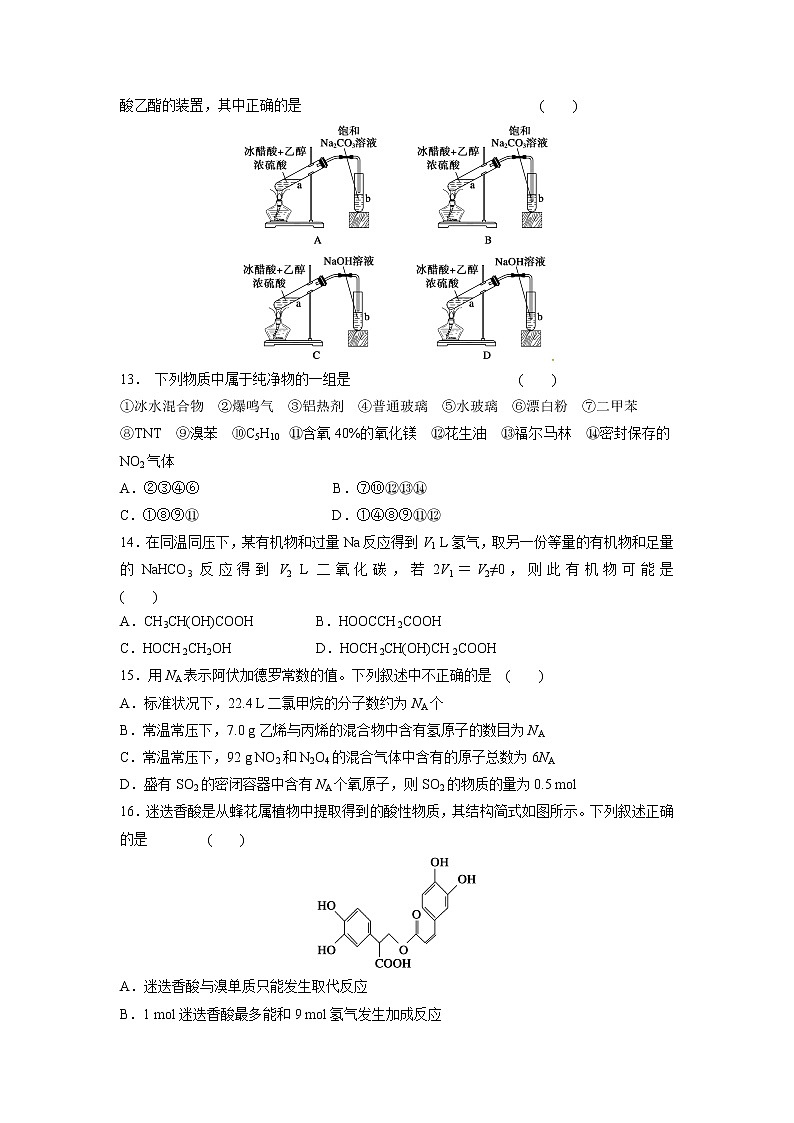
B.石油分馏是化学变化,可得到汽油、煤油
C.煤干馏主要得到焦炭、煤焦油、粗氨水、粗苯和焦炉气
D.煤制煤气是物理变化,是高效、清洁地利用煤的重要途径
2.下列说法正确的是 ( )
A.油脂的硬化属于酯化反应
B.涤纶、尼龙、环氧树脂、酚醛树脂等高分子化合物都是由缩聚反应制得
C.蛋白质受某些理化因素引起蛋白质理化性质和生物活性的变化称为盐析
D.蔗糖和麦芽糖的水解产物都是葡萄糖和果糖
3.下列有关说法不正确的是 ( )
A.PH小于5.6的雨水称为酸雨
B.分散质粒子直径介于1~100nm之间的分散系称为胶体
C.王水是浓硝酸和浓盐酸按物质的量之比1:3组成的混合物
D.光导纤维的主要成分是二氧化硅,太阳能光电板的主要原料是硅晶体
4. 化学工业是国民经济的支柱产业,下列生产过程中不涉及化学变化的是 ( )
A.氮肥厂用氢气和氮气合成氨 B.钢铁厂用热还原法冶炼铁
C.硫酸厂用接触法生产硫酸 D.炼油厂用分馏法生产汽油
5.下列有机物的结构表示不正确的是 ( )
A.羟基的电子式:
B.1-丁烯的键线式为
C.乙醇的结构式为
D.葡萄糖的最简式为CH2O
6.下列有机反应属于同一反应类型的是 ( )
A.甲烷制一氯甲烷、苯制硝基苯 B.苯制溴苯、乙烯制乙醇
C.乙醇制乙醛、乙醇和乙酸制乙酸乙酯 D.苯制环己烷、乙酸乙酯水解
7.下列化合物的分子中,所有原子一定处于同一平面的是 ( )
A.乙烷 B.1,3-丁二烯 C.氯乙苯 D.苯乙炔
8.北京奥运会期间对大量盆栽鲜花施用了S诱抗素制剂,以保持鲜花盛开。S诱抗素的分子结构如图,下列关于该分子说法正确的是 ( )
A.含有碳碳双键、羟基、羰基、羧基
B.含有苯环、羟基、羰基、羧基
C.含有羟基、羰基、羧基、酯基
D.含有碳碳双键、苯环、羟基、羰基
9.在核磁共振氢谱中出现两组峰,其氢原子数之比为3∶2的化合物是 ( )
A. B.
C. D.
10.下列化合物在一定条件下,既能发生消去反应,又能发生水解反应的是 ( )
A.CH3Cl B.
C. D.
11.由2氯丙烷制取少量的1,2丙二醇[HOCH2CH(OH)CH3]时,需要经过下列哪几步反应 ( )
A.加成→消去→取代 B. 取代→消去→加成
C.消去→加成→水解 D.消去→加成→消去
12.某课外兴趣小组欲在实验室里制备少量乙酸乙酯,该小组的同学设计了以下四个制取乙酸乙酯的装置,其中正确的是 ( )
13. 下列物质中属于纯净物的一组是 ( )
①冰水混合物 ②爆鸣气 ③铝热剂 ④普通玻璃 ⑤水玻璃 ⑥漂白粉 ⑦二甲苯
⑧TNT ⑨溴苯 ⑩C5H10 ⑪含氧40%的氧化镁 ⑫花生油 ⑬福尔马林 ⑭密封保存的NO2气体
A.②③④⑥ B.⑦⑩⑫⑬⑭
C.①⑧⑨⑪ D.①④⑧⑨⑪⑫
14.在同温同压下,某有机物和过量Na反应得到V1 L氢气,取另一份等量的有机物和足量的NaHCO3反应得到V2 L二氧化碳,若2V1=V2≠0,则此有机物可能是 ( )
A.CH3CH(OH)COOH B.HOOCCH2COOH
C.HOCH2CH2OH D.HOCH2CH(OH)CH2COOH
15.用NA表示阿伏加德罗常数的值。下列叙述中不正确的是 ( )
A.标准状况下,22.4 L二氯甲烷的分子数约为NA个
B.常温常压下,7.0 g乙烯与丙烯的混合物中含有氢原子的数目为NA
C.常温常压下,92 g NO2和N2O4的混合气体中含有的原子总数为6NA
D.盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5 mol
16.迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构简式如图所示。下列叙述正确的是 ( )
A.迷迭香酸与溴单质只能发生取代反应
B.1 mol迷迭香酸最多能和9 mol氢气发生加成反应
C.迷迭香酸可以发生水解反应、取代反应、消去反应和酯化反应
D.1 mol迷迭香酸最多能和6 mol NaOH发生反应
17.某中性有机物C10H20O2在稀硫酸作用下加热得到M和N两种物质,N经氧化最终可得到M,则该中性有机物的结构可能有 ( )
A.2种 B.3种 C.4种 D.5种
18. A、B、C三种醇同足量的金属钠完全反应,在相同条件下产生相同体积的氢气,消耗这三种醇的物质的量之比为3∶6∶2,则A、B、C三种醇分子里羟基数之比是 ( )
A.3∶2∶1 B.2∶6∶2 C.3∶1∶2 D.2∶1∶3
19.若要将1.6 mol甲烷完全和氯气发生取代反应,并且生成四种取代物的物质的量依次增大0.1 mol,则需要氯气的物质的量为 ( )
A.2.5 mol B.4.5 mol C.0.6 mol D.1.5 mol
20.能正确表示下列反应的离子方程式是 ( )
A.Fe3O4溶于足量稀HNO3:Fe3O4+8H+===Fe2++2Fe3++4H2O
B.NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO+Ba2++OH-===BaCO3↓+H2O
C.向澄清石灰水中通入少量CO2:OH-+CO2===HCO
D.将0.2 mol·L-1的NH4Al(SO4)2溶液与0.3 mol·L-1的Ba(OH)2溶液等体积混合:
2Al3++3SO+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
21.下列各组离子在指定环境中一定能大量共存的是 ( )
A.使pH试纸显蓝色的溶液中:Cu2+、NO、Fe3+、SO
B.与铝粉反应放出氢气的无色溶液中:NO、Al3+、Na+、SO
C.pH=0的溶液中:Al3+、NH、Ca2+、ClO-
D.使红色石蕊试纸变蓝的溶液中:SO、CO、Na+、K+
22.如图所示,分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的1/4)、H2和O2的混合气体,在标准状态下,若将H2、O2的混合气体点燃引爆。活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央。则原来H2、O2的体积之比可能为 ( )
A.2∶7 B.5∶4 C.4∶5 D.2∶1
23.标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,则下列关系中不正确的是 ( )
A.ρ=(17V+22 400)/(22.4+22.4V)
B.w=17c/(1 000ρ)
C.w=17V/(17V+22 400)
D.c=1 000Vρ/(17V+22 400)
24.某有机物分子中有a个—CH3,b个—CH2—,c个 , 则可连接的羟基的个数为( )
A.2b+3c-a B.a+b+c C.c+2-a D.b+c+2-a
25、25 ℃和101 kPa,乙烷、乙炔和丙烯组成的混合烃32 mL与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了72 mL,原混合烃中乙炔的体积分数为( )
A.15% B.25% C.45% D.75%
第Ⅱ卷(非选择题,共50分)
二、非选择题:包括5个大题,每题10分。
26.( 10分)已知氨基酸可发生如下反应:
且已知:D、E的相对分子质量分别为162和144,可发生如下物质转化关系,如下图所示:
(1) 写出C中所含官能团的名称:________________________
(2)写出B、D的结构简式:B____________,D________________________。
(3)写出C→E的化学方程式:_______________________________________。
(4)写出C发生缩聚反应的化学方程式:_______________________________________。
27.(10分)次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O)在印染、医药以及原子能工业中应用广泛,已知次硫酸氢钠甲醛具有强还原性,且在120 ℃以上发生分解。以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
步骤1:在烧瓶中(装置如图所示)加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH约为4,制得NaHSO3溶液。
步骤2:将装置A中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90 ℃下,反应约3 h,冷却至室温,抽滤。
步骤3:将滤液真空蒸发浓缩,冷却结晶,抽滤。
(1) 仪器B的名称为__________,装置A中通入SO2的导管末端是多孔球泡,其作用是:
___________ __________________。
(2) 装置C的作用是________________。
(3)①步骤2中,应采用何种加热方式____________,优点是________________;
②冷凝管中回流的主要物质除H2O外还有__________(填化学式)。
(4)步骤3中不在敞口容器中蒸发浓缩的原因是_____________________________。
⑸ (2分)请写出步骤1中制取NaHSO3的化学方程式:_____________________________。
28.(10分)某无色溶液中含有K+、Cl-、OH-、SO、SO,为检验溶液中所含的某些阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。检验其中OH-的实验方法省略,检验其他阴离子的过程如下图所示。
(1)图中试剂①~⑤溶质的化学式分别是
①________,②________,③________,④__________,⑤__________。
(2)图中现象c表明检验出的离子是________________。
(3) (2分) 白色沉淀A若加试剂③而不加试剂②,对实验的影响是____________________。
(4) (2分) 气体E通入试剂④发生反应的离子方程式是_________________________
_______________________________________________________________。
29、(10分)某天然有机化合物A仅含C、H、O元素,与A相关的反应框图如下:
(提示:A→P、A→B分别为两个反应,条件均为浓硫酸、加热)
(1)写出下列反应的反应类型:
B→D________; D→E第①步反应________。
(2)请分别写出D和E中的不含氧官能团的名称:D:__________ 、E:____________。
(3)写出S、P的结构简式:
S:_________________________________;P:____________________________;
(4) (2分)写出在浓H2SO4存在并加热的条件下,F与足量乙醇反应的化学方程式:
_____________________________________________________________________。
(5) (2分)写出符合条件的D的同分异构体的结构简式:(①与D具有相同官能团,②核磁共振氢谱中能呈现2种峰;峰面积比为1∶1)
_______________________________________________________________。
30.(10分) 分子式为C12H14O2的F有机物广泛用于香精的调香剂。为了合成该物质,某实验室的科技人员设计了下列合成路线:
试回答下列问题:
(1)A物质在核磁共振氢谱中能呈现________种峰;峰面积比为__________。
(2)上述合成路线中属于取代反应的是__________(填编号)。
(3)写出反应⑤、⑥的化学方程式:
⑤____________________________________________________________________;(2分)
⑥____________________________________________________________________。(2分)
(4) F有多种同分异构体,请写出符合下列条件的所有物质结构简式:①属于芳香族化合物,且含有与F相同的官能团;②苯环上有两个取代基,且苯环上的一氯代物只有两种;③其中一个取代基为—CH2COOCH3:______________。(3分)
参考答案
一、选择题(本题包括25小题,每小题2分,共50分,每题只有1个选项是正确的)
1.C 2.B 3.C 4.D 5.A 6.A 7.D 8.A 9.D 10.B 11.C 12.A 13.C 14.B 15.A 16.D 17.C 18.D 19.B 20.D 21.D 22.C 23.A 24.C 25.B
二、非选择题:包括5个大题,每题10分。
26. (10分,每空2分) (1)羟基、羧基
(2)
(3)
(4)
27. (10分,除标记外每空1分)
(1)(球形)冷凝管 增大接触面积使SO2充分反应
(2) 吸收二氧化硫并防止倒吸
(3)①水浴加热 均匀受热、容易控制温度(2分) ②HCHO
(4)防止产物被空气氧化
(5) (2分) Na2SO3+SO2+H2O===2 NaHSO3
28. (10分,除标记外每空1分)
(1)Ba(NO3)2 HCl HNO3 Br2 AgNO3 (2) Cl-
(3) (2分)会使SO对SO的检验产生干扰,不能确认SO是否存在
(4) (2分)SO2+Br2+2H2O===4H++SO+2Br-
29. (10分,除标记外每空1分)
(1)加成反应 消去反应 (2)D:溴原子、E:碳碳三键
(3)
(4) +2C2H5OH+2H2O(2分)
(5) (2分)
30. (10分,除标记外每空1分)
(1)4(1分) 3∶2∶3∶2 (1分)
(2) ②⑤⑥(1分)
(3)
+NaCl (2分)
(4) (3分)








