

【化学】河北省秦皇岛市卢龙中学2018-2019学年高二下学期期末考试
展开河北省秦皇岛市卢龙中学2018-2019学年高二下学期期末考试
说明:1、本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。
2、需将Ⅰ卷答案涂到答题卡上,Ⅱ卷答到卷纸上。
3、考试时间90分钟,总分100分
4、可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Cl-35.5
第I卷 选择题(共41分)
一、单项选择题(1--13每小题2分,14--18每小题3分,共41分。错选和多选不得分)
1、用激光笔照射烧杯中的豆浆时,可看见一条光亮的“通路”,该豆浆属于
A.悬浊液 B.乳浊液 C.胶体 D.溶液
2、从海水资源中提取下列物质,不用化学方法可能得到的是
A.Mg B.Br2 C.I2 D.NaCl
3、为探究Al(OH)3的性质,某同学取两支洁净的试管,加入适量Al(OH)3悬浊液,然后分别滴加足量的:①稀盐酸;②NaOH溶液。下列有关实验现象的描述正确的是
A.①、②都澄清 B.①、②都浑浊 C.①澄清,②浑浊 D.①浑浊,②澄清
4、硫酸工业的重要反应之一:2SO2(g)+O2(g) 2SO3(g),下列有关叙述错误的是
A.升高温度,反应速率加快 B.使用合适的催化剂,反应速率加快
C.平衡时,SO2的转化率为100% D.平衡时,SO3的浓度不再改变
5、下列表示不正确的是
A.甲烷分子的比例模型为 B.乙烷的结构简式为 CH3CH3
C.磷原子的结构示意图为 D.MgCl2的电子式为
6、下列说法不正确的是
A.16O和18O互为同位素 B.金刚石和足球烯互为同素异形体
C.C2H6和C3H6互为同系物 D.C2H5OH和CH3OCH3互为同分异构体
7、下列方程式不正确的是
A.碳与热的浓硫酸反应的化学方程式:C+2H2SO4(浓)CO↑+2SO2 +2H2O
B.乙炔燃烧的化学方程式: 2C2H2 + 5O2 4CO2+2H2O
C.氯化氢在水中的电离方程式:HCl=H+ +Cl-
D.氯化铵水解的离子方程式: NH4+ + H2O NH3·H2O +H+
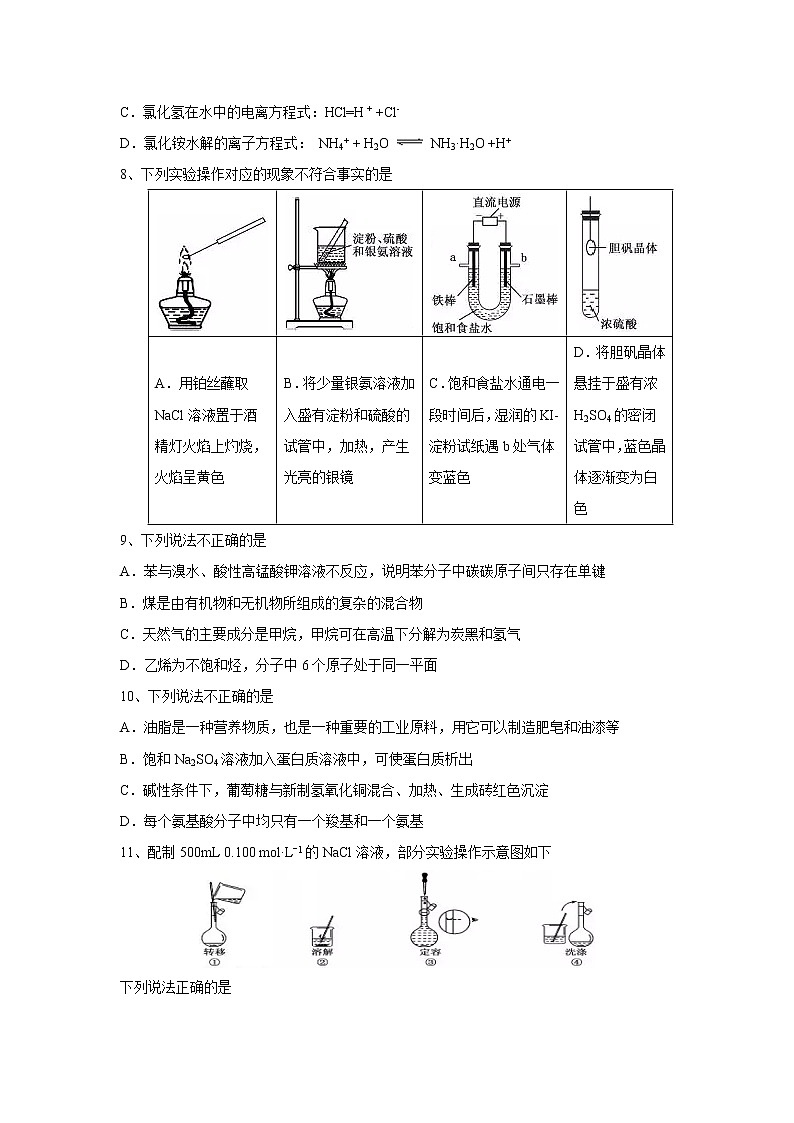
8、下列实验操作对应的现象不符合事实的是
A.用铂丝蘸取NaCl溶液置于酒精灯火焰上灼烧,火焰呈黄色 | B.将少量银氨溶液加入盛有淀粉和硫酸的试管中,加热,产生光亮的银镜 | C.饱和食盐水通电一段时间后,湿润的KI-淀粉试纸遇b处气体变蓝色 | D.将胆矾晶体悬挂于盛有浓H2SO4的密闭试管中,蓝色晶体逐渐变为白色 |
9、下列说法不正确的是
A.苯与溴水、酸性高锰酸钾溶液不反应,说明苯分子中碳碳原子间只存在单键
B.煤是由有机物和无机物所组成的复杂的混合物
C.天然气的主要成分是甲烷,甲烷可在高温下分解为炭黑和氢气
D.乙烯为不饱和烃,分子中6个原子处于同一平面
10、下列说法不正确的是
A.油脂是一种营养物质,也是一种重要的工业原料,用它可以制造肥皂和油漆等
B.饱和Na2SO4溶液加入蛋白质溶液中,可使蛋白质析出
C.碱性条件下,葡萄糖与新制氢氧化铜混合、加热、生成砖红色沉淀
D.每个氨基酸分子中均只有一个羧基和一个氨基
11、配制500mL 0.100 mol·Lˉ1的NaCl溶液,部分实验操作示意图如下
下列说法正确的是
A.实验中需用的仪器有:天平、250mL容量瓶、烧杯、玻璃棒、胶头滴管等
B.上述实验操作步骤的正确顺序为①②④③
C.容量瓶需要用自来水、蒸馏水洗涤,干燥后才可用
D.定容时,仰视容量瓶的刻度线,使配得的NaCl溶液浓度偏低
12、下列有关物质用途的叙述中,错误的是
A.氧化铝可用于制造耐火坩埚 B.二氧化硫可用来漂白食品
C.氧化铁可用作红色油漆和涂料 D.硅酸钠溶液可用作木材防火剂
13、下列物质中,不能发生水解反应的是
A.油脂 B.蔗糖 C.葡萄糖 D.纤维素
14、现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4; ②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是
A.第一电离能:③>②>① B.原子半径:③>②>①
C.电负性:③>②>① D.最高正化合价:③>②>①
15、下列各组元素属于p区的是
A.原子序数为1,2,7的元素 B.O,S,P C.Fe,Ar,Cl D.Na,Li,Mg
16、下列说法正确的是
A.所有共价键都有方向性
B.H3O+离子的存在,说明共价键不应有饱和性
C.若把H2S分子写成H3S分子,违背了共价键的饱和性
D.两个原子轨道发生重叠后,两核间的电子仅存在于两核之间
17、下列有关叙述正确的是
A.已知NaH是离子化合物,则其电子式是 Na+[:H]-
B.在PCl5分子中,磷原子满足最外层8电子结构
C.BCl3分子的空间构型为三角锥形
D.石墨晶体是层状结构,在同一层上平均每个正六边形所含有的碳原子数为3
18、下列事实与氢键有关的是
A. HF、HCl、HBr、HI的热稳定性依次减弱
B. 水加热到很高的温度都难以分解
C. CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
D.水结成冰体积膨胀
第Ⅱ卷(非选择题 共59分)
19、(10分)在实验室里,常用如下图所示装置制取并收集氨气。请回答下列问题:
(1)原理与方法
①制取氨气的化学方程式为___________________ __________;
②该收集氨气的方法为________。
A.向上排空气法 B.向下排空气法
(2)装置与操作
按右图组装仪器,进行实验。仪器a的名称为____________。
(3)思考与交流
①欲制取标准状况下4.48 L NH3,至少需要NH4Cl________g;
②实验室制取氨气,还可采用下图中的____ (填“A”或“B”)
20、(4分)已知:X为具有浓郁香味、不易溶于水的油状液体,食醋中约含有3%-5%的D,其转化关系如图所示。
请回答:(1)X的结构简式是__________________。
(2)A→B的化学方程式是____________________________________________。
(3)下列说法不正确的是________。
A.A+D→X的反应属于取代反应
B.除去X中少量D杂质可用饱和Na2CO3溶液
C.A与金属钠反应比水与金属钠反应要剧烈得多
D.等物质的量的A、B、D完全燃烧消耗O2的量依次减小
21、(15分)X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大。X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态。请回答下列问题:
(1)R核外电子排布式为__________________。
(2)X、Y、Z、W形成的有机物YW(ZX2)2中Y、Z的杂化轨道类型分别为__________,ZW3-离子的立体构型是__________。
(3)Y、R的最高价氧化物的沸点较高的是 (填化学式),原因是________________________________________。
(4)将Q单质的粉末加入到ZX3的浓溶液中,并通入W2,充分反应后溶液呈深蓝色,该反应的离子方程式为: 。
(5)W和Na的一种离子化合物的晶胞结构如图,该离子化合物为________(填化学式)。Na+的配位数为________,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为__________。已知该晶胞的密度为ρ g ·cm3,阿伏加德罗常数为NA,则两个最近的W离子间距离为 nm。(用含ρ、NA的计算式表示)
22、(每空2分,共20分)
(1)已知:25 ℃、101 kPa时,C(s)+O2(g)===CO(g) ΔH1=-110.5 kJ/mol
C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol
试回答下列问题:
①碳的燃烧热是:__________(填“ΔH1”或“ΔH2”);
②CO(g)+O2(g)===CO2(g) ΔH=__________kJ/mol。
(2)在25 ℃时,将0.2 mol NO2充入2 L的密闭容器中,发生反应:2NO2(g) N2O4(g) ΔH=-56.9 kJ/mol。5秒后反应达到平衡,测得NO2的物质的量为0.1 mol。试回答下列问题:
①5秒内,v(NO2)=__________mol/(L·s);
②若将该容器置于冰水中,气体颜色将________(填“变深”“变浅”或“不变”);
③该反应的平衡常数K=________________。
(3)NaHSO3是中学化学常见的物质。HSO在水溶液中存在如下两个平衡:
HSO H++SO Ka2 HSO+H2O H2SO3+OH- Kh2
已知25 ℃时,Ka2>Kh2,则0.1 mol/L NaHSO3溶液:
①溶液呈__________(填“酸性”“碱性”或“中性”);
②溶液中c(Na+)______c(HSO)(填“>”“<”或“=”)。
(4)将除锈后的铁钉用饱和食盐水浸泡一下,放入下图所示的具支试管中。
①几分钟后,可观察到导管中的水柱________;
A.升高 B.降低
②水柱变化的原因是铁钉发生了电化学腐蚀中的________;
A.析氢腐蚀 B.吸氧腐蚀
③该电化学腐蚀的正极反应式为 ___________________。
23、(10分)某研究性学习小组欲探究原电池的形成条件,按下图所示装置进行实验
序号 | A | B | 烧杯中的液体 | 指针是否偏转 |
1 | Zn | Cu | 稀硫酸 | 有 |
2 | Zn | Zn | 稀硫酸 | 无 |
3 | Cu | C | 氯化钠溶液 | 有 |
4 | Mg | Al | 氢氧化钠溶液 | 有 |
分析上述数据,回答下列问题:
(1)实验1中电流由 极流向 极(填“A”或“B”)
(2)实验4中电子由B极 流向A极,表明负极是 电极(填“镁”或“铝”)
(3)实验3 表明
A.铜在潮湿空气中不会被腐蚀 B.铜的腐蚀是自发进行的
(4)分析上表有关信息,下列说法不正确的是
A.相对活泼的金属一定做负极
B.失去电子的电极是负极
C.烧杯中的液体,必须是电解质溶液
D.浸入同一电解质溶液中的两个电极,是活泼性不同的二种金属(或其中一种非金属)
参考答案
第I卷 选择题(共41分)
单选题(1--13每小题2分,14--18每小题3分,共41分。错选和多选不得分)
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
答案 | C | D | A | C | D | C | A | B | A | D | D | B | C | A | B | C | A | D |
第Ⅱ卷(非选择题 共59分)
19、(10分,每空2分) (1)①2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O ②B
(2)酒精灯 (3)①10.7 ②A
20、(4分,其中方程式2分,其他每空1分)
21、(15分)
22、(每空2分,共20分)
(1)① ΔH2 ②-283
(2)①0.01 ②变浅 ③10
(3)①碱性 ②>
(4)①A ②B ③O2+4e-+2H2O=4OH-
23、(10分)
(1)B;A (4分)(2)铝 (2分)(3)B (2分)(4)A (2分)








