

【化学】江苏省兴化一中2018-2019学年高二上学期期末考试
展开
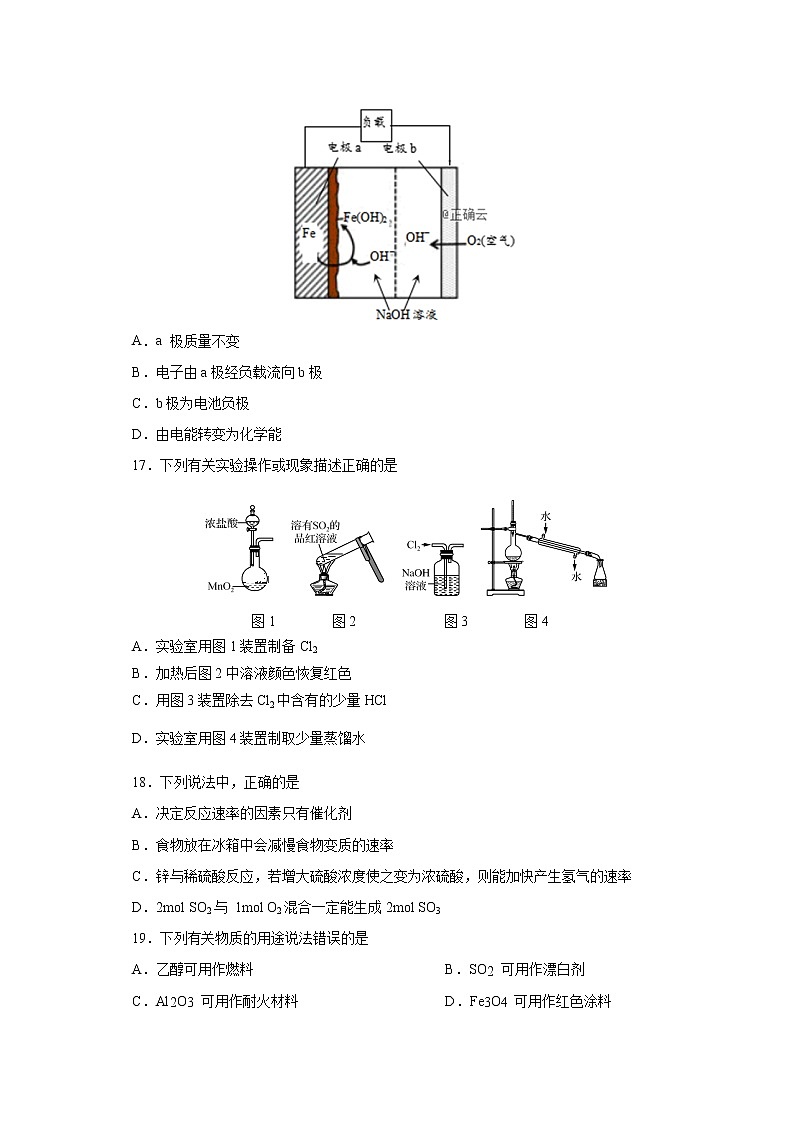
江苏省兴化一中2018-2019学年高二上学期期末考试.本试卷可能用到的相对原子质量:H 1 N 14 O 16 S 32 Cl 35.5 Cu 64 I 127一、单项选择题: (本部分23题,每题3分,共69分)。1.我国首飞的长征七号运载火箭采用液氧和煤油作为推进剂。煤油属于 A.纯净物 B.混合物 C.氧化物 D.单质2.下列物质不属于天然高分子化合物的是 A.淀粉 B.蚕丝 C.油脂 D.纤维素3.据报道,某些建筑材料会产生放射性同位素氡,从而对人体产生伤害。该同位素原子的中子数与质子数之差是 A. 50 B. 136 C.86 D. 2224.下列变化属于化学变化的是 A.拨云见日 B.剪纸成花 C.酿谷成酒 D.磨豆成浆 5.下列指定物质的主要成分与化学式对应不正确的是 A.水煤气——CO2、H2 B.磁性氧化铁——Fe3O4C.漂白粉——Ca(ClO)2与CaCl2的混合物 D.生石灰——CaO6.下列化学用语表示正确的是 A.乙酸的结构简式:C2H4O2 B.镁离子的结构示意图:C.HF的电子式: D.碳酸氢钠的电离方程式:NaHCO3 = Na++HCO3-7.以下物质间的转化不能通过一步反应实现的是 A.NO →NO2 B.NO2 →NO C.NH3→NO D.N2 → NO2 8.某溶液与Al反应能放出H2,下列离子在该溶液中一定能大量共存的是A.NH4+、Fe2+、NO3-、SO42- B.Na+、K+、Cl-、SO42-C.Mg2+、H+、Cl-、NO3- D.K+、Ca2+、HCO3-、Cl-9.下列气体中与NO气体的收集方法一定相同的是( ) A.N2 B.O2 C.NH3 D.NO210.下列物质中含有共价键的共价化合物是 A.NH4Cl B.MgBr2 C.N2 D.H2O11. 下列有关物质应用的叙述中,正确的是 A.Na2CO3可用于治疗胃酸过多 B.水玻璃浸泡过的木材能防火 C.明矾用于饮用水消毒 D.晶体硅用于制造光导纤维12.用NA表示阿伏加德罗常数的值。下列判断正确的是 A.常温常压下,28 g N2含有原子数为2NAB. 5.6gFe与足量盐酸反应失去的电子数为0.3 NAC.标准状况下22.4L水中含有的H2 O分子数为NAD. 1 mol·L-1 Al2(SO4)3溶液中含SO42-数目为3NA13.下列反应中热量变化与下图一致的是A.CO 和 O2 反应B.油脂在人体中氧化 C.NaOH 溶液和 HNO3 溶液反应D.C 和 C O2反应14.汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3K2O+5Na2O+16N2↑,有关该反应说法正确的是 A.属于复分解反应 B.KNO3发生氧化反应C.NaN3是还原剂 D.NaN3和KNO3中氮元素化合价均降低15.下列反应的离子方程式书写正确的是 A.铁和稀硝酸反应: 2Fe+6H+=2Fe 3++3H 2↑B.稀硫酸与氢氧化钡溶液反应: H++SO42一+Ba2++OH一=BaSO4↓+H2OC.氯气与水反应: Cl2+H2O=2H++Cl-+ClO-D.二氧化氮和水反应: 3NO2+H2O=2H++2NO3-+NO16.美国NASA曾开发一种铁-空气二次电池。该电池放电时,其原理如下图所示,电池反应为:2Fe+O2+2H2O=2Fe(OH)2。有关该电池放电时的说法正确的是A.a 极质量不变 B.电子由a极经负载流向b极C.b极为电池负极D.由电能转变为化学能 17.下列有关实验操作或现象描述正确的是 图1 图2 图3 图4A.实验室用图1装置制备Cl2 B.加热后图2中溶液颜色恢复红色C.用图3装置除去Cl2中含有的少量HCl D.实验室用图4装置制取少量蒸馏水18.下列说法中,正确的是A.决定反应速率的因素只有催化剂 B.食物放在冰箱中会减慢食物变质的速率C.锌与稀硫酸反应,若增大硫酸浓度使之变为浓硫酸,则能加快产生氢气的速率D.2mol SO2与 1mol O2混合一定能生成2mol SO319.下列有关物质的用途说法错误的是A.乙醇可用作燃料 B.SO2 可用作漂白剂C.Al2O3 可用作耐火材料 D.Fe3O4 可用作红色涂料20.下列关于乙醇和乙酸的说法中,正确的是A.乙醇和乙酸分子中都含有碳氧双键 B.乙醇和乙酸均能使紫色石蕊试液变红C.乙醇和乙酸均不能使酸性高锰酸钾溶液褪色D.乙醇和乙酸在一定条件下能发生酯化反应21.下列化学方程式书写正确的是A. CH2=CH2 + Br2 CH3CHBr2 B. C.D. 22.X、Y、Z、W是原子序数依次增大的短周期主族元素。Y与W同主族,Z所在的族序数等于周期数,X、Y最外层电子数之和为7;X、Z原子的电子数总和与Y、W原子的电子数总和之比为7∶12。下列说法正确的是A.原子半径:r(X)<r(Y)<r(Z)<r(W) B.Y的简单气态氢化物的热稳定性比W的弱C. 常温下,Z的单质一定易溶于由X、Y、W三种元素组成的化合物的溶液D.由X、Y组成的物质与由Y、W组成的物质化合,可能发生氧化还原反应23.某溶液中可能含有下列6种离子中的某几种:Cl-、SO42-、CO、NH、Na+、K+。为确认溶液组成进行如下实验:(1) 200 mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30 g,向沉淀中加入过量的盐酸,有2.33 g沉淀不溶。(2) 向(1)的滤液中加入足量的NaOH溶液,加热,标准状况下产生能使湿润红色石蕊试纸变蓝的气体1.12 L。由此可以得出关于原溶液组成的正确结论是 ( )A. 一定存在SO42-、CO、NH,可能存在Cl-、Na+、K+B. 一定存在SO42-、CO、NH、Cl-,一定不存在Na+、K+C. c(CO)=0.01mol·L-1,c(NH)>c(SO42-)D. 如果上述6种离子都存在,则c(Cl-)>c(SO42-) 二、 非选择题(本部分3题,共31分)24.A.《化学与生活》(15分) (1)(5分)合理饮食和正确用药,是人体健康的重要保证。现有下列物质 A.新鲜的橙汁 B.葡萄糖 C.食盐 D.小苏打 E.青霉素,请按下列要求填空(填序号)。应用最广泛的抗生素之一的是 ,可直接进入血液,补充能量的是 ,既可作为疏松剂,又可治疗胃酸过多的是 。碱式碳酸铝[Mg3Al(OH)7CO3]是一种治疗胃酸的药物,不溶于水,但溶于胃酸。试写出其与胃酸反应的离子方程式:__________________________________。(2)(5分)保护环境人人有责,化学也能让生活更美好。①经过百姓和政府的努力,位于某规划区的一座大型钢铁厂搬迁后,附近居民将不再受到该厂产生的红棕色烟尘的困扰。你认为红棕色烟尘是________(填字母)。A. CaCO3粉尘 B. P2O5粉尘 C. Fe2O3粉尘 D. SiO2粉尘②全国各地的污水处理厂正在升级改造,处理废水时加入明矾可作为混凝剂以吸附水中的杂质,明矾的化学式为____________________;漂白粉可用来杀菌消毒,工业上利用氯气和石灰乳制取漂白粉的化学反应方程式是__________________________。③为了确保空气质量的优良率,人们需要定时测定空气中各种污染物的浓度来计算出空气污染指数。因此,人们需要监测的空气污染物除了可吸入颗粒物(PM10)、二氧化硫以外,还有____________________。(3)(5分)环境友好型城市建设是城市规划(2011~2020 年)重点之一。①在机动车尾气系统中装置催化转化器,可将尾气中的 NO、CO 转化为可参与大气生态环境循环的无毒气体,写出NO和CO在一定条件下反应的化学方程式:___________。②脱硫、脱碳是指将燃煤中产生的 SO2、CO2 去除,减少其排放的过程。向煤中加入适量生石灰,可大大减少 SO2 的排放,并可回收得到 ____ ; CO2 和 H2 在催化剂及高温、高压条件下可以合成乙醇,该反应的化学方程式为 。25.(6分)在下图所示的物质转化关系中。D、E、H、J为常见单质,物质G是最常见的液体, B、G组成元素相同,C、K组成元素相同,C、D的相对分子质量相同,气体K能使湿润的红色石蕊试剂变蓝,F、K的水溶液酸碱性相同,气体L不能用排空气法收集。反应①是工业制取金属E的重要方法(部分反应条件未列出)。请回答下列问题:(1) C的化学式为______________。 (2) K的电子式为______________。(3) 反应②的离子方程式为________________________________________。(4) 反应③的化学方程式为________________________________________。26.(10分)海带中含有丰富的碘。为了从海带中提取碘并测定海带中碘元素的百分含量,某研究性学习小组称量了1 000 g海带,设计并进行了以下实验:(1) 步骤①中高温灼烧海带时,除需要三脚架、泥三角、酒精灯、玻璃棒外,还需要用的实验仪器是________。(2) 步骤③的实验操作名称是______________。(3) 步骤④反应中能生成可溶性的Mn2+,写出该反应的离子方程式:____________。(4) 请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:____________。(5) 在步骤④中加入5.000 g MnO2实验后又回收了3.260 g,通过计算求海带中碘元素的百分含量。
参考答案一、单项选择题:共69分。选项123456789101112答案BCACADDBADBA选项1314151617181920212223/答案DCDBBBDDBDD/二、非选择题:共31分。24.(15分)A.化学与生活(1)(共5分)E、B、D (各1分,共3分) Mg3Al(OH)7CO3+9H+===3Mg2++Al3++8H2O+CO2↑(2分)(2)(共5分)① C (1分)② KAl(SO4)2·12H2O(1分)2Cl2+2Ca(OH)2===Ca(ClO)2+CaCl2+2H2O (2分)③二氧化氮(NO2) (1分)(3)(共5分) ①2CO+2NO2CO2+N2 (2分)②CaSO4或(CaSO4·2H2O)(1分) 2CO2+6H2 =高=温==、=加==压= CH3CH2OH+3H2O (2 分)25.(6分)(1) N2H4 (1分) (2) (1分)(3)2Al+2OH-+2H2O===2AlO+3H2↑(2分)(4)4NH3+5O24NO+6H2O (2分)26.(10分)(1)坩埚(1分) (2)过滤(1分)(3) 2I-+MnO2+4H+===Mn2++I2+2H2O (2分) (4)取少量提取碘后的水溶液于试管中,加入几滴淀粉试液,观察是否出现蓝色,如果变蓝,说明还有单质碘。 (2分) (5)0.508%加入5.000 g MnO2实验后又回收了3.260 g即实际参加反应的MnO2为1.74 g,设I元素的质量为x,根据离子方程式:2I-+MnO2+4H+===Mn2++I2+2H2O254 87x 1.74 解得x=5.08 g,(2分)则海带中碘元素的质量分数为×100%=0.508%。(2分)





