
【化学】福建省南安第一中学2019-2020学年高二上学期第一次阶段考试
展开福建省南安第一中学2019-2020学年高二上学期第一次阶段考试
本试卷考试内容为:化学反应原理。分第I卷(选择题)和第II卷,共6页,满分100分,考试时间90分钟。
注意事项:
1.答题前,考生务必先将自己的姓名、准考证号填写在答题纸上。
2.考生作答时,请将答案答在答题纸上,在本试卷上答题无效。按照题号在各题的答题区域内作答,超出答题区域书写的答案无效。
3.答案使用0.5毫米的黑色中性(签字)笔或碳素笔书写,字体工整、笔迹清楚(英语科选择题答案使用2B铅笔填涂,如需改动,用橡皮擦干净后,再选涂其它答案标号)。
4.保持答题纸纸面清洁,不破损。考试结束后,将本试卷自行保存,答题纸交回。
相对原子质量:O:16 Na: 23 Mg:24 S:32 Cu:64 Ag:108 Ba:137
第I卷(选择题 共48分)
一.选择题:本大题共16小题,每小题3分,共48分。在每小题给出的四个选项中,只有1项符合题目要求。
1.如图是中国在南极建设的第四个科学考察站——泰山站。为了延长科学考察站基础设施使用寿命,钢铁设备表面镶嵌一些金属块(M)。下列说法正确的是( )
A.金属块M可能是铜,发生氧化反应
B.科考考察站里的设备在潮湿空气中主要发生化学腐蚀
C.这种保护方法叫牺牲阳极的阴极保护法
D.若采用外加电流的阴极保护法,设备与电源正极相连
2.成语是中国传统文化的瑰宝。铜墙铁壁、铜心铁胆、金戈铁马、百炼成钢等成语向人传递正能量。工业上,冶炼铁的有关热化学方程式如下
①C(s)+O2(g)=CO2(g) △H1=akJ·mol-1
②CO2(g)+C(s)=2CO(g) △H2=bkJ·mol-1
③Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H3=ckJ·mol-1
④2Fe2O3(s)+3C(s)=4Fe(s)+3CO2(g ) △H4=dkJ·mol-1(上述热化学方程式中,a,b,c,d均不等于0)下列说法正确的是( )
A.b<a B.CO(g)+ 1/2O2(g)= CO2(g) △H<akJ·mol-1
C.d=3c+2b D.C(s)+ 1/2O2(g)=CO (g) △H=(a+b)/2kJ·mol-1
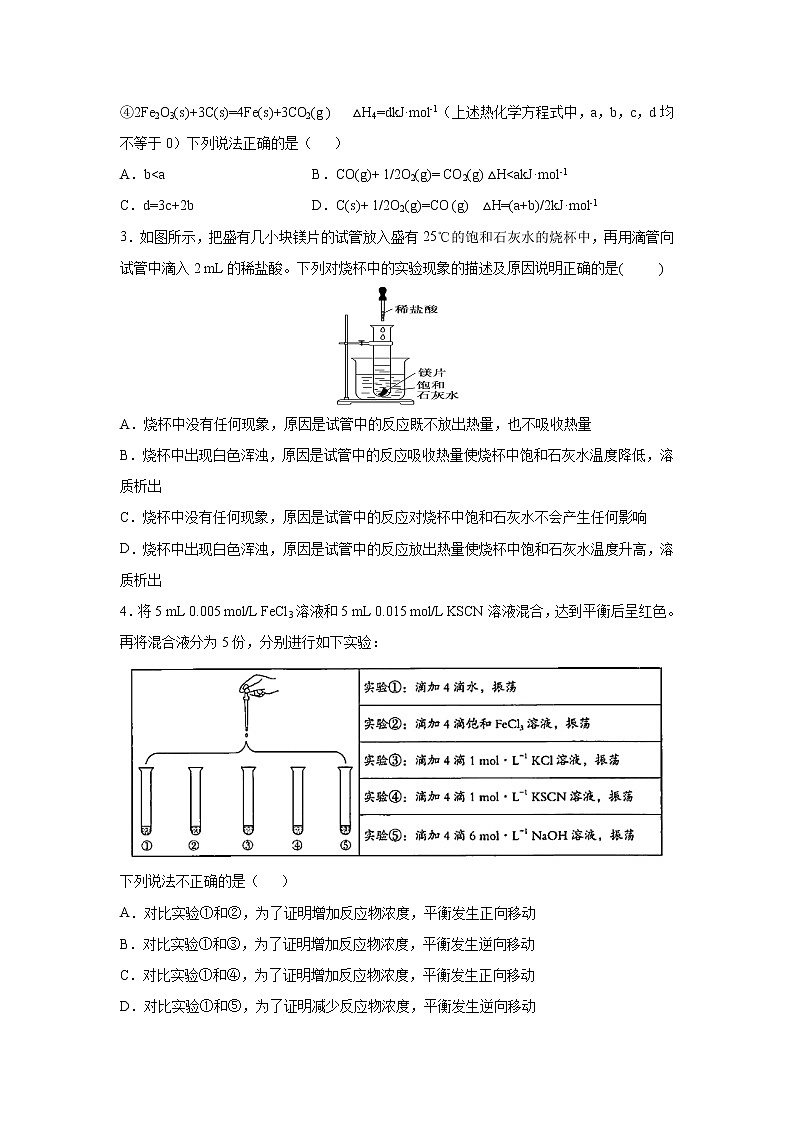
3.如图所示,把盛有几小块镁片的试管放入盛有25℃的饱和石灰水的烧杯中,再用滴管向试管中滴入2 mL的稀盐酸。下列对烧杯中的实验现象的描述及原因说明正确的是( )
A.烧杯中没有任何现象,原因是试管中的反应既不放出热量,也不吸收热量
B.烧杯中出现白色浑浊,原因是试管中的反应吸收热量使烧杯中饱和石灰水温度降低,溶质析出
C.烧杯中没有任何现象,原因是试管中的反应对烧杯中饱和石灰水不会产生任何影响
D.烧杯中出现白色浑浊,原因是试管中的反应放出热量使烧杯中饱和石灰水温度升高,溶质析出
4.将5 mL 0.005 mol/L FeCl3溶液和5 mL 0.015 mol/L KSCN溶液混合,达到平衡后呈红色。再将混合液分为5份,分别进行如下实验:
下列说法不正确的是( )
A.对比实验①和②,为了证明增加反应物浓度,平衡发生正向移动
B.对比实验①和③,为了证明增加反应物浓度,平衡发生逆向移动
C.对比实验①和④,为了证明增加反应物浓度,平衡发生正向移动
D.对比实验①和⑤,为了证明减少反应物浓度,平衡发生逆向移动
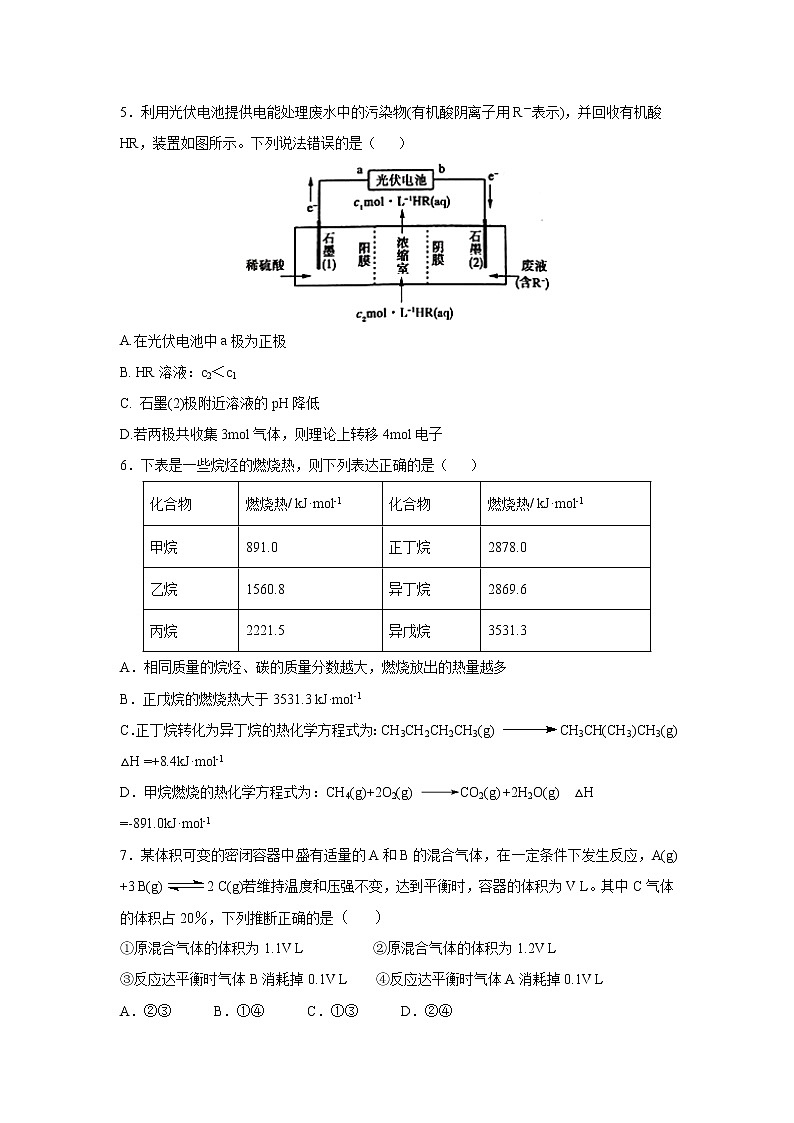
5.利用光伏电池提供电能处理废水中的污染物(有机酸阴离子用R-表示),并回收有机酸HR,装置如图所示。下列说法错误的是( )
A.在光伏电池中a极为正极
B. HR溶液:c2<c1
C. 石墨(2)极附近溶液的pH降低
D.若两极共收集3mol气体,则理论上转移4mol电子
6.下表是一些烷烃的燃烧热,则下列表达正确的是( )
化合物 | 燃烧热/ kJ·mol-1 | 化合物 | 燃烧热/ kJ·mol-1 |
甲烷 | 891.0 | 正丁烷 | 2878.0 |
乙烷 | 1560.8 | 异丁烷 | 2869.6 |
丙烷 | 2221.5 | 异戊烷 | 3531.3 |
A.相同质量的烷烃、碳的质量分数越大,燃烧放出的热量越多
B.正戊烷的燃烧热大于3531.3 kJ·mol-1
C.正丁烷转化为异丁烷的热化学方程式为:CH3CH2CH2CH3(g) CH3CH(CH3)CH3(g) △H =+8.4kJ·mol-1
D.甲烷燃烧的热化学方程式为:CH4(g)+2O2(g) CO2(g) +2H2O(g) △H =-891.0kJ·mol-1
7.某体积可变的密闭容器中盛有适量的A和B的混合气体,在一定条件下发生反应,A(g) +3 B(g) 2 C(g)若维持温度和压强不变,达到平衡时,容器的体积为V L。其中C气体的体积占20%,下列推断正确的是( )
①原混合气体的体积为1.1V L ②原混合气体的体积为1.2V L
③反应达平衡时气体B消耗掉0.1V L ④反应达平衡时气体A消耗掉0.1V L
A.②③ B.①④ C.①③ D.②④
8.对于一定条件下进行的化学反应:2SO3(g) 2SO2(g)+O2(g),改变下列条件,可以提高反应物活化分子百分数的是( )
①增大压强 ②升高温度 ③加入催化剂 ④增大反应物浓度
A.②③ B.①② C.①②③ D.①②④
9.根据如图有关图象,说法正确的是( )
A.由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的△H<0
B.由图Ⅱ知,反应在t6时刻,NH3体积分数最大
C.由图Ⅱ知,t3时采取降低反应体系温度的措施
D.图Ⅲ表示在10L容器、850℃时的反应,由图知,到4min时,反应放出51.6kJ的热量
10.下列实验装置符合实验目的的是( )
11.科研工作者对甘油(丙三醇)和辛酸合成甘油二酯的酶法合成工艺进行了研究。发现其它条件相同时,不同脂肪酶(Ⅰ号、Ⅱ号)催化合成甘油二酯的效果如图所示,此实验中催化效果相对最佳的反应条件是( )
A.24h,I号 B. 12h,I号 C.12h,II号 D.24h,II号
12.一定温度下,在某2 L恒容密闭容器中加入纳米级氧化亚铜并通入0.1 mol 水(g),发生如下反应:2H2O(g)2H2(g)+O2(g) ΔH=+484 kJ·mol-1。不同时间产生O2的物质的量见下表:
下列说法不正确的是( )
A.前20 min内的平均反应速率v(H2O)=5×10-5mol·L-1·min-1
B.达到平衡时,需要从外界吸收的能量为0.968 kJ
C.使用纳米级的氧化亚铜,可以增大平衡时氧气的体积分数
D.增大水的浓度,可以改变待反应的限度
13.电—Fenton法是用于水体里有机污染物降解的高级氧化技术,其反应原理如图所示,其中电解产生的H2O2与Fe2+发生Fenton反应,Fe2++H2O2=Fe3++OH-+•OH,生成的烃基自由基(•OH)能氧化降解有机污染物。下列说法正确的是( )
A.消耗1 molO2,电解池右边电极产生4mol •OH
B.电解池中只有O2和Fe3+发生还原反应
C.电解池左边电极的电势比右边电极的电势高
D.电解池工作时,右边电极附近溶液的pH增大
14.在如图所示的三个容积相同的容器①②③中进行如下反应:3A(g)+B(g) 2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
A.②①③ B.③①② C.①②③ D.③②①
15.在体积恒定的密闭容器中,一定量的二氧化硫与1.100mol氧气在催化剂作用下加热到600℃发生反应:2SO2+O22SO3。当气体的物质的量减少0.315mol时反应达到平衡,在相同温度下测得气体压强为反应前的82.5%。下列有关叙述正确的是( )
A.三氧化硫生成的速率与二氧化硫消耗的速率相等时反应达到平衡
B.降低温度,正反应速率减小,逆反应速率增大
C.达到平衡时,二氧化硫的转化率为90%
D.平衡混合气体通入过量氯化钡溶液中,得到沉淀的质量为161.980g
16.将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL。则下列说法错误的是( )
A.通入CH4的一端为原电池的负极,通入空气的一端为原电池的正极
B.0<V≤22.4 L时,电池总反应的化学方程式为CH4+2O2+2KOH=K2CO3+3H2O
C. V=33.6 L时,溶液中只存在阴离子CO32-
D. 22.4 L<V≤44.8 L时,负极电极反应为CH4-8e-+9 CO32-+3H2O = 10H CO3-
第II卷(非选择题,共52分)
二.实验题,本大题共2小题,共20分。
17.(本小题满分9分)
通过测定反应过程中所放出的热量可计算中和热。50mL 0.50mol/L盐酸与50mL 0.55 mol/LNaOH溶液在图示的装置中进行中和反应.回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是___________.
(2)大烧杯上如果不盖硬纸板,求得的中和热数值__________(填“偏大”,“偏小”或“无影响”).
(3)实验中改用60mL 0.50mol/L盐酸跟50mL 0.55mol/LNaOH溶液进行反应,与上述实验相比,所求中和热________(填“相等”“不相等”),简述理由:______________________.
(4)若两溶液的密度都是1g/mL,中和后所得溶液的比热容c=4.18J/(g·℃),三次平行操作测得终止温度与起始温度差(t2﹣t1)分别为:①3.2℃ ②2.2℃ ③3.0℃,写出表示盐酸与NaOH溶液反应的中和热的热化学方程式___________________________________.(小数点后保留一位小数)
18.(本小题满分11分)
某组甲乙同学进行稀硫酸与锌制取氢气的实验,请回答下列问题:
(1)甲同学发现加入少量硫酸铜溶液可加快氢气的生成速率。为了进一步研究硫酸铜的量对氢气生成速率的影响,设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
实验 混合溶液 | A | B | C | D | E | F |
4 mol·L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1=___,V6=___,V9=___;
②反应一段时间后,实验A中的金属呈___色,实验E中的金属呈___色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因 。
(2)乙同学为了探究锌与稀硫酸反应过程中的速率及能量的变化,进行以下实验,分析影响反应速率的因素。
实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1分钟内从a管流出的水滴数,得到的水滴数如下表所示:
1分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
1分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
分析反应过程中的水滴数,请回答:
① 由水滴数58>34、81>59,说明在反应初期,闭合K时比断开K时的反应速率快,主要原因是 。
② 由水滴数102>78,说明在反应后期,断开K时的反应速率快于闭合K时的反应速率,主要原因是 。
三.填空题,本大题共2小题,共32分。
19.(本小题满分16分)
环戊二烯()是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知:(g)= (g)+H2(g) ΔH1=100.3 kJ·mol −1 ①
H2(g)+ I2(g)=2HI(g) ΔH2=﹣11.0 kJ·mol −1 ②
对于反应:(g)+ I2(g)=(g)+2HI(g) ③ ΔH3=___________kJ·mol −1。
(2)某温度下,等物质的量的碘和环戊烯()在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为_________,该反应的平衡常数Kp=_________Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有__________(填标号)。
A.通入惰性气体 B.提高温度
C.增加环戊烯浓度 D.增加碘浓度
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是__________(填标号)。
A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时二聚体的浓度为0.45 mol·L−1
(4)环戊二烯可用于制备二茂铁(Fe(C5H5)2结构简式为),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
该电解池的阳极为____________,总反应为 。电解制备需要在无水条件下进行,原因为 。
20.(本小题满分16分)
钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展。
(1)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2SX)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如下图所示:
物质 | Na | S | Al2O3 |
熔点/℃ | 97.8 | 115 | 2050 |
沸点/℃ | 892 | 444.6 | 2980 |
①根据上右表数据,请你判断该电池工作的适宜应控制在____________(填字母)范围内。
A.100℃以下 B.100~300℃ C.300~350℃ D.350~2050℃
②放电时,电极A为_________极,电极B发生_________反应(填“氧化或还原”)
③充电时,总反应为Na2SX=2Na+xS(3<x<5),则阳极的电极反应式为:________________。
(2)若把钠硫电池作为电源,电解槽内装有KI及淀粉溶液如图所示,槽内的中间用阴离子交换膜隔开。通电一段时间后,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。则右侧发生的电极方程式:________________;试分析左侧溶液蓝色逐渐变浅的可能原因是:_____________________。
(3)若把钠硫电池作为电源,按如图所示装置进行实验电解乙池和丙池:
当钠硫电池中消耗0.05xmol的S时,理论上乙池中B极的质量增加__________g;此时丙装置中___________(填“c”或“d”)电极折出7.20g金属,则按丙装置中的的某盐溶液可能是__________________(填序号)。
a.MgSO4溶液 b.CuSO4溶液 c.NaCl溶液 d.AgNO3溶液
【参考答案】
一.选择题:本大题共16小题,每小题3,共48分。在每小题给出的四个选项中,只有1项符合题目要求。
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
C | D | D | B | C | B | D | A | D | B |
11 | 12 | 13 | 14 | 15 | 16 |
|
|
|
|
B | C | A | D | C | C |
|
|
|
|
二.实验题,本大题共2小题,共20分。
17.(本小题满分9分)环形玻璃搅拌棒 偏小 相等(此空1分,其余各2分)
因为中和热是指酸跟碱发生中和反应生成1 mol H2O所放出的能量,与酸碱的用量无关
HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=﹣51.8 kJ/mol
18.(本小题满分11分)
(1)①30 10 17.5(各1分) ②灰黑 暗红(各1分) ③当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,减少了Zn与溶液的接触面积(2分)
(2)①形成原电池反应速度快(2分)
②断开K时,溶液中的c(H+)大于闭合K时溶液中的c(H+),c(H+)的影响是主要因素(2分)
三.填空题,本大题共2小题,共32分。
19.(本小题满分16分) (各2分) (1). 89.3 (2). 40% 3.56×104 BD (3) CD
(4) Fe电极 Fe+2+H2↑(Fe+2C5H6Fe(C5H5)2+H2↑)
水会阻碍中间物Na的生成;水会电解生成OH−,进一步与Fe2+反应生成Fe(OH)2
20.(本小题满分16分)
(1)①C(2分)②负(1分)还原(1分)③SX2--2e-=xS(2分)
(2)2H2O+2e—=H2↑+2OH—(2H++2e—=H2↑)(2分)右侧溶液中生成的OH—通过阴离子交换膜进入左侧溶液,并与左侧溶液中I2反应等(2分)
(3)10.8(2分) d(2分) bd(2分)








