

【化学】黑龙江省大庆铁人中学2019-2020学年高二上学期开学考试
展开黑龙江省大庆铁人中学2019-2020学年高二上学期开学考试
试题说明:1、本试题满分100分,答题时间90分钟。
2、请将答案填写在答题卡上,考试结束后只交答题卡。
3、可能用到的相对原子质量:
H:1 C:12 N:14 O:16 S:32 Na:23 Fe:56 Cu:64 K:39 Zn:65
第Ⅰ卷 选择题部分(共54分)
一、选择题(本题共18小题,每小题只有一个选项正确,每小题3分,共54分)
1.“玉兔”号月球车用作为热源材料,下列关于的说法正确的是( )
A.与互为同位素 B.与互为同素异形体
C.与具有完全相同的化学性质 D.与具有相同的最外层电子
2.对于可逆反应:2SO2(g)+O2(g)2SO3(g),下列措施能使反应物中活化分子百分数和化学反应速率都变化的是( )
A.增大压强 B.升高温度 C.增加SO3浓度 D.多充入O2
3.已知A、B、C、D的原子序数都不超过18,它们的离子aA(n+1)+、bBn+、cC(n+1)-、dDn-均具有相同的电子层结构,则下列叙述正确的是( )
A.原子序数:a>b>c>d
B.单质还原性:B>A,单质氧化性:D>C
C.离子还原性:A(n+1)+>Bn+,离子氧化性:C(n+1)->Dn-
D.离子半径:A(n+1)+>Bn+>C(n+1)->Dn-
4.下列事实中,能说明氯的非金属性比硫强的是( )
①氯气与氢气化合比硫与氢气化合要容易进行 ②HCl比H2S稳定 ③盐酸酸性比氢硫酸强 ④常温下氯气是气态而硫是固态 ⑤H2S能被Cl2氧化成硫 ⑥SCl2分子中氯显﹣1价 ⑦HClO的氧化性比H2SO4的氧化性强 ⑧Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS.
A.①②③④⑤⑥⑦ B.①④⑤⑥⑦ C.①②⑤⑥⑧ D.③④⑤⑦⑧
5.在一定温度、不同压强(p1<p2)下,可逆反应:2X(g)2Y(s)+Z(g)中,生成物Z在反应混合物中的体积分数(φ)与反应时间(t)的关系有以下图示,其中正确的是( )
6.通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
化学键 | H—H | Cl—Cl | H—Cl |
生成1 mol化学键时放出的能量 | 436 kJ/mol | 243 kJ/mol | 431 kJ/mol |
则下列热化学方程式不正确的是 ( )
A.H2(g)+Cl2(g)===HCl(g)ΔH=-91.5 kJ/mol
B.H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ/mol
C.2HCl(g)===H2(g)+Cl2(g) ΔH=+183 kJ/mol
D.H2(g)+Cl2(g)===HCl(g)ΔH=+91.5 kJ/mol
7.下列有关热化学方程式的叙述正确的是 ( )
A.已知C(石墨,s)===C(金刚石,s) ΔH>0,则金刚石比石墨稳定
B.已知2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ/mol,则氢气的燃烧热为ΔH=-285.8 kJ/mol
C.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)===CH3COONa(aq)+H2O(l) ΔH=-57.4 kJ/mol
D.已知2C(s)+2O2(g)===2CO2(g) ΔH1;2C(s)+O2(g)===2CO(g) ΔH2,则ΔH1 >ΔH2
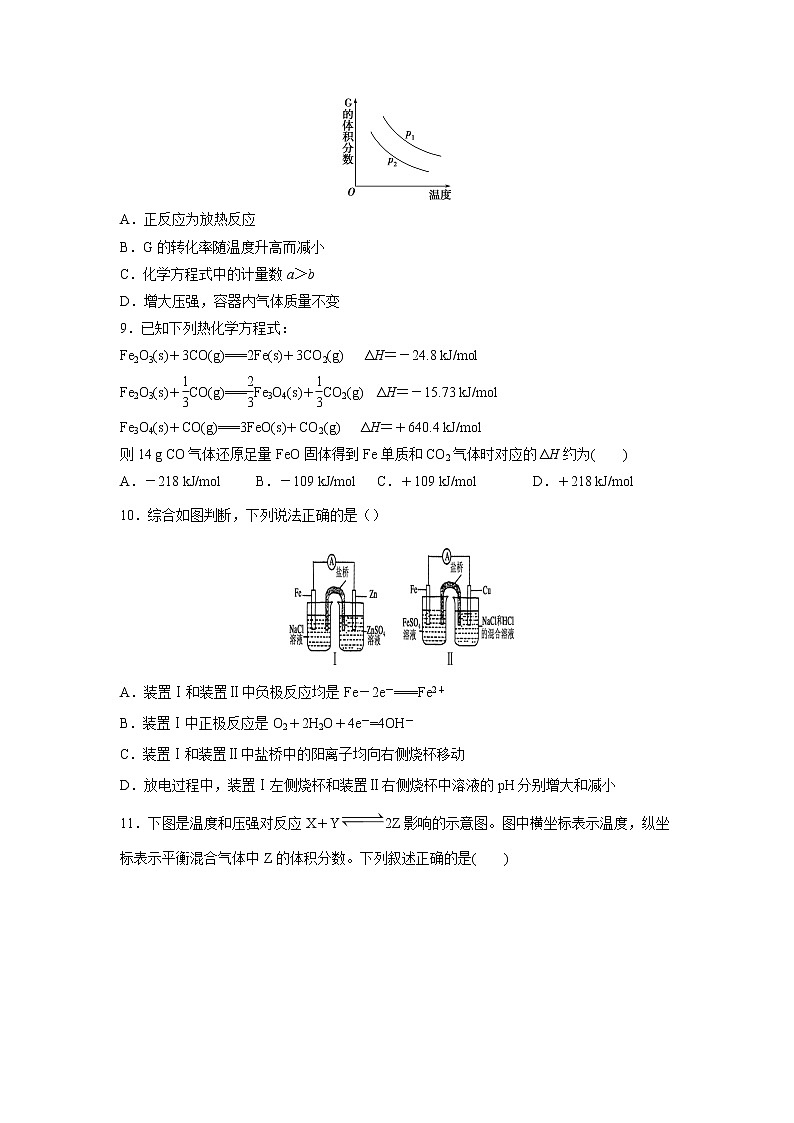
8.密闭容器中有如下反应:L(s)+aG(g) bR(g),温度和压强对该反应的影响如图所示,其中压强p1<p2,由此可判断( )
A.正反应为放热反应
B.G的转化率随温度升高而减小
C.化学方程式中的计量数a>b
D.增大压强,容器内气体质量不变
9.已知下列热化学方程式:
Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol
Fe2O3(s)+CO(g)===Fe3O4(s)+CO2(g) ΔH=-15.73 kJ/mol
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH=+640.4 kJ/mol
则14 g CO气体还原足量FeO固体得到Fe单质和CO2气体时对应的ΔH约为( )
A.-218 kJ/mol B.-109 kJ/mol C.+109 kJ/mol D.+218 kJ/mol
10.综合如图判断,下列说法正确的是()
A.装置Ⅰ和装置Ⅱ中负极反应均是Fe-2e-===Fe2+
B.装置Ⅰ中正极反应是O2+2H2O+4e-=4OH-
C.装置Ⅰ和装置Ⅱ中盐桥中的阳离子均向右侧烧杯移动
D.放电过程中,装置Ⅰ左侧烧杯和装置Ⅱ右侧烧杯中溶液的pH分别增大和减小
11.下图是温度和压强对反应X+Y2Z影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
A.上述可逆反应的正反应为放热反应
B.X、Y、Z均为气态
C.X和Y中最多只有一种为气态,Z为气态
D.上述反应的逆反应的ΔH>0
12. 已知:科学家制造出一种使用固体电解质的燃料电池,其效率更高。一个电极通入空气,另一电极通入汽油蒸汽,其中电池的电解质是掺杂了Y2O3(Y为钇)的ZrO2 (Zr为为锆)晶体,它在高温下能传导O2—离子。若以丁烷(C4H10)代表汽油,总反应为2 C4H10+13O2=8CO2+10H2O。有关该电池说法错误的是( )
A.该电池负极的电极反应式为:2C4H10+26O2-- 52e- = 8CO2+10H2O
B.O2-向负极移动
C.该电池正极的电极反应式为:O2+ 4e-+ 2H2O= 4OH-
D.丁烷在放电时发生氧化反应
13.将4 mol A气体和2 mol B气体在2 L的容器中混合,并在一定条件下发生反应:
2A(g)+B(g)2C(g),若经2 s 后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
②用物质A表示的反应的平均速率为0.3 mol·L-1·s-1
③2 s时物质A的转化率为70% ④2 s时物质B的浓度为0.7 mol·L-1
其中正确的是( )
A.①③ B.③④ C.②③ D.②④
14.按下图的装置进行电解实验:A极是铜锌合金,B极为纯铜,电解质中含有足量的铜离子。通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68克,溶液质量增加0.03克,则A合金中Cu、Zn原子个数比为( )
A. 4︰1 B. 2︰1 C. 3︰1 D.任意比
15.X、Y、Z都是短周期元素,在元素周期表中的位置如图所示:下列有关说法正确的是( )
A.原子半径:Z>Y>X
B.氢化物的稳定性:X>Y、Z>Y,可能X>Z
C.最高价氧化物对应的水化物酸性:Z>Y>X
D.三种元素形成的简单离子的半径:X<Y<Z
16.将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如右图(不考虑电极产物的溶解),则下列说法正确的是( )
A.阳极产物一定是Cl2,阴极产物一定是Cu
B.整个过程中阳极先产生Cl2,后产生O2
C.BC段表示在阴极上是H+放电产生了H2
D.CD段表示阳极上OH-放电破坏了水的电离平衡,产生了H+
17.用惰性电极电解一定浓度的硫酸铜溶液,长时间通电后,向所得溶液中加入0.2mol Cu(OH)2恰好恢复到电解前的浓度和pH。则电解过程中转移电子的总物质的量为 ( )
A.0.2mol B.0.6mol C.0.4mol D.0.8mol
18.有关下列四个常用电化学装置的叙述中,正确的是 ( )
图Ⅰ 碱性锌锰电池 | 图Ⅱ 铅硫酸蓄电池 | 图Ⅲ 电解精炼铜 | 图Ⅳ 银锌纽扣电池 |
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图Ⅱ所示电池放电过程中,硫酸浓度不断减小
C.图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图Ⅳ所示电池中,Ag2O是还原剂,电池工作过程中生成Ag
第Ⅱ卷 非选择题(共46分)
19.(12分)某同学设计如图装置,研究非金属元素性质变化规律。
已知:高锰酸钾在常温下与浓盐酸反应产生氯气,离子方程式为 。
(1)如果C中装饱和的H2S溶液,A中装浓盐酸,B中装高锰酸钾溶液,反应开始后观察到现象是C中产生淡黄色沉淀,证明氯的非金属性比硫的非金属性________(填“强”或“弱”或“无法判断”;请用电子式表示H2S的形成过程: 。
(2)利用如图装置证明Cl2氧化性强于I2的氧化性。则A中装浓盐酸,B中装入高锰酸钾
粉末, C中装入淀粉KI溶液,则C中现象是 。
(3)现有浓硝酸、大理石、澄清石灰水、硅酸钠溶液,选择试剂用如图装置证明:
非金属性:N > C > Si。C中装试剂____________,实验现象为 .
该装置存在不足之处,改进措施为: 。
20.(10分)(1)已知:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ/mol
②CH3OH(g)+3/2O2(g)===CO2(g)+2H2O(g) ΔH=-192.9 kJ/mol
由上述方程式可知:CH3OH的燃烧热________(填“大于”“等于”或“小于”)192.9 kJ/mol。
已知水的气化热为44 kJ/mol。则表示氢气燃烧热的热化学方程式为__________________。
(2)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。
已知:
①2NH3(g)+CO2(g)===NH2CO2NH4(s) ΔH=-159.5 kJ/mol
②NH2CO2NH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+116.5 kJ/mol
③H2O(l)===H2O(g) ΔH=+44.0 kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式____________________。
(3)已知:
①Fe(s)+1/2O2(g)===FeO(s) ΔH1=-272.0 kJ/mol
②2Al(s)+3/2O2(g)===Al2O3(s) ΔH2=-1675.7 kJ/mol
Al和FeO发生铝热反应的热化学方程式是___________________________________。
某同学认为,铝热反应可用于工业炼铁,你的判断是_____________(填“能”或“不能”),
你的理由是____________________________________。
21.(12分)已知铅蓄电池的工作原理为 ,现用如图1装置进行电解(电解液足量),测得当铅蓄电池中转移0.4mol电子时,铁电极的质量减少11.2g。请回答下列问题:
图1 图2
(1)A是铅蓄电池的________极,铅蓄电池正极反应式为:_______________________。
(2)Ag电极的电极反应式是___________________,该电极的电极产物共________g。
(3)Cu电极的电极反应式是_______________________________________________,
CuSO4溶液的浓度________(填“减小”“增大”或“不变”)。
(4)如图2表示电解进行过程中某个量(纵坐标x)随时间的变化曲线,则x表示________。
a.各U形管中产生的气体的体积
b.各U形管中阳极质量的减少量
c.各U形管中阴极质量的增加量
22.(12分)已知2A2(g)+B2(g)2C3(g) △H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的容积不变的密闭容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
(1)达到平衡时, A2的转化率为____________。
(2)达到平衡后,若向原容器中通入少量的氩气,A2的转化率将____________(填“增大“、“减小”或“不变”)
(3)恒压的密闭容器中发生可逆反应2A2(g)+B2(g)2C3(g) △H=-Q1 kJ/mol(Q1>0),在一定条件下达到化学平衡状态的标志是 ( )
A. v(A2):v(C3)=3:2 B. 反应混合气体的密度不再变化
C. 反应混合气体的平均摩尔质量不再变化 D.A2、B2两种反应物的转化率不再变化
E. A2、B2、C3三种物质的浓度相等 F. 密闭容器内的压强不再变化
(4)改变某一条件,得到如上图的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是____________;
a.反应速率c>b>a
b.达到平衡时A2的转化率大小为:b>a>c
c.T2>T1
d.b点A2和B2的物质的量之比为2:1
(5)若将上述容器改为恒压容器,起始时加入2 molA2和1 molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2__________Q4(填“>”、“<”或“=”)。
(6)下列措施可以同时提高反应速率和B2的转化率是___________(填选项序号)。
a.选择适当的催化剂 b.增大压强
c.及时分离生成的C3 d.升高温度
参考答案
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
D | B | B | C | D | D | B | C | B | B |
11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
|
|
C | C | D | C | B | B | D | B |
|
|
19. 离子方程式:略(2分)
(1)强(1分) ; H2S的形成过程:略(2分)
(2)淀粉-KI溶液变蓝色(2分) ;
(3)硅酸钠溶液(1分) ;有白色沉淀生成(2分) ; 在B、C之间加一个盛饱和NaHCO3溶液的洗气瓶(2分)
20.(1). 大于(1分) H2(g)+1/2O2(g)===H2O(l) ΔH=-124.6 kJ/mol(2分)
(2). 2NH3(g)+CO2(g)===CO(NH2)2(s)+H2O(l) ΔH=-87.0 kJ/mol (2分)
(3) . 3FeO(s)+2Al(s)===Al2O3(s)+3Fe(s) ΔH=-859.7 kJ/mol (2分)
不能 (1分) (6). 该反应的引发,需消耗大量能量,成本较高 (2分)
21.(1)负(1分); PbO2+4H++SO42-+2e-===PbSO4+2H2O(2分)
(2)2H++2e-===H2↑(2分) ; 0.4(2分)
(3)Cu-2e-===Cu2+(2分) ; 不变(1分)
(4)b(2分)
22. (每空2分)(1). (2). 不变 (3). BCD (4). ad (5). < (6). b








