
人教版九年级下册第十单元 酸和碱综合与测试单元测试复习练习题
展开一、单选题(共12小题)
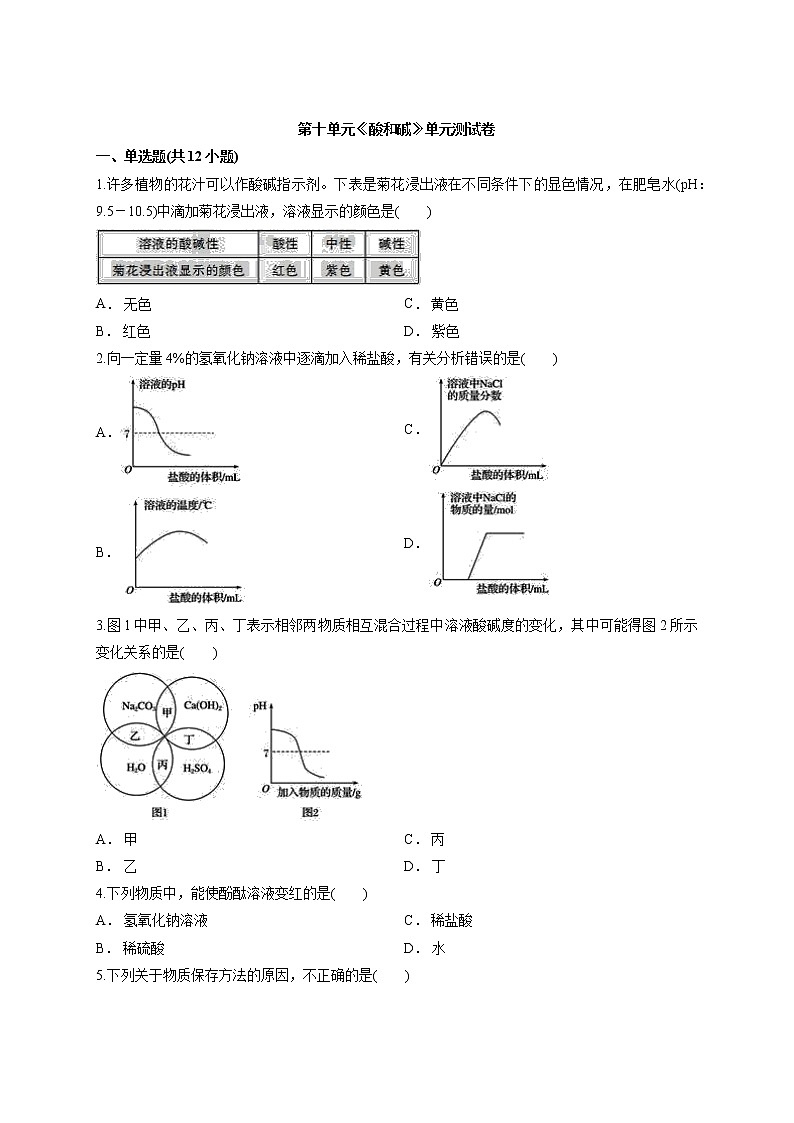
1.许多植物的花汁可以作酸碱指示剂。下表是菊花浸出液在不同条件下的显色情况,在肥皂水(pH:9.5-10.5)中滴加菊花浸出液,溶液显示的颜色是( )
A. 无色
B. 红色
C. 黄色
D. 紫色
2.向一定量4%的氢氧化钠溶液中逐滴加入稀盐酸,有关分析错误的是( )
A.
B.
C.
D.
3.图1中甲、乙、丙、丁表示相邻两物质相互混合过程中溶液酸碱度的变化,其中可能得图2所示变化关系的是( )
A. 甲
B. 乙
C. 丙
D. 丁
4.下列物质中,能使酚酞溶液变红的是( )
A. 氢氧化钠溶液
B. 稀硫酸
C. 稀盐酸
D. 水
5.下列关于物质保存方法的原因,不正确的是( )
A. 选项A
B. 选项B
C. 选项C
D. 选项D
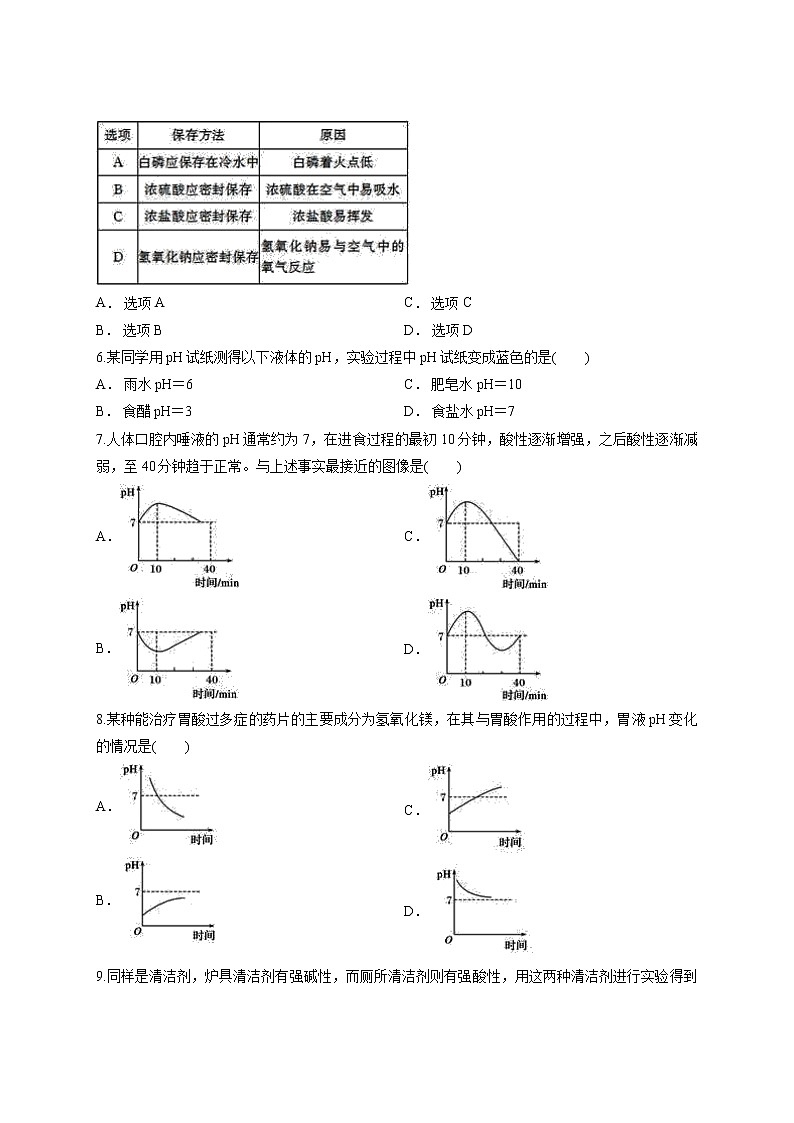
6.某同学用pH试纸测得以下液体的pH,实验过程中pH试纸变成蓝色的是( )
A. 雨水pH=6
B. 食醋pH=3
C. 肥皂水pH=10
D. 食盐水pH=7
7.人体口腔内唾液的pH通常约为7,在进食过程的最初10分钟,酸性逐渐增强,之后酸性逐渐减弱,至40分钟趋于正常。与上述事实最接近的图像是( )
A.
B.
C.
D.
8.某种能治疗胃酸过多症的药片的主要成分为氢氧化镁,在其与胃酸作用的过程中,胃液pH变化的情况是( )
A.
B.
C.
D.
9.同样是清洁剂,炉具清洁剂有强碱性,而厕所清洁剂则有强酸性,用这两种清洁剂进行实验得到的结果一定有误的是( )
A. 测得炉具清洁剂pH=13
B. 测得厕所清洁剂pH=8
C. 炉具清洁剂使无色酚酞溶液变红
D. 厕所清洁剂使紫色石蕊溶液变红
10.某同学用pH试纸测日常生活中一些液体的pH值,他的实验记录一定错误的是( )
A. 纯碱溶液的pH=11
B. 食醋的pH=8
C. 肥皂水pH=10
D. 酸梅汁pH=4
11.以下列举的事例中说法正确的是( )
A. 食用馒头可以补充糖类
B. 用含亚硝酸钠的工业用盐腌制食品
C. 服用大量含碳酸钙的药物来补钙
D. 用甲醛水溶液泡制水产品并出售
12.推理是一种重要的学习方法。下列推理正确的是( )
A. 任何化学反应都遵循质量守恒定律,因此任何物质发生化学反应都没有质量变化
B. 化合物是由多种元素组成的纯净物,则由多种元素组成的纯净物一定是化合物
C. 离子是带电的原子或原子团,则带电的粒子都有是离子
D. 碱能使酚酞溶液变红,因此能使酚酞溶液变红的物质一定是碱
二、填空题(共3小题)
13.正常雨水的pH<7,显酸性,其理由是_____________________________________
_______________________________________________________________________________。
人们通常把pH<______的雨水称为酸雨。土壤的pH范围在pH________或pH________时,农作物难以生长。
14.归纳是学习的重要方法,小芳在复习盐酸的性质时,归纳出盐酸的五条化学性质(如图1所示,连线表示相互反应);小明为表示反应实质绘制图2、图3。请根据下列图示和要求回答问题:
(1)图1中为了验证性质①,小红将紫色石蕊溶液滴加到盐酸溶液中,溶液变________色;图1中A所表示的物质类别是________。
(2)图2描述了氢氧化钠溶液与盐酸反应的微观实质,图2中A、B、C处应填入的化学式或离子符号依次为________;
(3)图3是镁和盐酸反应过程的微观示意图,从微观角度看,该反应有效相互作用的微粒是________(写微粒符号,下同),产生的新微粒是________。
15.有一气体混合物含有二氧化碳、一氧化碳、氮气和水蒸气四种气体,现进行如下操作,请回答:(假设每步反应都进行完全)
(1)依次通过NaOH溶液、浓硫酸,此过程中发生反应的化学方程式为
________________________________________________________________________;
(2)依次通过浓硫酸、炽热的氧化铁粉末,最后得到的气体有________(填化学式)。
三、实验与探究(共3小题)
16.在一支试管中放入一小段镁条(已擦去氧化膜),再向试管中加入一定量的盐酸,镁条表面有________产生,反应的化学方程式是_______________________________
________________________________________________________________________。
[发现问题]为了再次观察上述反应现象,小林同学用较长的镁条重做上述实验,但发现了异常现象,试管中出现了白色沉淀。
[实验验证1]小林同学针对两次实验的不同,设计对比实验方案,探究出现异常现象的原因。
[得出结论]镁条与盐酸反应产生白色沉淀与________有关。
[追问]白色沉淀是什么物质?
[查阅资料]①20 ℃时,100 g水中最多能溶解氯化镁54.8 g;
②镁能与热水反应产生一种碱和氢气;
③氯化银既不溶于水也不溶于稀硝酸。
[做出猜想]猜想一:镁;猜想二:氯化镁;猜想三:氢氧化镁,猜想的依据是
________________________________________________________________________
________________________________________________________________________(用化学方程式表示)。
[实验验证2]将白色沉淀洗涤干净,分别取少量沉淀于A、B、C试管中,进行如表实验:
17.小亮在做“盐酸中和氢氧化钠溶液”的实验时,滴加盐酸前忘了加入指示剂,导致无法判断该中和反应进行的程度,于是他对所得的溶液的酸碱性进行了探究。
[探究目的]探究所得溶液的酸碱性
[提出猜想]所得溶液可能呈碱性,也可能呈________性,还可能呈________性。
[实验验证]
[分析与思考]
(1)若溶液呈碱性,则溶液中使其呈碱性的离子是______(填写微粒符号),为避免碱性溶液污染环境,小亮对所得溶液进行了如下处理:向溶液中逐滴加入________溶液,直到不再产生沉淀为止。然后过滤,把滤液倒入蒸发皿中加热,得到氯化钠晶体,该过程涉及的化学反应的方程式为____________________________________________________________________
______________________________________________________________________________。
(2)若无色酚酞溶液不变色,为了进一步确定溶液的酸碱性,小亮提出以下方案:
方案一:取样,加入碳酸钠溶液,若观察到___________________________________________,
则所取溶液呈酸性;若无明显现象,则呈中性。
方案二:取样,加入金属锌,若有气泡产生,则所取溶液呈酸性,该反应的化学方程式为
________________________________________________________________________
________________________________________________________________________;
若无明显现象,则呈中性。
18.在一次化学实验课上,老师让同学们对两个实验进行探究。
实验一:探究氢氧化钠溶液中是哪一种粒子能使无色酚酞溶液变色
[猜想]可能是水分子、钠离子或氢氧根离子使无色酚酞溶液变色。
[实验]
(1)在第一支试管中加入约2 mL蒸馏水,滴入几滴无色酚酞溶液。现象:溶液不变色;
(2)在第二支试管中加入约2 mL氯化钠溶液,滴入几滴无色酚酞溶液。现象:
________________________________________________________________________;
(3)在第三支试管中加入约2 mL氢氧化钠溶液,滴入几滴无色酚酞溶液。现象:
________________________________________________________________________。
[结论]________________________________________________________________________。
实验二:用注射器向充满某种气体的软塑料瓶中注入一种液体(如图),振荡,发现塑料瓶变瘪,探究气体和液体可能是什么物质?
[猜想]气体和液体可能是________(写一组即可)。
[实验]用试管取少量实验后塑料瓶中的溶液,加入试剂________,产生相应的现象,其化学方程式为________________________________________________________________________。
[评价]上述实验完成后,能否验证你的猜想________,理由是____________________________。
四、计算题(共1小题)
19.某化学活动小组用稀盐酸对赤铁矿中Fe2O3含量进行测定(杂质不与盐酸反应且不溶于水),得到一黄色残液。为防止直接排放造成环境污染,对其进行了处理,过滤该残液,取100 g滤液,向其中不断加入某未知溶质质量分数的氢氧化钠溶液,所得
实验数据如下表:
(资料:FeCl3+3NaOH===Fe(OH)3↓+3NaCl)
通过对上述实验数据的分析,选择合理的数据,计算所加氢氧化钠溶液中溶质的质量分数。
答案解析
1.【答案】C
【解析】根据已有的知识进行分析,肥皂水呈碱性,据此解答。
2.【答案】D
【解析】A项,开始的时候是氢氧化钠的溶液,溶液显碱性,pH会大于7,随着和盐酸的反应,氢氧化钠减少,溶液的pH变小,当二者恰好反应时pH为7,当继续加入盐酸后,溶液会变为酸性,pH小于7,正确;B项,因为反应产生热量,温度会上升,正确;C项,反应过程中产物氯化钠会不断增加,氯化钠的质量分数会变大,当反应结束,氯化钠的物质的量不再变化,而继续加入盐酸,溶液的质量会变大,所以氯化钠的质量分数会变小,正确。
3.【答案】D
【解析】由图2可以看出该反应是碱性溶液与酸性溶液相互结合至恰好反应,此时pH等于7,再滴加酸液溶液会显酸性,pH小于7,利用这一过程对图1进行分析判断即可。
4.【答案】A
【解析】酸性和中性溶液不能使无色酚酞变色,碱性溶液能使无色酚酞变红,A项氢氧化钠溶液是碱性的,BC是酸性的,D项水呈中性。
5.【答案】D
【解析】氢氧化钠易吸收空气中水分潮解,还易与空气中的二氧化碳反应而变质,所以要密封保存。
6.【答案】C
【解析】本题主要考查学生对pH试纸变色与酸碱性的关系。pH试纸变为蓝色,说明溶液显碱性,pH应大于7。
7.【答案】B
【解析】在进食过程的最初10分钟,酸性逐渐增强,溶液的pH应该减小;之后酸性逐渐减弱,溶液的pH应该增大。B图中的曲线变化符合这一情况。故选B。
8.【答案】B
【解析】明确中和反应的原理、酸碱的溶解性、pH变化与溶液的酸碱性的关系,是解题的关键。胃酸的主要成分是盐酸,人的胃液的pH在0.9~1.5,酸度再高就会患胃酸过多症。用氢氧化镁中和时,可使胃液酸性逐渐减弱,pH升高,但pH不会超过7。因为氢氧化镁难溶于水,在溶液中不能解离出OH-,故溶液不会呈碱性,所以B项正确。
9.【答案】B
【解析】本题考查学生区分物质酸碱性的能力。A项,炉具清洁剂有强碱性,其pH>7;B项,厕所清洁剂具有强酸性,其pH<7;C项,炉具清洁剂有强碱性,使无色的酚酞溶液变红;D项,厕所清洁剂具有强酸性,使紫色石蕊溶液变红。
10.【答案】B
【解析】根据所学知识可知A选项纯碱溶液显碱性是正确的;B选项食醋溶液显酸性,是错误的叙述;C选项肥皂水显碱性是正确的叙述;D选项酸梅汁溶液显酸性是正确的叙述;故选B。
11.【答案】A
【解析】A项,馒头中富含有大量的淀粉,淀粉就属于糖类,正确;B项,含亚硝酸钠的工业用盐有毒不能食用,不能用来腌制食品,错误;C项,补钙要通过食物补充,而不是通过含碳酸钙的药物,错误;D项,甲醛能使蛋白质失去生理活性,所以甲醛有毒不能用来浸泡水产品,错误。
12.【答案】B
【解析】A项,参加化学反应的物质的总质量等于生成物的总质量,而不是各自的质量保持不变,错误;C项,质子和电子也带电,错误;D项,显碱性的物质,如Na2CO3,不一定是碱,错误。
13.【答案】空气中的二氧化碳溶于水生成碳酸的缘故 5.6 <4 >8
【解析】根据雨水因溶有空气中的二氧化碳(生成碳酸)而略显酸性;人们通常把pH小于5.6的降水成为酸雨;农作物适合生长土壤的pH范围是4~8分析解答。
14.【答案】(1)红 碱 (2)OH-、H+、H2O (3)Mg、H+ H2、Mg2+
【解析】稀盐酸能使石蕊溶液变红色,能和碱发生中和反应;根据图中提供的信息可以进行相关方面的判断。
15.【答案】(1) 2NaOH+CO2===Na2CO3+H2O
(2)CO2、N2
【解析】会写出酸碱中和反应的化学方程式,第(2)题考查了浓硫酸的吸水性和一氧化碳的还原性。
16.【答案】气泡 Mg+H2SO4===MgSO4+H2↑
[得出结论]镁条长度
[做出猜想]Mg+2H2O===Mg(OH)2+H2↑
[实验验证2]没有气泡产生 消失 不消失 Ag+
【解析】镁与稀硫酸反应生成硫酸镁溶液和氢气,在一支试管中放入一小段镁条(已擦去氧化膜),再向试管中加入一定量的盐酸,镁条表面有气泡产生,
反应的化学方程式是Mg+H2SO4===MgSO4+H2↑。
[做出猜想]由小林同学的实验,镁条长度越长,产生白色沉淀越多,则镁条与盐酸反应产生白色沉淀与镁条长度有关。
由题意,镁能与热水反应产生一种碱和氢气,即镁与热水反应生成氢氧化镁沉淀和氢气,猜想三为氢氧化镁,反应的化学方程式为Mg+2H2O===Mg(OH)2+H2↑。
[实验验证2]A项,镁与稀盐酸反应生成氯化镁和氢气,由实验结论,猜想一不正确,但这种白色沉淀能溶于盐酸,则没有气泡产生,白色沉淀消失。
B项,20 ℃时,100 g水中最多能溶解氯化镁54.8 g,易溶于水,由实验结论,猜想二不正确,则加入足量水,白色沉淀不消失。
C项,加入适量稀硝酸,白色沉淀消失,说明白色沉淀能与酸反应;继续滴加几滴硝酸银溶液,出现大量白色沉淀,说明生成了不溶于硝酸的白色沉淀,次沉淀应为氯化银沉淀,则原白色沉淀中含有的离子是:Mg2+、Ag+。
17.【答案】酸 中 红 酸性或中性
(1)OH- CuCl2(答案合理即可) 2NaOH+CuCl2===Cu(OH)2↓+2NaCl(答案合理即可)
(2)产生气泡 Zn+2HCl===ZnCl2+H2↑
【解析】酸、碱中和反应时有三种可能:①酸和碱恰好中和,pH=7,②酸有剩余,pH<7,③碱有剩余,pH>7;使溶液呈酸性的离子是H+,使溶液呈碱性的离子是OH-;呈酸性的溶液加入活泼金属,可产生氢气或加入Na2CO3溶液可产生CO2进行检验。
18.【答案】实验一:(2)溶液不变色 (3)溶液由无色变为红色 NaOH溶液中是OH-使无色酚酞溶液变为红色
实验二:CO2和NaOH溶液(合理均可) 盐酸 Na2CO3+2HCl===2NaCl+CO2↑+H2O 不能,因上述实验只能验证气体可能是CO2,而不能确定是何碱液
【解析】实验一:(1)蒸馏水中只含有水分子,滴入几滴无色酚酞溶液,溶液不变色,说明水分子不能使酚酞溶液变红。
(2)用试管取约2 mL氯化钠溶液,滴入1~2滴无色酚酞溶液,会观察到溶液不变色,说明钠离子不能使酚酞溶液变红。
(3)用试管取约2 mL氢氧化钠溶液,滴入1~2滴无色酚酞溶液,振荡,会观察到溶液由无色变为红色,说明NaOH溶液中是OH-使无色酚酞溶液变为红色。
实验二:二氧化碳气体与氢氧化钠溶液反应生成碳酸钠和水,从而造成瓶内气体压强减小,在外界大气压的作用下塑料瓶变瘪。
取少量实验后塑料瓶中的溶液是碳酸钠溶液,滴加稀盐酸,碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式为Na2CO3+2HCl===2NaCl+CO2↑+H2O;可观察到有气泡产生,塑料瓶重新鼓起来。
上述实验完成后,由于只能验证气体可能是CO2,而不能确定是何碱液,故不能验证猜想说法正确。
19.【答案】设与生成2.14 g-1.07 g氢氧化铁所消耗的20 g溶液中NaOH溶质的质量为x。
答:氢氧化钠溶液中溶质的质量分数为6%。
【解析】从表中加入的氢氧化钠可以看出40 g以前没有生成沉淀,是在中和盐酸,140 g和160 g氢氧化钠都是生成沉淀5.35 g,由于无法判断是否是60 g才开始沉淀,和140才完全沉淀,所以不能利用以上数值。但是从60到80,可以判定20 g氢氧化钠一定对应2.14 g-1.07 g沉淀氢氧化铁沉淀。所以以此为计算依据。
初中人教版第十单元 酸和碱综合与测试当堂检测题: 这是一份初中人教版第十单元 酸和碱综合与测试当堂检测题,共9页。试卷主要包含了单选题,实验题,推断题,科学探究题,计算题等内容,欢迎下载使用。
初中第十单元 酸和碱综合与测试课后测评: 这是一份初中第十单元 酸和碱综合与测试课后测评,共12页。试卷主要包含了单选题,填空题,实验与探究等内容,欢迎下载使用。
初中化学人教版九年级下册第十单元 酸和碱综合与测试课时作业: 这是一份初中化学人教版九年级下册第十单元 酸和碱综合与测试课时作业,共16页。试卷主要包含了单选题,填空题,实验题,推断题,计算题等内容,欢迎下载使用。